Niektóre atomy są bardziej polarne niż inne z powodu tego, że są bardziej „chciwe” dla elektronów.
Spójrz na swój układ okresowy, im bardziej w prawo i w górę, tym bardziej elektronegatywne stają się atomy (nie licząc gazów szlachetnych, ponieważ mają pełne powłoki i są „szczęśliwe” i nie potrzebują żadnych elektronów walencyjnych).
Myślę, że każdy słyszał, że Mąka (F), na przykład, jest jednym z najbardziej elektronegatywnych pierwiastków, dosłownie wyrwie elektrony z atomów wodoru lub węgla. Tak samo będzie Chlor (Cl)
Check out this image:
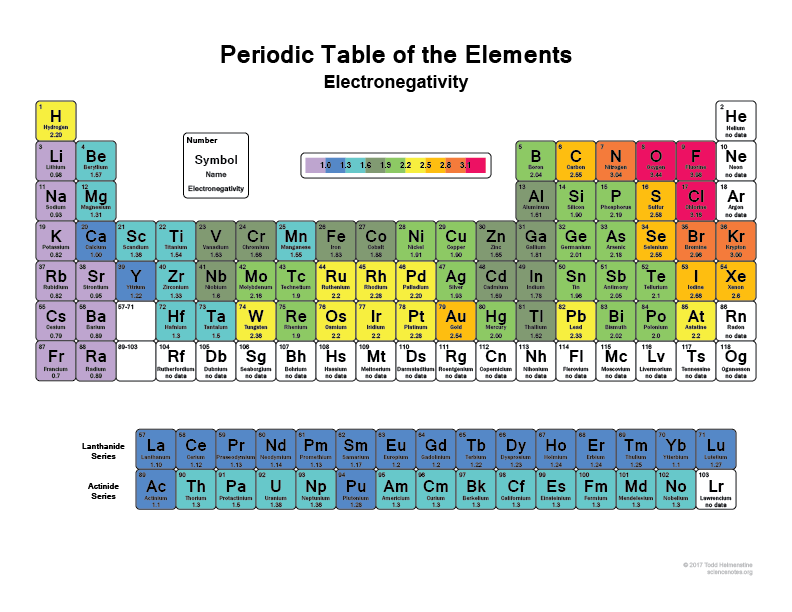
That’s why when a bond some molecules have super polar regions because they have something like Hydrogen bonding with something like Flourine that just basically has the electrons with it most of the time.
To pytanie może być również wyjaśnione przez ideę chmur elektronowych i fakt, że więcej elektronegatywnych atomów zazwyczaj będzie miało więcej elektronów pozostających z nim przez większość czasu w porównaniu do nie tak bardzo elektronegatywnych atomów.

To się nazywa moment dipolowy i bez zagłębiania się za bardzo w to widzisz jak większość elektronów jest bliżej tlenu niż wodoru (ponieważ tlen jest bardziej elektronegatywny niż wodór)
Przy okazji słowo elektronegatywny brzmi czasem sprzecznie z intuicją ale jest to elektro-negatywny zamiast pozytywnego ponieważ w chemii atomy które zyskują elektrony mają negatywny znak (Ex: #Cl^-# jest chlorem który zyskał elektron).