
Brønsted w swoim laboratorium
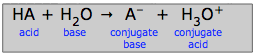
Zgodnie z koncepcją Brønsteda-Lowry’ego, proces, który wcześniej był zapisany jako prosta dysocjacja ogólnego kwasu HA (HA → H+ + A-), jest bardziej poprawnie traktowany jako proces przeniesienia protonu:
HA + H2O → A-+ H3O+(3-1)
Pomysł, ponownie, jest taki, że proton, po opuszczeniu kwasu, musi skończyć przyłączony do czegoś (co nazywamy zasadą;) nie może po prostu pływać wokół jako wolny jon wodorowy.
- Koniugatowe pary kwas-zasada
- Silne kwasy i słabe kwasy
- Definicja „mocnego” kwasu
- Efekt niwelacji
- Słabe kwasy
- Silne kwasy mają słabe zasady sprzężone
- Sole słabych kwasów rozpuszczają się dając roztwory zasadowe
- Jedynymi powszechnie występującymi silnymi zasadami są wodorotlenki grupy 1
- Sole słabych zasad dają roztwory kwaśne
- Autoprotoliza
- Amfolity
- Układ kwasowo-zasadowy węglanowy
Koniugatowe pary kwas-zasada
Reakcja kwasu z zasadą jest więc reakcją wymiany protonów; jeżeli kwas oznaczymy przez AH, a zasadę przez B, to uogólnioną reakcję kwasowo-zasadową możemy zapisać jako
AH + B → A- + BH+(3-2)
Zauważmy, że reakcja odwrotna do tej reakcji,
BH+ + A- → B + AH(3-3)
jest również reakcją kwasowo-zasadową. Ponieważ reakcje przeniesienia protonu są odwracalne, wynika z tego, że przeniesienie protonu z kwasu do zasady musi koniecznie utworzyć nową parę gatunków, które mogą, przynajmniej w zasadzie, stanowić własną parę kwasowo-zasadową, którą określamy jako sprzężoną parę kwasowo-zasadową:
Termin sprzężony oznacza „połączony z”, co oznacza, że człony każdej sprzężonej pary są „połączone” obecnością lub brakiem jednego protonu.
To, które gatunki są uważane za „sprzężone” zależy od kierunku, w którym zapisana jest reakcja, jak pokazano poniżej dla przeniesienia protonu w (3-1):


Podobnie, dla uogólnionych przeniesień protonu (3-2) i (3-3), mamy


W poniższej tabeli przedstawiono pary sprzężone kilku typowych układów kwasowo-zasadowych.
| kwas | zasada | ||
| kwas chlorowodorowy | HCl | jon chlorkowy | Cl- |
| kwas octowy | CH3CH2COOH | jon octanowy | CH3CH2COO- |
| kwas azotowy | HNO3 | jon azotanowy | NO3- |
| jon dwuwodorofosforanowy | H2PO4- | jon monowodorofosforanowy | HPO42- |
| jon wodorosiarczanowy | HSO4- | jon siarczanowy | SO42- |
| jon wodorosiarczanowy jon węglanowy („wodorowęglanowy”) | HCO3- | jon węglanowy | CO32- |
| jon amonowy | NH4+ | ||
| jon amonowy | amoniak | NH3 | |
| jon żelaza(III) („żelazny”) | Fe(H2O)63+ | pentaaquoironIII | Fe(H2O)5OH2+ |
| woda | H2O | jon wodorotlenkowy | OH- |
| jon hydroniowy | H3O+ | woda | H2O |
Silne kwasy i słabe kwasy
Możemy spojrzeć na uogólnioną reakcję kwas – zasada
.zasadę
jako współzawodnictwo dwóch zasad o proton:

Definicja „mocnego” kwasu
Jeśli zasada H2O przeważnie wygrywa tę walkę, to o kwasie HA mówi się, że jest mocnym kwasem. Tak właśnie dzieje się z kwasem solnym i innymi popularnymi mocnymi „kwasami mineralnymi” H2SO4, HNO3 i HClO4:
Roztwory tych kwasów w wodzie są tak naprawdę roztworami gatunków jonowych pokazanych pogrubioną czcionką po prawej stronie. Z tego wynika, że to, co nazywamy na przykład 1 M roztworem „kwasu solnego” w wodzie, w rzeczywistości nie zawiera w ogóle znaczącego stężenia HCl; jedynym prawdziwym kwasem obecnym w takim roztworze jest H3O+!
Z tych rozważań wynikają dwie ważne zasady, które trzeba nie tylko znać, ale i rozumieć:
H3O+ jest najsilniejszym kwasem, jaki może istnieć w wodzie;
Wszystkie silne kwasy wydają się być równie silne w wodzie.
Efekt niwelacji
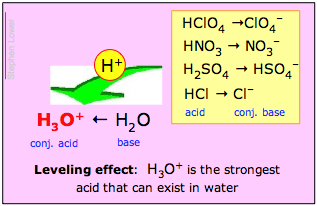
Drugie z tych stwierdzeń nosi nazwę efektu niwelacji. Oznacza on, że chociaż siły protonowo-donorowe silnych kwasów różnią się między sobą, wszystkie one są całkowicie zdysocjowane w wodzie. Chemicy mówią, że ich siły są „wyrównane” przez rozpuszczalnik water.
Porównywalny efekt byłoby widać, jeśli jeden próbował ocenić siły kilku dorosłych przez prowadzenie serii konkursów holowania z małym dzieckiem. Można by się spodziewać, że dorośli wygraliby w przeważającej większości w każdej próbie; ich siły zostałyby „wyrównane” przez siły dziecka.
Słabe kwasy
Większość kwasów, jednak są w stanie trzymać się swoich protonów mocniej, więc tylko niewielka część kwasu jest zdysocjowany. Tak więc kwas cyjanowodorowy, HCN, jest słabym kwasem w wodzie, ponieważ proton jest w stanie dzielić się elektronami pary samotnej jonu cyjankowego CN- bardziej skutecznie niż może z tymi z H2O, więc reakcja
HCN + H2O → H3O+ + CN-
postępuje tylko w bardzo małym stopniu.
Ponieważ mocny kwas wiąże swój proton tylko słabo, podczas gdy słaby kwas wiąże go mocno, możemy powiedzieć, że
Silne kwasy są „słabe”; Słabe kwasy są „mocne”
Jeśli jesteś w stanie wyjaśnić ten pozorny paradoks, rozumiesz jedną z najważniejszych idei w chemii kwasowo-zasadowej!
|
reakcja
|
kwas
|
baza
|
sprzężony kwas
|
sprzężona zasada
|
| 1) autojonizacja wody H2O | H2O | H2O | H3O+ | OH- |
| 2) jonizacja kwasu cyjanowodorowego HCN | HCN | H2O | H3O+ | CN- |
| 3) jonizacja amoniaku NH3 w wodzie | NH3 | H2O | NH4+ | OH-. |
| 4) hydroliza chlorku amonu NH4Cl | NH4+ | H2O | H3O+ | NH3 |
| 5) hydroliza octanu sodu CH3COO- Na+ | H2O | CH3COO- | CH3COOH | OH- |
| 6) neutralizacja HCl przez NaOH | HCl | OH- | H2O | Cl- |
| 7) neutralizacja NH3 kwasem octowym | CH3COOH | NH3 | NH4+ | CH3COO- |
| 8) rozpuszczanie BiOCl (tlenochlorku bizmutu) przez HCl | 2 H3O+ | BiOCl | Bi(H2O)3+ | H2O, Cl- |
| 9) rozkład Ag(NH3)2+ przez HNO3 | 2 H3O+ | Ag(NH3)2+ | NH4+ | H2O |
| 10) wypieranie HCN przez CH3COOH | CH3COOH | CN- | HCN | CH3COO- |
Silne kwasy mają słabe zasady sprzężone
To jest tylko ponownestwierdzenie tego, co jest zawarte w tym, co zostało powiedziane powyżej o rozróżnieniu między silnymi kwasami i słabymi kwasami. Fakt, że HCl jest silnym kwasem implikuje, że jego sprzężona zasada Cl- jest zbyt słabą zasadą, aby utrzymać proton w konkurencji z H2O lub H3O+. Podobnie, jon CN- wiąże się silnie z protonem, co czyni HCN słabym kwasem.
Sole słabych kwasów rozpuszczają się dając roztwory zasadowe
Fakt, że HCN jest słabym kwasem oznacza, że jon cyjankowy CN- łatwo reaguje z protonami, a więc jest stosunkowo dobrą zasadą. Jako dowód tego, sól taka jak KCN, po rozpuszczeniu w wodzie, daje lekko zasadowy roztwór:
CN- + H2O → HCN + OH-
Reakcja ta jest nadal czasami określana starą nazwą hydroliza („rozszczepianie wody”), która jest dosłownie poprawna, ale ma tendencję do zaciemniania jej tożsamości jako kolejnej reakcji kwasowo-zasadowej. Reakcje tego typu zachodzą tylko w niewielkim zakresie; 0,1M roztwór KCN jest nadal, dla wszystkich praktycznych celów, 0,1M w jonach cyjankowych.
Jedynymi powszechnie występującymi silnymi zasadami są wodorotlenki grupy 1
Jedynymi naprawdę silnymi zasadami, z którymi można się spotkać w codziennej chemii są wodorotlenki metali alkalicznych, takie jak NaOH i KOH, które są zasadniczo roztworami jonu wodorotlenkowego (i oczywiście kationu.Większość innych związków zawierających jony wodorotlenkowe, takich jak Fe(OH)3 i Ca(OH)2 nie są wystarczająco rozpuszczalne w wodzie, aby dawać roztwory silnie alkaliczne, więc nie są one zwykle uważane za silne zasady.
W rzeczywistości istnieje wiele zasad, które są silniejsze niż jon wodorotlenkowy – najbardziej znane to jon tlenkowy O2- i jon amidowy NH2-, ale są one tak silne, że mogą nawet pozbawić wodę protonu:
O2- + H2O → 2 OH-
NH2- + H2O → NH3 + OH-
W ten sposób powstaje ten sam rodzaj efektu wyrównywania, który opisaliśmy dla kwasów, czego konsekwencją jest to, że
Sole słabych zasad dają roztwory kwaśne
Najczęstszym tego przykładem jest chlorek amonu, NH4Cl, którego roztwory wodne są wyraźnie kwaśne:
NH4+ + H2O → NH3 + H3O+
Ponieważ ta (i podobne) reakcje zachodzą tylko w niewielkim stopniu, roztwór chlorku amonu będzie tylko lekko kwaśny.
Autoprotoliza
Z niektórych przykładów podanych powyżej, widzimy, że woda może działać jako kwas
CN- + H2O → HCN + OH-
i jako zasada
NH4+ + H2O → NH3 + H3O+
Jeśli tak jest, to nie ma powodu, dla którego „woda-kwas” nie może oddać protonu „wodzie-azie”:

Reakcja ta znana jest jako autoprotoliza wody.
Chemicy nadal często odnoszą się do tej reakcji jako „dysocjacji” wody i używają równania w stylu Arrheniusa H2O → H+ + OH- jako pewnego rodzaju skrótu.
Jak omówiono w poprzedniej lekcji, proces ten zachodzi tylko w niewielkim stopniu. Oznacza to jednak, że zarówno jony hydroniowe jak i wodorotlenkowe są obecne w każdym roztworze wodnym.
Czy inne ciecze mogą wykazywać autoprotolizę? Odpowiedź brzmi: tak. Najbardziej znanym przykładem jest ciekły amoniak:
2 NH3 → NH4+ + NH2-
Nawet czysty ciekły kwas siarkowy może grać w tę grę:
2 H2SO4→ H3SO4+ + HSO4-
Każdy z tych rozpuszczalników może być podstawą własnego „systemu” kwasowo-zasadowego, równoległego do znanego „systemu wodnego”.
Amfolity
Woda, która może działać zarówno jako kwas lub zasada, jest określana jako amfiprotyczna: może „obracać się w obie strony”. Substancja taka jak woda, która jest amfiprotyczna, jest nazywana amfolitem.
Jak wskazano tutaj, jon wodorotlenkowy może być również amfolitem, ale nie w roztworze wodnym, w którym jon tlenkowy nie może istnieć.
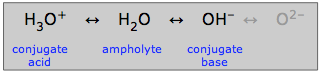
To oczywiście amfiprotyczna natura wody pozwala jej odgrywać szczególną rolę w zwykłej wodnej chemii kwasowo-zasadowej. Ale wiele innych substancji amfiprotycznych może również istnieć w roztworach wodnych. Każda taka substancja zawsze będzie miała sprzężony kwas i sprzężoną zasadę, więc jeśli potrafisz rozpoznać te dwie koniugacje substancji, będziesz wiedział, że jest ona amfiprotyczna.
Układ kwasowo-zasadowy węglanowy
Na przykład układ trójkowy {kwas karbonowy, jon wodorowęglanowy, jon węglanowy} stanowi szereg amfiprotyczny, w którym jon wodorowęglanowy jest amfolitem, różniącym się od każdego ze swoich sąsiadów dodaniem lub usunięciem jednego protonu:
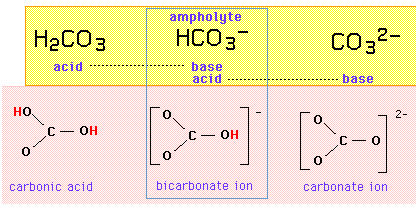
Jeśli jon wodorowęglanowy jest zarówno kwasem, jak i zasadą, powinien mieć możliwość wymiany protonu z samym sobą w reakcji autoprotolizy:
HCO3- + HCO3- → H2CO3 + CO32-
Od powyższej reakcji zależy Twoje życie! CO2, produkt uboczny przemiany materii każdej komórki Twojego ciała, reaguje z wodą tworząc kwas węglowy
H2CO3, który, gdyby pozwolić mu się gromadzić, uczyniłby Twoją krew śmiertelnie kwaśną. Jednakże krew zawiera również jon węglanowy, który reaguje zgodnie z odwrotnością powyższego równania, tworząc wodorowęglan, który może być bezpiecznie transportowany przez krew do płuc. W płucach reakcja autoprotolizy przebiega w kierunku do przodu, wytwarzając H2CO3, który traci wodę, tworząc CO2, który zostaje wydalony z oddechem. Jon węglanowy jest zawracany z powrotem do krwi, aby ostatecznie odebrać kolejną cząsteczkę CO2.