W chemii, geometria molekularna w kształcie litery T opisuje struktury niektórych cząsteczek, w których atom centralny ma trzy ligandy. Zazwyczaj związki trójkoordynacyjne przyjmują geometrię trygonalną planarną lub piramidalną. Przykładami cząsteczek w kształcie litery T są trifluorki halogenowe, takie jak ClF3.
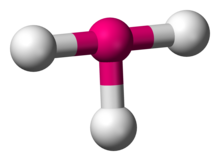
ClF3
C2v
90°, 180°
>0

Zgodnie z teorią VSEPR geometria w kształcie litery T powstaje, gdy do atomu centralnego są związane trzy ligandy i dwie samotne pary elektronów, zapisywane w notacji AXE jako AX3E2. Geometria w kształcie litery T jest związana z trygonalną dwupiramidową geometrią molekularną dla cząsteczek AX5 z trzema ligandami równikowymi i dwoma osiowymi. W cząsteczce AX3E2 dwie samotne pary zajmują dwie pozycje równikowe, a trzy atomy ligandów zajmują dwie pozycje osiowe oraz jedną równikową. Trzy atomy wiążą się pod kątem 90° po jednej stronie centralnego atomu, tworząc kształt T.
Anion trifluoroksenianowy(II), XeF-
3, został zbadany jako możliwy pierwszy przykład cząsteczki AX3E3, która może być oczekiwana przez rozumowanie VSEPR, aby mieć sześć par elektronowych w układzie oktaedrycznym z trzema samotnymi parami i trzema ligandami w orientacji mer lub T. Chociaż anion ten został wykryty w fazie gazowej, próby syntezy w roztworze i eksperymentalnego określenia struktury nie powiodły się. Badanie chemii obliczeniowej wykazało zniekształconą planarną geometrię w kształcie litery Y z najmniejszym kątem wiązania F-Xe-F równym 69°, a nie 90° jak w geometrii w kształcie litery T.
.