Pierwiastek chemiczny hel jest klasyfikowany jako gaz szlachetny i niemetal. Został odkryty w 1895 roku przez Williama Ramsaya.

Strefa danych
| Klasyfikacja: | Hel jest gazem szlachetnym i niemetalem |
| Kolor: | bezbarwny |
| Masa atomowa: | 4.00260 |
| Stan: | gaz |
| Temperatura topnienia: | -272,2 oC, 0,95 K |
| Uwaga: Przy normalnym ciśnieniu atmosferycznym hel nie krzepnie, a więc nie ma temperatury topnienia. Przytoczona powyżej temperatura topnienia jest pod ciśnieniem 25 atmosfer. | |
| Temperatura wrzenia: | -268,9 oC, 4.2 K |
| Elektrony: | 2 |
| Protony: | 2 |
| Neutrony w najobficiej występującym izotopie: | 2 |
| Powłoki elektronowe: | 2 |
| Konfiguracja elektronów: | 1s2 |
| Gęstość @ 20oC: | 0.0001787 g/cm3 |
Pokaż więcej, w tym: Ciepła, Energie, Utlenianie,
Reakcje, Związki, Promienie, Przewodności
| Objętość atomowa: | 27,2 cm3/mol |
| Struktura: | zwykle heksagonalna blisko upakowana |
| (v.wysokie ciśnienie potrzebne do zestalenia helu) | |
| Ciepło właściwe | 5.193 J g-1 K-1 |
| Ciepło topnienia | 0.0138 kJ mol-1 |
| Ciepło atomizacji | 0 |
| Ciepło parowania | 0.0845 kJ mol-1 |
| 1. energia jonizacji | 2372.3 kJ mol-1 |
| 2. energia jonizacji | – |
| 3. energia jonizacji | – |
| powinowactwo elektronów | 0 kJ mol-.1 |
| Minimalna liczba utlenienia | 0 |
| Min. wspólna liczba utlenienia | 0 |
| Maksymalna liczba utlenienia | 0 |
| Maksymalna wspólna liczba utlenienia. | 0 |
| Elektronegatywność (skala Paulinga) | – |
| Objętość polaryzacji | 0.198 Å3 |
| Reakcja z powietrzem | brak |
| Reakcja z 15 M HNO3 | brak |
| Reakcja z 6 M HCl | brak |
| Reakcja z 6 M NaOH | brak |
| Tlenek(i) | brak |
| Wodorek(i) | brak |
| Chlorek(i) | brak |
| Promień atomowy | 31 pm |
| Promień jonowy (jon 1+) | – |
| Promień jonowy (jon 1+) | – |
| Promień jonowy (2+ jon) | – |
| Promień jonowy (3+ jon) | – |
| Promień jonowy (1- jon) | – |
| Promień jonowy (2- jon) | – |
| Promień jonowy (3- jon) | – |
| Przewodność cieplna | 0.15 W m-1 K-1 |
| Przewodność elektryczna | – |
| Temperatura zamarzania/topnienia: | -272,2 oC, 0.95 K |

Nasa: Zjonizowane atomy helu w temperaturze około 60 000 °C w chromosferze Słońca emitują światło ultrafioletowe widoczne na tym zdjęciu.
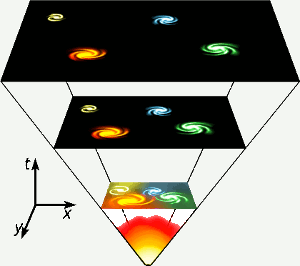
Hel powstał w pierwszych trzech minutach istnienia wszechświata, gdy wszędzie temperatury były wystarczająco wysokie, by mogła nastąpić fuzja jądrowa. Ta krótka, wysokoenergetyczna faza jest przedstawiona na samym dole diagramu. Hel powstaje również w wyniku fuzji jądrowej wodoru w gwiazdach takich jak nasza. Obraz: Gnixon
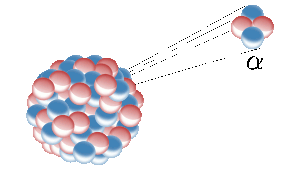
Hel na Ziemi pochodzi z rozszczepienia jąder atomowych pierwiastków promieniotwórczych, takich jak uran. Tutaj radioaktywne jądro emituje jądro helu (znane również jako cząstka alfa). Obraz: Inductiveload

Widmo helu z widoczną żółtą linią. Obraz: Nasa

William Ramsay wskazujący na ostatnią kolumnę układu okresowego zawierającą gazy szlachetne (lub obojętne). Ramsay otrzymał Nagrodę Nobla w dziedzinie chemii w 1904 r. za pracę nad odkryciem gazów obojętnych. Obraz: Vanity Fair
Odkrycie helu
Historia odkrycia helu przeplata się z odkryciem natury gwiazd.
Swego czasu ludzie wierzyli, że nigdy nie dowiemy się, z czego zbudowane są gwiazdy. W 1835 roku francuski filozof Auguste Comte oświadczył, że „nigdy nie będziemy w stanie w żaden sposób zbadać ich składu chemicznego.” (1)
Comte uważał, że moglibyśmy dowiedzieć się, czym jest gwiezdny materiał tylko wtedy, gdybyśmy mogli go dostać do laboratorium.
Pomimo pesymizmu Comte’a, metoda odkrycia helu i składów gwiazd została już znaleziona. W 1814 roku niemiecki fizyk Joseph Fraunhofer zastosował metodę Isaaca Newtona polegającą na rozszczepieniu światła słonecznego za pomocą pryzmatu i dokonał istotnego postępu. Fraunhofer zauważył ciemne linie w tęczy kolorów pochodzących od światła słonecznego rozszczepionego przez pryzmat; linie, które zobaczył, były pierwszą w historii obserwacją widma gwiazdy. (2), (3)
W 1859/60 niemieccy naukowcy Gustav Kirchhoff i Robert Bunsen dokonali ogromnych skoków w nauce spektroskopii, w tym odkrycia, że ciemne linie, które widział Fraunhofer, były jak odcisk palca substancji.
Scena była ustawiona dla Kirchhoffa i Bunsena, aby odkryć nowe elementy poprzez badanie światła z substancji, gdy się paliły.
W 1860 roku odkryli cez dzięki niebieskim liniom widmowym, a w 1861 roku rubid dzięki dwóm czerwonym liniom widmowym. Następnie William Crookes odkrył tal w 1861 roku po zaobserwowaniu jasnej zielonej linii spektralnej.
Kirchhoff i Bunsen przyjrzeli się widmu Słońca i byli w stanie stwierdzić, że żelazo było obecne w jego świecącej atmosferze. (4)
Na odkrycie helu potrzeba było jeszcze kilku lat. W sierpniu 1868 roku miało nastąpić pierwsze całkowite zaćmienie od czasu opublikowania pracy Kirchhoffa i Bunsena.
Francuski astronom Pierre Janssen czekał na zaćmienie, aby za pomocą spektroskopu zaobserwować prominencje w koronie słonecznej. W ciągu dwóch tygodni po zaćmieniu Janssen opracował metodę rejestracji widm prominencji bez potrzeby zaćmienia. W widmach tych zaobserwował żółtą linię. (5)
Linia ta znajdowała się w podobnym, ale nie identycznym położeniu jak linie w widmie sodu. Zostały one nazwane liniami D1 i D2. Angielski naukowiec Norman Lockyer badał nową żółtą linię; później nazwano ją linią D3.Opublikował on swoje badania linii, zdając sobie sprawę, że może być ona spowodowana przez nowy pierwiastek:
„…więc wtedy wiedzieliśmy, że nie mamy do czynienia z wodorem; stąd mieliśmy do czynienia z pierwiastkiem, którego nie mogliśmy uzyskać w naszych laboratoriach, i dlatego wziąłem na siebie odpowiedzialność za ukucie słowa hel, w pierwszej kolejności do użytku laboratoryjnego.” (6)
Nazwa hel pochodziła od greckiego słowa oznaczającego słońce, helios.
Lockyer i Edward Frankland, jego współpracownik, mieli szereg innych pomysłów na temat możliwych przyczyn żółtej linii i dlatego nie ogłosili nowego pierwiastka.
Do 1871 roku inni naukowcy byli świadomi sytuacji. Lord Kelvin omówił „odbicie światła świecącego wodoru i 'helu’ wokół Słońca.” The use of 'hel’ is followed by a footnote to explain it:
„Frankland and Lockyer find the yellow prominences to give a very decided bright line not far from D, but hitherto not identified with any terrestrial flame. Wydaje się, że wskazuje ona na nową substancję, którą proponują nazwać Hel.” (7)
Istnienie Helu nie zostało jednak zaakceptowane przez wszystkich. (5)
Wszystkie wątpliwości zostały rozwiane, gdy szkocki chemik William Ramsay wyizolował hel w 1895 roku w Londynie. Ramsay odkrył argon w 1894 roku; argon był pierwszym z gazów szlachetnych, który został odkryty. W 1895 r. przeczytał pracę Williama Hillebranda opisującą niereaktywny gaz, który został uwolniony po dodaniu kwasu do minerału uranu, uranitu. Hillebrand uważał, że gazem tym był azot.
Ramsay, który uważał, że gaz może zawierać argon, powtórzył eksperyment Hillebranda, używając innego minerału uranu, cleveite, i zebrał gaz.
Jego spektroskop wskazał na obecność azotu, argonu i jednego innego gazu. Ramsay podejrzewał, że może to być hel, ponieważ pojawiła się linia D3. (8) Wiedząc, że Lockyer i William Crookes mieli lepszy spektroskop niż on, wysłał im próbkę gazu. Niestety próbka nie była odpowiednia, więc Lockyer zdobył próbkę uranitu, wyekstrahował gaz i zbadał go za pomocą spektroskopu. Pisze: (8)
„Jedna po drugiej nieznane linie, które zaobserwowałem w słońcu w 1868 roku, okazały się należeć do gazu.”
Widmo gazu było identyczne ze słonecznym „helem”. Nowy pierwiastek zdobył swoje miejsce w układzie okresowym.
Odwiedź stronę Chemicool’s Cool Helium Facts Page.

Wygląd i właściwości
Szkodliwe działanie:
Nie wiadomo, czy hel jest toksyczny.
Właściwości:
Hel jest lekkim, bezwonnym, bezbarwnym, obojętnym, monatomowym gazem. Może tworzyć cząsteczki dwuatomowe, ale tylko słabo i w temperaturach bliskich zeru bezwzględnemu.
Hel ma najniższą temperaturę topnienia ze wszystkich pierwiastków, a jego temperatura wrzenia jest bliska zeru bezwzględnemu.
W przeciwieństwie do innych pierwiastków, hel nie krzepnie, ale pozostaje cieczą aż do zera bezwzględnego (0 K) pod zwykłym ciśnieniem.
Głos kogoś, kto wdychał hel chwilowo brzmi wysoko tonowo.
Użytki helu
Obrazowanie rezonansem magnetycznym (MRI) jest największym użytkownikiem helu. Hel jest używany do chłodzenia nadprzewodzących magnesów skanerów MRI.
Hel jest używany do napełniania balonów (blimps) i do ciśnienia ciekłego paliwa rockets.
Mieszaniny helu i tlenu są używane jako sztuczne „powietrze” dla nurków i innych pracujących pod ciśnieniem. Hel jest używany zamiast azotu w normalnym powietrzu, ponieważ po długim nurkowaniu hel opuszcza ciało szybciej niż azot, umożliwiając szybszą dekompresję.
Hel jest używany jako osłona gazowa w pobliżu spawania łukowego, zapobiegając, na przykład, jakiejkolwiek reakcji gorących spoin metalowych z tlenem. Gaz ten jest stosowany w przemyśle półprzewodnikowym do zapewnienia atmosfery obojętnej dla wzrostu kryształów krzemu i germanu. Jest on również stosowany jako gaz wysokotemperaturowy w produkcji tytanu i cyrkonu oraz jako gaz nośny w chromatografii gazowej.
Abundance and Isotopes
Abundance earth’s crust: 8 parts per billion by weight, 43 parts per billion by moles
Abundance solar system: 23 % by weight, 7.4 % by moles
Cost, pure: $5.2 per 100g
Cost, bulk: $ per 100g
Source: Prawie cały hel na Ziemi jest wynikiem rozpadu promieniotwórczego. Główne źródła helu pochodzą ze złóż gazu ziemnego w odwiertach w Teksasie, Oklahomie i Kansas. Hel jest wydobywany poprzez destylację frakcyjną gazu ziemnego, który zawiera do 7% helu.
Izotopy: Hel ma 8 izotopów, których okresy półtrwania są znane, o liczbach masowych od 3 do 10. Naturalnie występujący hel jest mieszaniną jego dwóch stabilnych izotopów, 3He i 4He o naturalnych liczebnościach wynoszących odpowiednio 0,0001% i 99,999%.

- Auguste Comte, Cours de Philosophie Positive at Project Gutenberg
- Keith J. Laidler, The World of Physical Chemistry, 1993, p179.
- The Era of Classical Spectroscopy, z MIT Spectroscopy.
- Gerard G. Emch, Mathematical and Conceptual Foundations of 20th-Century Physics., 1984, Elsevier Science Publishers, p211
- Helge Kragh, The Solar Element: A Reconsideration of Helium’s Early History., 2009, Annals of Science, 66:2, p157-182.
- J. Norman Lockyer, The Growth of our Knowledge of Helium., Science Progress, 1896, Vol 5., p249
- W. Thomson, Presidential Address, British Association for the Advancement of Science, 1871, (Address. XCIX).
- Sir Norman Lockyer, The Sun’s Place in Nature…, 1897, p47-48
Cite this Page
W przypadku linkowania online, proszę skopiować i wkleić jeden z poniższych fragmentów:
<a href="https://www.chemicool.com/elements/helium.html">Helium</a>
lub
<a href="https://www.chemicool.com/elements/helium.html">Helium Element Facts</a>
Aby zacytować tę stronę w dokumencie akademickim, proszę użyć następującego cytatu zgodnego z MLA:
"Helium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/helium.html>.
.