Abstract
Zakażenie dróg moczowych (UTI) jest problemem globalnym. Większość badań nad UTI koncentruje się na etiologii gram-ujemnej. Enterobacteriaceae okazały się być najbardziej rozpowszechnioną infekcją UTI, stanowiąc ponad 80% wszystkich zgłoszonych przypadków. Głównymi bakteriami Gram-dodatnimi w przypadkach UTI są Staphylococcus saprophyticus, Enterococcus faecalis, Streptococcus agalactiae. Patogeny Gram-dodatnie były opisywane w wielu krajach zarówno w niepowikłanych, jak i powikłanych UTI. Antybiotykoterapia bakterii Gram-dodatnich jest zupełnie inna niż patogenów Gram-ujemnych UTI. Jednakże objawy związane z UTI wywołanym przez bakterie gram-dodatnie i gram-ujemne są bardzo podobne. Bez odpowiedniej diagnostyki istnieje duże prawdopodobieństwo postawienia błędnej diagnozy i zastosowania niewłaściwej antybiotykoterapii. W Bangladeszu dostępnych jest niewiele badań dotyczących etiologii i ich wrażliwości na antybiotyki. Naszym celem było poszukiwanie w tym obszarze badawczym wypełnienia luki. Badanie to wykryło 8,2% bakterii Gram-dodatnich u pacjentów z UTI. Częstość występowania wykazuje harmonię z wcześniej opublikowanymi doniesieniami. Stwierdzono, że mężczyźni i kobiety są w równym stopniu zainfekowani przez gram-dodatnie patogeny UTI. Większość wcześniejszych publikacji wskazuje, że kobiety są bardziej podatne na zakażenie gram-ujemnymi bakteriami UTI. Nasze wyniki wskazują, że mężczyźni są w równym stopniu narażeni na zakażenie bakteriami gram-dodatnimi w porównaniu z kobietami. Dalsze badania z większą liczbą próbek mogą potwierdzić te wstępne wyniki. Analiza antybiogramów wykazała, że amikacyna i gentamycyna są najskuteczniejszymi antybiotykami wobec badanych izolatów. Z kolei nitrofurantoina okazała się najbardziej nieskutecznym lekiem w tym badaniu. Wyniki badania mogą pomóc w przepisywaniu antybiotyków na podstawie tego opartego na dowodach badania.
Słowa kluczowe
uropatogen, UTI, oporność na środki przeciwdrobnoustrojowe, leczenie empiryczne, Bangladesz
Skróty
API: Analytic Profile Index; CLSI: Clinical and Laboratory Standards Institute; CLED: Cysteine Lactose Electrolyte Deficient Agar; MDR: Multi Drug Resistant; MHA: Muller Hinton Agar; PBS: Phosphate Buffered Saline; UTI: Urinary Tract Infection
Introduction
Urinary tract infection (UTI) is one of the most common infectious diseases. Głównymi czynnikami wywołującymi UTI są Escherichia coli i inne Enterobacteriaceae. Pozostałe proporcje są związane z różnymi organizmami, w tym z Gram-dodatnimi bakteriami Staphylococcus saprophyticus, Enterococcus faecalis, Streptococcus agalactiae (Streptococcus grupy B, GBS) i innymi, rzadziej izolowanymi organizmami. Do najczęściej występujących gram-dodatnich bakterii uropatogennych należą Staphylococcus saprophyticus i Enterococcus facecalis . Gram-dodatnie uropatogeny były opisywane w wielu krajach zarówno w niepowikłanych jak i powikłanych UTI. W populacji Bangladeszu nie przeprowadzono takich ekskluzywnych badań w celu poszukiwania etiologii Gram-dodatnich UTI. Bez właściwej diagnozy istnieje duże prawdopodobieństwo otrzymania niewłaściwych i nieodpowiednich leków oraz późniejszych niepożądanych skutków ubocznych związanego z nimi leczenia. Bakterie Gram-dodatnie częściej występują jako czynniki etiologiczne UTI u kobiet w ciąży i osób starszych. Ponadto, skomplikowane UTI często występują w warunkach szpitalnych i/lub instytucjonalnych, a osoby te są bardziej narażone na Gram-dodatnie i polimikrobowe UTI. Stanowi to znaczną część zużycia antybiotyków i ma duży wpływ socjoekonomiczny oraz może przyczyniać się do oporności bakterii. Klinicyści często napotykają problemy w wyborze odpowiedniego antybiotyku do terapii empirycznej w leczeniu UTI. W Bangladeszu, bezkrytyczne stosowanie antybiotyków przynosi wiele niekorzystnych skutków klinicznych u pacjentów z UTI, co wiąże się z rozszerzonym obciążeniem ekonomicznym. Celem tego badania była ocena profilu wrażliwości uropatogenów Gram-dodatnich na różne antybiotyki przepisywane na receptę. Nasze badanie zracjonalizowało konieczność ciągłego monitorowania pacjentów z zakażeniem układu moczowego w celu lepszego zrozumienia ich obecnej epidemiologii przez gram-dodatnie szczepy bakteryjne w populacji Bangladeszu.
Metody i materiały
Zbieranie danych
Informacje socjodemograficzne pacjentów, historia leczenia (czy pacjenci byli leczeni przeciwdrobnoustrojowo) oraz wszelkie istotne informacje kliniczne (kamica nerkowa, ciąża, niedawne użycie cewnika) zostały zarejestrowane przez ustrukturyzowany kwestionariusz.
Projekt badania i zbieranie próbek
Badanie przekrojowe zostało przeprowadzone w okresie od lipca 2018 r. do grudnia 2018 r. w celu poszukiwania izolatu bakterii Gram-dodatnich od pacjentów mających zakażenie układu moczowego. Badanie to zostało zaprojektowane w oparciu o badania laboratoryjne próbek moczu zebranych od pacjentów z UTI uczęszczających do różnych szpitali społecznościowych w obszarze Savar. W celu uruchomienia planowania, prawdopodobni pacjenci z UTI, którzy szukali porady medycznej w Gonosastha Hospital i Enam Medical College w Savar, Dhaka, zostali poproszeni o udział w tym badaniu. Badanie obejmuje pacjentów posiadających kliniczne dowody UTI z objawami mniej niż siedem dni prezentujących się w ambulatorium szpitala i tych przyjętych na mniej niż 48 h.
Izolacja bakterii i identyfikacja
Aby wyizolować patogen UTI, próbki moczu pobrano do sterylnych szklanych probówek i zaszczepiono na zróżnicowanym podłożu hodowlanym, agarze z cysteiną, laktozą i ubogim w elektrolity (CLED) (Lyophilchem, Włochy). Pacjentom wyjaśniono wcześniej standardową procedurę pobierania próbek śródprzełykowych z czystego źródła, aby uniknąć zanieczyszczenia bakteriami komensalnymi. Aby uniknąć wyników fałszywie dodatnich, próbki moczu były posiewane w ciągu 2 godzin po pobraniu. Użycie agaru CLED zapewnia korzyści związane ze wzrostem większości potencjalnych uropatogenów, w tym gram-dodatnich kokcytów, takich jak Staphylococcus aureus, Staphylococcus saprophyticus i Enterococcus spp. Równolegle wprowadzono podłoże Mannitol Salt Agar (MSA) w celu ukierunkowania wzrostu UTI na bakterie gram-dodatnie. Posiewy moczu inkubowano przez noc w temperaturze 35ºC-37ºC w powietrzu atmosferycznym. Wykonano ilościowe posiewy moczu, a liczbę kolonii 102 lub 103 CFU/mL uznano za definiującą prawdopodobne zakażenie UTI u poszczególnych pacjentów. Liczbę kolonii poniżej 102 CFU/mL przyjęto jako potencjalne zanieczyszczenie. Oczyszczone kolonie bakteryjne identyfikowano za pomocą barwienia metodą Grama, konwencjonalnych procedur biochemicznych, a następnie za pomocą zestawu do szybkich testów biochemicznych (API 20E, BioMe´rieux, Durham, NC) składającego się z zestawu paneli chromogennych, baterii węglowodanów i substratów enzymatycznych. Identyfikacja bakterii została dodatkowo potwierdzona przez genotypowanie z wykorzystaniem 16S rRNA izolatów w części.
Ocena wrażliwości na antybiotyki
Izolaty poddano badaniu wrażliwości na antybiotyki in vitro standardową metodą dyfuzyjno-krążkową Kirby-Bauera, a strefy zahamowań interpretowano zgodnie z zaleceniami CLSI (Clinical amp; Laboratory Standards Institute-2010). Sześć krążków z antybiotykami beta-laktamowymi, nitrofurantoiną i fluorochinolonami umieszczano na trawniku bakteryjnym i inkubowano w temperaturze 37ºC w celu określenia wzoru wrażliwości. Bakterie wrażliwe dawały wyraźną strefę wokół krążka z antybiotykiem, a średnica strefy była mierzona w celu porównania ze standardem.
Detekcja genów oporności na β-laktamazę i chinolony
Izolaty, które wykazywały fenotypową oporność były poddawane PCR w celu wykrycia genu blaTEM i qnrS. Łącznie przygotowano sześć lizatów bakteryjnych. PCR przeprowadzono w probówce PCR zawierającej lizat bakteryjny jako szablon DNA (1 µl) z końcową objętością 12 µl zawierającą premiks DNA 2x (6 µl), 5 pmol każdego primera (1 µl) i wodę dejonizowaną (4 µl). PCR przeprowadzono w termocyklerze, a warunki cykli dla bla TEM i qnrS były następujące: wstępna denaturacja w 94°C przez 5 min, następnie 32 cykle amplifikacji z denaturacją w 94°C przez 30 s, annealingiem w 50°C przez 30 s (blaTEM) i 55°C przez 30 s (qnrS) oraz przedłużeniem w 72°C przez 1 min, zakończone końcowym przedłużeniem w 72°C przez 7 min. Produkty PCR o oczekiwanym rozmiarze oczyszczano i sekwencjonowano przy użyciu tych samych starterów, których użyto do wygenerowania produktów PCR.
Analizy statystyczne
Jak opisano, do zbierania danych użyto zwalidowanej wersji kwestionariusza w języku Bangla. Wypełnione formularze zbierania danych były ponownie sprawdzane przez osoby nadzorujące zbieranie danych. Losowo wybrane 10% analiz laboratoryjnych zostało wykonanych dwukrotnie przez różne osoby prowadzące badania, aby zapewnić autentyczność danych laboratoryjnych i ocenić uprzedzenia między badaczami. Zweryfikowane dane zostały wprowadzone, a następnie przeanalizowane przy użyciu edytora danych statystycznych IBM SPSS (wersja 21). Brakujące dane zostały wykluczone z analizy dwuczynnikowej. Statystyki opisowe podawano w postaci częstości, odsetków i średnich wraz z odchyleniem standardowym. Wrażliwość badanych bakterii na środki przeciwdrobnoustrojowe oceniano w 3-stopniowej kategorycznej skali ocen jako wrażliwą (antybiotyk wskazany jako w pełni skuteczny), pośrednią (wskazana jako częściowo skuteczna) i oporną (wskazana jako nieskuteczna). Do badania asocjacji pomiędzy danymi kategorycznymi zastosowano test chi kwadrat Pearsona, a tam, gdzie było to właściwe, zastosowano korektę Yate’a dla ciągłości. W ten sposób obliczono wpływ stosowania środków przeciwdrobnoustrojowych na nabycie genu antybiotykooporności. Współczynnik korelacji został obliczony w celu sprawdzenia siły związku. Przy porównywaniu średnich zmiennych ciągłych przeprowadzono testy t dla prób niezależnych. Dwuwartościowa wartość p mniejsza niż 0,05, została uznana za statystycznie istotną.
Wyniki
Demografia badanej populacji
Podeszliśmy do pacjentów, którzy uczęszczali do lekarzy Gonosatha Medical College z ich powikłaniami związanymi z UTI. Do badania włączyliśmy 147 pacjentów, którzy mieli ciężkie objawy kliniczne. Spośród nich 36 (24,5%) było mężczyznami, a pozostałe 111 (75,5%) było kobietami. Zatem prawie trzykrotnie więcej pacjentów z UTI było płci żeńskiej w porównaniu z płcią przeciwną (ryc. 1). Test chi kwadrat wykazał, że płeć żeńska wiąże się z istotnie większą liczbą zdarzeń UTI (p = 0,04). Rozkład wieku badanych pacjentów mieścił się w przedziale od poniżej 1 roku do ponad 70 lat. Najczęściej jednak zakażenia UTI występowały w grupie wiekowej 21-30 lat. Ogólną dystrybucję przypadków w zależności od wieku przedstawiono w tabeli 1. W grupie wiekowej 21-30 lat zidentyfikowano w sumie 5 z 12 Staphylococcus spp (42%). Nie zaobserwowano innej tendencji w rozkładzie wiekowym zakażeń bakteriami gram-dodatnimi UTI.
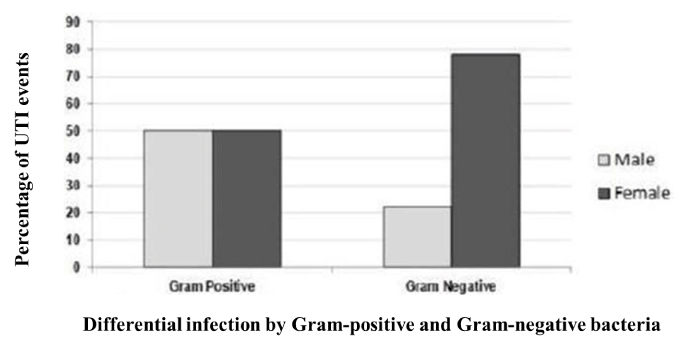
Rycina 1. Dystrybucja bakterii gram-dodatnich i gram-ujemnych wśród mężczyzn i kobiet. Kobiety miały istotnie większą liczbę UTI niż mężczyźni, które były wywołane przez bakterie gram-ujemne. W przypadku zakażeń układu moczowego wywołanych przez bakterie gram-dodatnie, mężczyźni i kobiety wykazywali jednakową podatność
Tabela 1. Wiek -distribution of UTI study patients
|
Wiek w latach |
Liczba pacjentów z UTI |
Częstość % |
|
Ogółem |
Isolacja i identyfikacja patogenów Gram-positive UTI pathogens
Badaliśmy 147 próbek moczu od klinicznie objawowych pacjentów. Podłoże hodowlane CLED dawało kolonie o różnym zabarwieniu dla różnych patogenów UTI. Gram-dodatnie Staphylococcus aureus wytwarzają żółte kolonie, Staphylococcus saprophyticus – białe do żółtawych, a Enterococcus spp – bezbarwne do żółtych. Bakterie Gram-ujemne wytwarzają inne kolory. Dlatego też identyfikacja bakterii UTI poprzez obserwację kolorów kolonii na CLED może być przypuszczalna, ale trudna do stwierdzenia. Z podłoża CLED wyhodowaliśmy kolonie Gram-dodatnie na podłoże Mannitol Salt Agar (MSA) i inkubowaliśmy przez noc w temperaturze 37°C. Wyrosłe kolonie na MSA miały barwę od białej do żółtawej i różowej. Bakterie z MSA poddano barwieniu metodą Grama i stwierdzono ich Gram-dodatni charakter. Wstępnie zidentyfikowane gram-dodatnie bakterie UTI to Staphylococcus species. Analiza wskaźnika profilowania analitycznego (API) i/lub sekwencjonowanie DNA 16sRNA mogą być wykonane w celu identyfikacji etiologii na poziomie gatunkowym. Wykryliśmy 12 gram-dodatnich patogenów UTI, co stanowiło 8,2% całej populacji patogenów.
Wzór oporności przeciwdrobnoustrojowej izolatów gram-dodatnich UTI
Dyskusyjny eksperyment dyfuzyjny wytworzył wyraźne strefy trawnika bakteryjnego na agarze Mullera-Hintona (MH), wskazując na wrażliwość na odpowiednie antybiotyki tam impregnowane. Z kolei izolaty oporne nie pozwalały na uzyskanie wyraźnej strefy nawet w obecności krążka z antybiotykiem. W naszej ocenie zaobserwowano mieszany trend wrażliwości na badane antybiotyki. Najwyższą oporność stwierdzono w stosunku do nitrofurantoiny (91,7%), następnie amoksycyliny (83%), ofloksacyliny (50%). Bardzo skutecznymi lekami okazały się gentamycyna i amikacyna, na które oporność stwierdzono jedynie u 8,3% (ryc. 2).
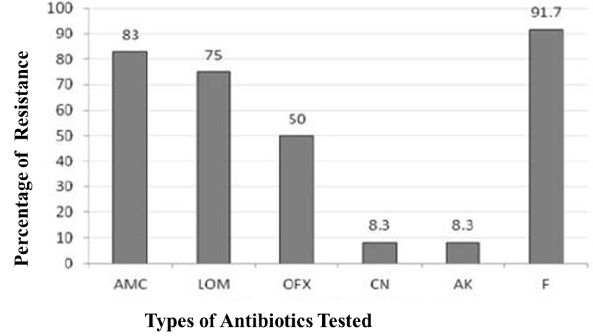
Ryc. 2. Częstość występowania antybiotykooporności wśród gram-dodatnich bakterii UTI.
AMC: Amoxicillin; LOM: Lomefloxacin; OFX: Ofloxacin; CN: Gentamicin; AK: Amikacin; F: Nitrofurantoin. Amikacyna i gentamycyna okazały się najbardziej skutecznymi antybiotykami wobec Gram-dodatnich bakterii UTI. Nitrofurantoina okazała się najmniej skuteczna spośród badanych antybiotyków.
Geny oporne na antybiotyki w Gram-dodatnich uropatogenach
Przygotowaliśmy próbki DNA ze wszystkich 12 izolatów Gram-dodatnich metodą gotowania w wysokiej temperaturze. Ściany komórkowe bakterii gram-dodatnich są zwykle znacznie sztywniejsze niż bakterii gram-ujemnych, co może wpływać na uwalnianie DNA metodą wrzenia termicznego. W obecnej analizie badaliśmy pierścień beta-laktamowy zawierający antybiotykooporny gen bla-TEM i stwierdziliśmy u dwóch (2/6, 33%) izolatów wynik dodatni. Podobnie sprawdziliśmy obecność genu qnr-S opornego na antybiotyki z grupy fluorochinolonów i stwierdziliśmy u trzech izolatów wynik pozytywny (3/6, 50%).
Dyskusja
Zakażenia układu moczowego stanowią jedną z najczęstszych chorób spotykanych w praktyce lekarskiej, powodującą znaczną związaną z tym chorobowość i występującą od noworodków do osób starszych. Częstość występowania zakażeń może się różnić w zależności od wieku, płci i pewnych czynników predysponujących. Większość zgłoszonych infekcji UTI była spowodowana przez bakterie gram-ujemne, głównie Enterobacteriaceae. Istniały również silne dowody przeciwko zakażeniom UTI wywołanym przez bakterie gram-dodatnie. Staraliśmy się zbadać częstość występowania gram-dodatnich patogenów UTI w populacji Bangladeszu. Empiryczne leczenie zakażeń układu moczowego w oparciu o kryteria ciężkości i objawy kliniczne stanowi duże wyzwanie. Ponieważ antybiotykoterapia bakterii gram-dodatnich jest zupełnie inna niż patogenów gram-ujemnych UTI, istnieje duże prawdopodobieństwo zastosowania niewłaściwego leczenia empirycznego. Dlatego prawidłowa diagnoza wraz z badaniem wrażliwości na antybiotyki jest niezbędna do ustalenia właściwego postępowania terapeutycznego. UTI jest częstą chorobą nabytą w Bangladeszu, dlatego każdego roku znaczny odsetek populacji ulega zakażeniu tą chorobą. Badanie zostało zaprojektowane w celu sprawdzenia wrażliwości na środki przeciwdrobnoustrojowe również patogenów Gram-dodatnich UTI. Wykryliśmy około 8,2% gram-dodatnich patogenów UTI, w szczególności Staphylococcus aureus, Staphylococcus saprophyticus i Enterococcus spp. które dołączyły do wcześniej opublikowanych raportów .
Często, infekcja UTI była rejestrowana znacznie częściej u kobiet niż u mężczyzn. Nieprawdopodobne, znaleźliśmy połowę infekcji gram-dodatnich odnotowano u samców. Wstępne wyniki wykazały, że mężczyźni są bardziej narażeni na zakażenie bakteriami Gram-dodatnimi w porównaniu do ogólnej sytuacji. Rozkład wieku badanych przez nas przypadków mieści się w przedziale od poniżej 1 roku do ponad 70 lat. Jednak najczęstsze zakażenia UTI wywołane przez bakterie Gram-dodatnie występowały w grupie wiekowej między 21 a 30 rokiem życia, co zostało potwierdzone w innych badaniach.
Oporność na antybiotyki wśród uropatogenów stała się problemem zdrowia publicznego w Bangladeszu. W tym badaniu określono profile wrażliwości na antybiotyki gram-dodatnich patogenów UTI na sześć różnych krążków antybiotykowych testem dyfuzyjnym. Najwyższy odsetek oporności obserwowano wobec nitrofurantoiny, natomiast najniższy wobec amikacyny i gentamycyny. Mniej niż 10% uropatogenów gram-dodatnich okazało się opornych na te dwa antybiotyki z grupy aminoglikozydów. Uzyskane wyniki przemawiają za stosowaniem aminoglikozydów jako leków z wyboru wobec gram-dodatnich patogenów UTI. Spośród antybiotyków z grupy chinolonów najwyższy odsetek oporności wykazała lomefloksacyna II generacji (75%). Wyniki antybiogramu wykazały, że nitrofurantoina nie jest zbyt skutecznym lekiem na gram-dodatnie bakterie UTI. Stary antybiotyk beta-laktamowy, amoksycylina, był słabo funkcjonalny wobec gram-dodatnich patogenów UTI. Antybiotyki fluorochinolonowe, ofloksacylina i lomefloksacyna, okazały się skuteczne na umiarkowanym poziomie.
Izolaty badano pod kątem wybranych genów AMR metodą łańcuchowej reakcji polimerazy (PCR), stosując startery specyficzne do wykrywania bla-TEM i qnrS. Około 33% izolatów było dodatnich dla bla-TEM, a 50% dla qnrS. Wykryto geny oporności na antybiotyki, które wykazywały zgodność z fenotypowym wzorcem wrażliwości. Chociaż z najwyższą szczerością i poświęceniem przeprowadzono badanie, nie mogło ono wyjść poza ograniczenia, ponieważ wielkość próby nie była wystarczająco duża. Pomimo tego ograniczenia, miejmy nadzieję, że wyniki badania pomogą klinicystom podejmującym decyzje o przepisywaniu antybiotyków na podstawie badań opartych na dowodach naukowych. Klinicysta powinien zadbać o konkretną diagnozę przed przepisaniem empirycznej antybiotykoterapii, szczególnie w przypadku męskiego UTI.
Oświadczenie etyczne
Badanie to zostało zatwierdzone przez Komitet Etyki i Przeglądu Badań Naukowych Uniwersytetu Jahangirnagar, Wydział Nauk Biologicznych, a ustną zgodę uzyskano od pacjentów z UTI i lekarzy.
Podziękowania
Autorzy chcieliby podziękować odpowiednim pacjentom i lekarzom za współpracę. Autorzy doceniają wkład pracowników laboratorium ogólnego, Departamentu Mikrobiologii, Uniwersytetu Jahangirnagar.
Ujawnienie
Ta praca była częściowo wspierana przez Grant for Advance Research (GARE), Ministerstwo Edukacji i The Ministry of Science and Technology Research Grant, Bangladesh, do Dr. Md. Salequl Islam.
- Stamm WE, Norrby SR (2001) Urinary tract infections: disease panorama and challenges. J Infect Dis 183: S1-S4.
- Hooton TM (2012) Clinical practice. Niepowikłane zakażenia układu moczowego. J Infect Dis 366: 1028-1037. Epub 2012/03/16.
- Piette A, Verschraegen G (2009) Role of coagulase-negative staphylococci in human disease. Vet Microbiol 134: 45-54.
- Edwards MS, Baker C (2005) Group B streptococcal infections. GROUP 12:c0060.
- Matthews SJ, Lancaster JW (2011) Urinary tract infections in the elderly population. Am J Geriatr Pharmacother 9: 286-309.
- Kline KA, Lewis AL (2016) Gram-dodatnie uropatogeny, polimikrobowe zakażenia układu moczowego i wyłaniająca się mikrobiota dróg moczowych. Microbiol Spectr 4: 2.
- Clouse K, Shehabi A, Suleimat AM, Faouri S, Khuri-Bulos N, et al. (2019) High prevalence of Group B Streptococcus colonization among pregnant women in Amman, Jordan. BMC pregnancy and childbirth 19: 177.
- de Sousa VS, da-Silva APS, Sorenson L, Paschoal RP, Rabello RF, et al. (2017) Staphylococcus saprophyticus Recovered from Humans, Food, and Recreational Waters in Rio de Janeiro, Brazil. Int J Microbiol 2017: 4287547
- Lee DH, Klinkova O, Kim JW, Nanjappa S, Greene JN (2019) A Case Series of Staphylococcus lugdunensis Infection in Cancer Patients at an Academic Cancer Institute in the United States. Infect Chemo 51: 45-53.
- Kunin CM (1994) Urinary tract infections in females. Clin Infect Dis 18: 1-10.
- Croxen MA, Finlay BB (2010) Molekularne mechanizmy patogenności Escherichia coli. Nat Rev Microbiol 8: 26-38.
- Grude N, Tveten Y, Kristiansen BE (2001) Urinary tract infections in Norway: bacterial etiology and susceptibility. A retrospective study of clinical isolates. Clin Microbiol Infect 7: 543-547.
- Falagas ME, Giannopoulou KP, Kokolakis GN, Rafailidis PI (2008) Fosfomycin: use beyond urinary tract and gastrointestinal infections. Clin Infect Dis 46: 1069-1077.
- Stamm WE, Counts GW, Running KR, Fihn S, Turck M, et al. (1982) Diagnosis of coliform infection in acutely dysuric women. N Engl J Med 307: 463-468.
- Detweiler K, Mayers D, Fletcher SG (2015) Bacteruria and Urinary Tract Infections in the Elderly. Urol Clin North Am 42: 561-568.
- Arshad M, Seed PC (2015) Urinary tract infections in the infant. Clin Perinatol 42: 17-28.
- Tien BYQ, Goh HMS, Chong KKL, Bhaduri-Tagore S, Holec S, et al. (2017) Enterococcus faecalis Promotes Innate Immune Suppression and Polymicrobial Catheter-Associated Urinary Tract Infection. Infect Immun pii: e00378-17.
- Vasquez V, Ampuero D, Padilla B (2017) Urinary tract infections in inpatients: that challenge. Rev Esp Quimioter 30: S39-S41.
- Hooton TM, Stamm WE (1997) Diagnostyka i leczenie niepowikłanego zakażenia układu moczowego. Infect Dis Clin North Am 11: 551-581.
- Medina M, Castillo-Pino E (2019) Wprowadzenie do epidemiologii i obciążeń związanych z zakażeniami układu moczowego. Ther Adv Urol 11: 1756287219832172.
- Wallmark G, Arremark I, Telander B (1978) Staphylococcus saprophyticus: częsta przyczyna ostrego zakażenia dróg moczowych wśród pacjentek ambulatoryjnych. J Infect Dis 138: 791-797.