Corantes são usados em muitas indústrias – para colorir roupas, tintas, plásticos, fotografias, estampas e cerâmicas. Os corantes são agora também usados em novas aplicações e são denominados funcionais (alta tecnologia) uma vez que não estão incluídos no produto apenas por razões estéticas mas para fins específicos, por exemplo em cirurgia.
Corantes podem ser corantes ou pigmentos. Os corantes são compostos orgânicos de cor solúvel que geralmente são aplicados aos têxteis a partir de uma solução em água. Eles são projetados para se ligar fortemente às moléculas de polímero que compõem a fibra têxtil.
Pigmentos são compostos insolúveis usados em tintas, tintas de impressão, cerâmicas e plásticos. São aplicados utilizando uma dispersão em um meio adequado. A maioria dos pigmentos utilizados são também compostos orgânicos.
- Manipulação da cor e aplicação de corantes
- A coloração dos têxteis
- Classificação de corantes
- Classificação de corantes pela sua estrutura química
- a) Corantes azo
- (b) Corantes antraquinona
- (c) Ftalocianinas
- Classificação dos corantes pelos métodos de aplicação
- Tinturas do grupo 1
- (i) Corantes ácidos
- (ii) Corantes complexos metálicos
- (iii) Corantes diretos
- (iv) Corantes básicos
- (v) Corantes dispersos
- Tinturas do Grupo 2
- i) Corantes reativos
- (ii) Corantes para cuba
- (iii) Corantes de enxofre
- Pigmentos
- Tinturas e pigmentos funcionais (alta tecnologia)
- (a) Cristais líquidos
- (b) Corantes laser
- (c) Impressão a jacto de tinta
- (d) Terapia fotodinâmica
Manipulação da cor e aplicação de corantes
Esta secção considera alguma da química por detrás da cor dos corantes e como o material alvo, por exemplo uma fibra, influencia o método de tingimento e o corante utilizado.
Um corante em solução é colorido devido à absorção selectiva de certos comprimentos de onda de luz por ligações específicas na molécula. A luz que é transmitida é vista pelo observador e aparece colorida porque faltam agora alguns dos comprimentos de onda do espectro visível.

Figure 1 Mauveine foi o primeiro corante sintético de sempre. Foi produzido acidentalmente por William Perkin em 1856, que estava tentando sintetizar o quinino. Tornou-se particularmente popular quando a Rainha Vitória usou um vestido de seda tingido com malva na Exposição Real de 1862 em Londres.
Pela gentil permissão da Society of Dyers and Colourists.
A absorção de energia da luz visível pelo composto promove elétrons na molécula a partir de um estado de baixa energia, o estado de terra, para um estado de energia mais alta, o estado excitado. Diz-se que a molécula foi submetida a uma transição electrónica durante este processo de excitação. As energias particulares de excitação correspondem a comprimentos de onda particulares da luz visível.
É um n elétron (um elétron em dupla ou tripla ligação) que é promovido ao estado excitado. Ainda menos energia necessária para esta transição se existirem ligações simples e duplas alternadas (isto é, ligações duplas conjugadas) na mesma molécula. A excitação do electrão é ainda facilitada pela presença de anéis aromáticos devido à maior deslocalização dos n electrões.
Ao alterar a estrutura do composto, os químicos da cor podem alterar o comprimento de onda da luz visível absorvida e portanto a cor do composto.
As moléculas da maioria dos compostos orgânicos coloridos contêm duas partes:
(i) um único anel de arilo (aromático) como o benzeno ou um anel de benzeno com um substituto. Alternativamente pode haver um sistema de anéis fundidos como o naftaleno (dois anéis fundidos juntos) ou o antraceno (três anéis fundidos juntos).
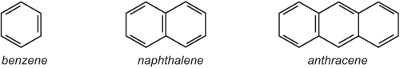
Onde os anéis se juntam, eles compartilham dois átomos de carbono e assim o naftaleno com dois anéis tem 10 átomos de carbono, não 12. Da mesma forma, o antraceno tem 14 átomos de carbono, em vez de 18. Como o naftaleno e o antraceno contêm elétrons deslocalizados em todos os anéis, é inapropriado usar o símbolo deslocalizado que é usado para o benzeno nas outras unidades, pois isso indicaria dois ou três sistemas deslocalizados separados. Assim, nesta unidade são utilizadas estruturas Kekule.
(ii) um extenso sistema de dupla ligação conjugado contendo grupos insaturados, conhecidos como cromóforos, tais como:
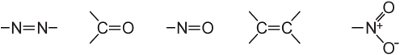
A intensidade da cor pode ser aumentada em uma molécula de corante pela adição de substitutos contendo pares solitários de elétrons ao anel arilo, tais como:
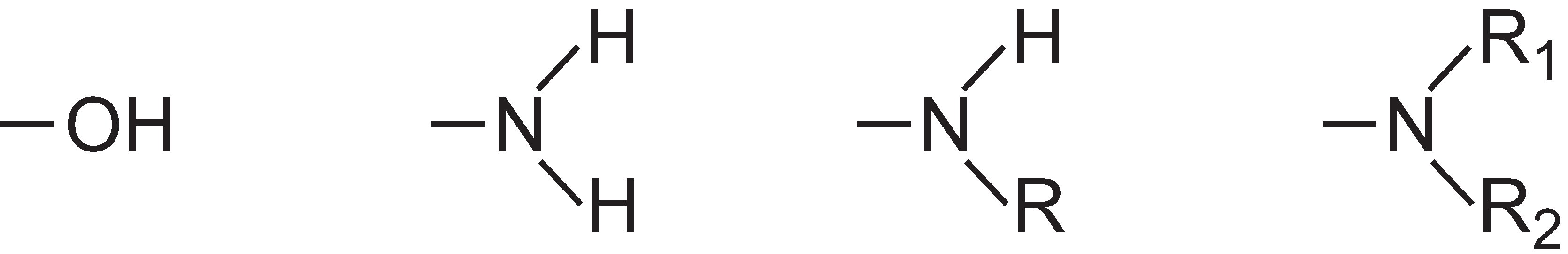
Estes grupos são conhecidos como auxocromos.
Por vezes toda a estrutura do corante é chamada de cromógeno.
Para fazer o corante de importância industrial, os químicos de cor também devem ser capazes de alterar a solubilidade do composto, e grupos podem ser incluídos para tornar o corante solúvel em água. Exemplos incluem o grupo ácido sulfónico, -SO3H, ou o grupo ácido carboxílico, -COOH, ou mais geralmente, o sal de sódio destes ácidos, -SO3-Na+ e -COO-Na+, respectivamente.
Outra preocupação chave dos químicos que desenvolvem corantes é aumentar a sua reactividade com o objecto que querem colorir, por exemplo, as moléculas da fibra. Isto é discutido abaixo e exemplos são dados ao longo da unidade.
A coloração dos têxteis
A natureza química de um corante é determinada pelas propriedades químicas e físicas das fibras do têxtil a ser colorido. Os quatro principais tipos de fibras (Tabela 1) são as proteicas, celulósicas, regeneradas (à base de celulose ou derivados) e sintéticas.
| Fibras naturais | Fibras sintéticas | ||
|---|---|---|---|
| Proteína | Celulose | Regeneradas | Sintéticas |
| Lã | Algodão | Raião viscose | Poliamidas |
| Seda | Linho | Celulose etanoatos | Polyesters |
| Mohair | Ramie | Acrylics | |
| Cashmere | |||
| O termo regenerado é usado quando um polímero natural foi tratado quimicamente para formar outro polímero. Por exemplo, a celulose natural das plantas, quando tratada com anidrido etanóico (anidrido acético), produz um polímero, o etanoato de celulose, que é o rayon. |
|||
Tabela 1 Classificação das fibras têxteis.
Durante o processo de tingimento de um tecido, o corante é distribuído entre as duas fases, a fase da fibra sólida e a fase aquosa, e no final do processo de tingimento a solução é esgotada e a maior parte do corante é associada à fibra. Uma vez que as moléculas do corante penetram na fibra, há uma interacção imediata entre os dois componentes, o que impede a dessorção das moléculas do corante de volta à solução. O tipo de interação, seja física ou química, dependerá dos grupos das moléculas do corante e das cadeias de fibras (Tabela 2).
| Tipo de ligação | Força relativa aproximada |
|---|---|
| covalente | 30.0 |
| iónica | 7.0 |
| hidrogénio | 3,0 |
| outro intermolecular | 1,0 |
Quadro 2 Forças relativas aproximadas de ligação entre um corante e um tecido.

Figure 2 Antes de se utilizar um corante, é necessário determinar a sua solidez à luz. Estes
racks, situados na costa nordeste da Austrália, são utilizados para muitos testes de
clima, entre eles a solidez da cor. A posição das estantes pode
ser alterada, mas na foto, elas estão num ângulo de 45° em relação à horizontal.
Por permissão do Laboratório de Exposição Allunga.
A solidez da cor de um tecido de cor é definida como a sua resistência à mudança quando sujeito a um conjunto particular de condições. O corante não deve ser muito afectado pela luz solar (solidez à luz), calor quando o tecido é engomado (solidez ao calor), transpiração (solidez à transpiração) e quando lavado (solidez à lavagem).
Classificação de corantes
O Colour Index International, produzido pela Society of Dyers and Colourists, em Bradford, é uma lista completa de corantes e pigmentos comerciais conhecidos e é actualizado regularmente. A cada corante é dado um Nome e Número do Índice de Cores (C.I.). Por exemplo:
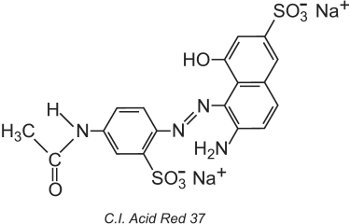
Todos os corantes da lista foram classificados pela sua estrutura química e pelo seu método de aplicação.
Classificação de corantes pela sua estrutura química
O Colour Index atribui corantes de estrutura conhecida a uma das 25 classes estruturais de acordo com o tipo químico. Entre as mais importantes estão:
a) corantes azo
b) corantes antraquinona
c) ftalocianinas
a) Corantes azo
Os corantes azo constituem a maior classe química, contendo pelo menos 66% de todos os corantes. A característica é a presença nas estruturas de um ou mais grupos azóicos,

com grupos hidroxil, aminas e grupos de aminas substituídas como auxocromos.
Azo compostos aromáticos são produzidos a partir de aminas aromáticas através do sal de diazônio correspondente.
Um sal de diazônio é formado quando uma amina aromática é tratada com ácido nitroso (nítrico(III)). O ácido nitroso é formado in situ através da adição de ácido clorídrico diluído a uma solução fria de nitrito de sódio a cerca de 278 K. No exemplo seguinte, uma solução de cloreto de benzenediazónio foi formada a partir de fenilamina (anilina), a amina aromática mais simples:

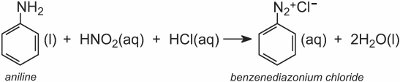
Uma solução de outro composto, como outra amina aromática ou um fenol, é então adicionada à solução fria e produz um composto azo que é corado. Um exemplo é a formação de um corante vermelho quando uma solução aquosa de ácido 4-aminonaftalenossulfónico (ácido naftónico) é adicionada a uma solução de cloreto de 4-nitrobenzenodiazónio para formar C.I. Acid Red 74:
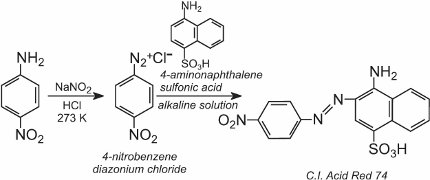
Azobenzeno é o cromóforo destes corantes azóicos,
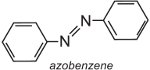
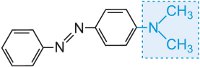
e a cor da molécula pode ser modificada e a intensidade da cor aumentada pela variação dos auxocromos (Tabela 3).
| Estrutura | Cor observada |
|---|---|
 |
amarelo…verde |
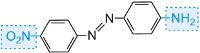 |
amarelo |
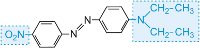 |
>vermelho |
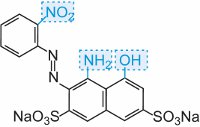 |
azul |
 |
Tabela 3 As estruturas moleculares de alguns corantes azóicos mostrando os auxocromos.
alguns corantes azo, aqueles que contêm um grupo hidroxi orto (ou para) ao grupo azo, por exemplo, C.I. Acid Orange 7, apresentam tautomerismo, um processo em que a molécula existe como duas ou mais estruturas diferentes em equilíbrio. O átomo de hidrogênio no grupo hidroxila é capaz de migrar para o átomo de nitrogênio do grupo azo e vice-versa:
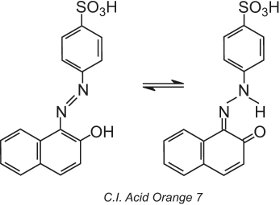
Este tipo de tautomerismo envolve um equilíbrio entre um tautomer de hidroxiazo e um tautomer de cetohidrazona, embora o tautomer de cetohidrazona geralmente domine e a cor observada é de maior comprimento de onda (um deslocamento bathochromic).
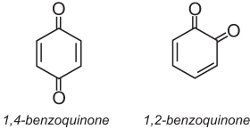
(b) Corantes antraquinona
Os corantes antraquinona representam cerca de 15% dos corantes e possuem estruturas baseadas em quinonas. A mais simples quinona é a benzoquinona, que tem dois isómeros:
Antraquinona, a mais simples das antraquinonas, é baseada em antraceno:
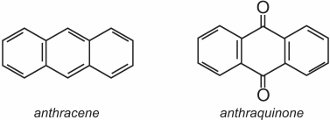
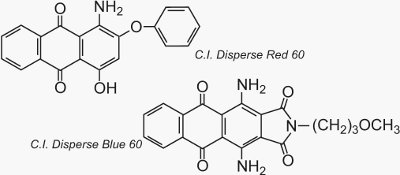
Dois exemplos bem conhecidos de antraquinonas que são usadas como corantes são as I.C. Disperse Red 60 e C.I. Disperse Blue 60:
(c) Ftalocianinas
Ftalocianinas são essencialmente constituídas por quatro moléculas de isoindole:
Estas moléculas estão ligadas umas às outras numa ftalocianina por átomos de azoto. A estrutura da ftalocianina é:
Estas moléculas estão ligadas umas às outras numa ftalocianina por átomos de nitrogénio. A estrutura da ftalocianina é:
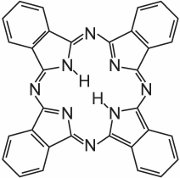
As ftalocianinas coordenam-se com átomos de metal. Os mais importantes, contribuindo com cerca de 2% de todos os corantes, são as ftalocianinas de cobre, utilizadas pelas suas cores azul e verde brilhantes. Um exemplo é C.I. Direct Blue 86:
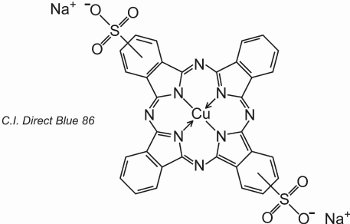
Os grupos de ácido sulfónico ajudam a solubilidade do corante em água.
A fórmula indica que os grupos de ácido sulfónico podem estar em diferentes posições nos anéis aromáticos.
Classificação dos corantes pelos métodos de aplicação
Classificação pelo método de aplicação é importante para o tintureiro têxtil aplicando o corante para produzir a cor necessária. Para obter a tonalidade requerida o tintureiro geralmente tem que fazer misturas de corantes e deve garantir que estes sejam compatíveis.
As características básicas que controlam a transferência do corante da solução para a fibra são:
- o pH da solução no tingimento (para corantes ácidos e básicos)
- um eletrólito (uma solução de sulfato de sódio ou cloreto)
- a temperatura (dentro da faixa de ambiente a 400 K)
- químicos, conhecidos como agentes dispersores, que produzem uma dispersão aquosa estável de corantes de muito baixa solubilidade
Tabela 4 lista os corantes sob os seus nomes tecnológicos que indicam como são aplicados, juntamente com as fibras às quais são aplicados.
| Corante | Fibra |
|---|---|
| Grupo 1 | |
| Ácido | Lã e outras fibras proteicas, poliamidas |
| Metal-complexo | Lã e outras fibras proteicas, poliamidas |
| Directo | Algodão, linho, viscose |
| Básico | Acrílico |
| Disperso | Poliésteres, poliamidas, etanoatos |
| Grupo 2 | |
| Reactivo | Algodão, linho, viscose, lã, seda |
| IVA | Algodão, linho, viscose |
| Sulfur | Algodão, linho |
Tabela 4 Classificação tecnológica dos corantes.
Tinturas do grupo 1
Tinturas neste grupo são caracterizadas pela sua solubilidade em água. Consequentemente, não são particularmente rápidos na lavagem. O método de aplicação envolve apenas um único estágio.
(i) Corantes ácidos
Os tipos químicos importantes são azo, antraquinona e ftalocianina, que cobrem todo o espectro visível e assim dão uma gama completa de cores. Estes corantes são solúveis em água dando espécies aniônicas. São geralmente aplicados a cerca de 373 K. Enquanto a lã e outras fibras proteicas se degradam facilmente acima desta temperatura, as fibras de poliamida (por exemplo, os nylons) podem ser tratadas a 393 K sem qualquer dano (Tabela 4).
O pH escolhido para a solução no banho corante depende das propriedades individuais dos corantes. Os valores mais baixos são obtidos pela adição de ácido sulfúrico e os valores mais altos pela adição de soluções de ácido etanóico e sulfato de amônio ou etanoato de amônio. O sulfato de sódio pode ser adicionado para controlar a difusão dos ânions de corante na estrutura da fibra.
Pela própria natureza da estrutura do corante, ligações iónicas, ligações de hidrogénio e outras interacções intermoleculares (Tabela 2) formar-se-ão entre o corante e a fibra, tornando assim os corantes rápidos. Um exemplo de um corante ácido típico é C.I. Acid Red 73:
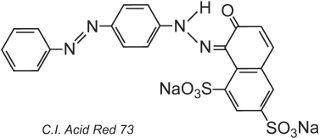
Um dos grupos azo neste tautómero está presente como a forma de cetohidrazona.
(ii) Corantes complexos metálicos
Os tipos químicos são azo e antraquinona dando uma gama de cores completa. No entanto, são mais baços do que os corantes ácidos devido à presença dentro da estrutura do corante de um átomo metálico. Os sais de crómio são frequentemente utilizados embora os sais de cobalto e níquel também sejam favorecidos.
O átomo metálico forma um complexo de coordenação com duas moléculas de um composto monoazo contendo hidroxila, carboxila ou grupos de amino nas posições de 2,2′ em relação ao grupo azo. Estes compostos são chamados de corantes “complexo metálico 1:2”. Um exemplo é C.I. Acid Violet 78:
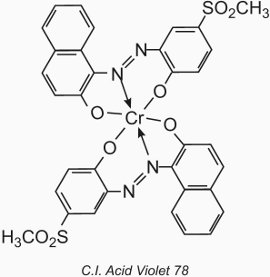
A sua aplicação à lã é semelhante à dos corantes ácidos, mas o valor do pH é restrito à faixa de 4,5 a 6,0 (Tabela 4).
(iii) Corantes diretos
Os corantes diretos são particularmente úteis para tingir fibras feitas de celulose (Tabelas 1 e 4).
Sintetizam-se com grupos de ácido sulfônico para dar-lhes solubilidade em água, dissociando-se para dar cátions sódio e as espécies de corantes aniônicos. Também estão desenhados para que sejam o mais linear e planar possível na sua estrutura. Isto permite que o corante seja fixado às cadeias celulósicas da fibra, muitas vezes por ligação intermolecular (incluindo hidrogênio).
São aplicados no banho de tintura em solução aquosa que contém cloreto de sódio. O sal reduz as forças eléctricas de repulsão entre a carga negativa na superfície da fibra e a espécie de corante aniónico.
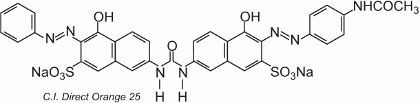
A maior parte dos corantes directos são compostos azóicos, muitas vezes contendo dois ou três grupos azóicos. Exemplos incluem C.I. Direct Orange 25 que tem -OH, -NHCO- e -N=grupos N, todos com potencial para formar ligações de hidrogênio com os grupos hidroxila na celulose:
>
O corante exibe tautomerismo, já que existem dois grupos hidroxila ortoxi para os grupos azo. Um dos tautómeros em equilíbrio com esta forma é
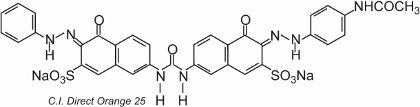
onde existem dois grupos de cetohidrazona.
Outro exemplo, C.I. Direct Blue 71, tem três grupos azo, um dos quais está presente como o tautômero da cetohidrazona:
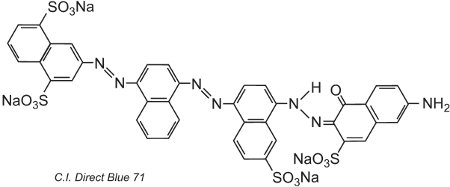
(iv) Corantes básicos
Corantes básicos estavam entre os primeiros corantes sintéticos. De facto, Mauveine é um corante básico. Os cromóforos estão presentes como catiões e são utilizados atualmente no tingimento de fibras acrílicas (geralmente um copolímero com propenonitrilo (acrilonitrilo) e uma pequena quantidade de um co-monômero que contém sulfonato, -SO3-, e carboxilato, -CO2-, grupos). Estas são interações íon-ion (Tabelas 2 e 4).
Existem cerca de 100 corantes básicos (catiônicos) cujas cores abrangem os vermelhos, amarelos e azuis, com tonalidades fortes e brilhantes. Alguns são baseados nos sistemas de cromóforos azo e antraquinona. Muitos também são baseados em íons arylcarbonium. Exemplos incluem o C.I. Basic Green 4 (conhecido como Verde Malaquite) e o C.I. Basic Red 9.
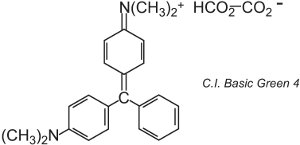 |
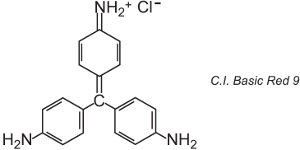 |
Estes dois são triarilmetanos, um grupo de corantes que com alterações relativamente pequenas na estrutura produzem uma gama de tonalidades de vermelho, verde e violeta.
Outros, conhecidos como corantes polimetimetânicos (contêm um ou mais grupos -CH=) também são utilizados. Eles devem a sua cor à presença de um sistema conjugado. Um exemplo de tal corante é C.I. Basic Yellow 28 que é uma diazacyanina:
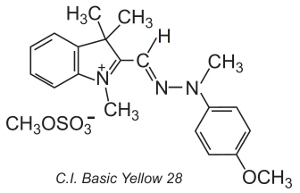
Os corantes são frequentemente aplicados numa solução de electrólito, que controla a taxa de difusão na estrutura da fibra, a temperaturas de cerca de 370 K.
(v) Corantes dispersos
Estes corantes são essencialmente hidrofóbicos e são quase insolúveis em água. No entanto, têm afinidade com fibras hidrofóbicas, por exemplo poliésteres, e são aplicados como dispersões muito finas em água (Tabela 4).
Os corantes mais dispersos são compostos azóicos e podem dar cores em todo o espectro. Alguns são corantes à base de antraquinona para vermelhos, violetas, azuis e verdes.
Fibras de poliéster podem ser tingidas a 400 K sob pressão, permitindo o uso de estruturas de corantes de maior tamanho molecular que obtêm melhor solidez, por exemplo:
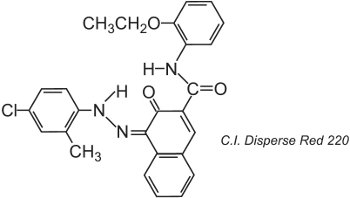
A estrutura mostrada é o tautômero de cetohidrazona.
Tinturas do Grupo 2
Embora os corantes deste grupo sejam aplicados por um processo de duas etapas (que contrasta com o processo de uma única etapa para os corantes do Grupo 1), os corantes têm vantagens, em particular com a solidez.
i) Corantes reativos
Tinturas reativas são de extrema importância para o tingimento do algodão, permitindo uma coloração intensa e brilhante com alta solidez. Aproximadamente 95% dos corantes reactivos são corantes azóicos cobrindo toda a gama de cores. Os azuis e verdes também são fornecidos por estruturas de antraquinona e ftalocianina.
Como o nome destes corantes sugere, eles reagem com a fibra, seja celulósica (algodão) ou proteica (lã) para formar ligações covalentes (Tabela 4). Os dois estágios, primeiro o tingimento, depois a reação, podem ocorrer separadamente ou simultaneamente. A característica estrutural é a presença de um ou mais grupos reactivos. Tipicamente os corantes são representados como
D-B-RG
onde D é o cromogénio, B um grupo ponte e RG o grupo reactivo.
Os grupos reactivos mais importantes são as triazinas cloradas e as vinilsulfonas.
Um dos três isómeros da triazina mais simples é:
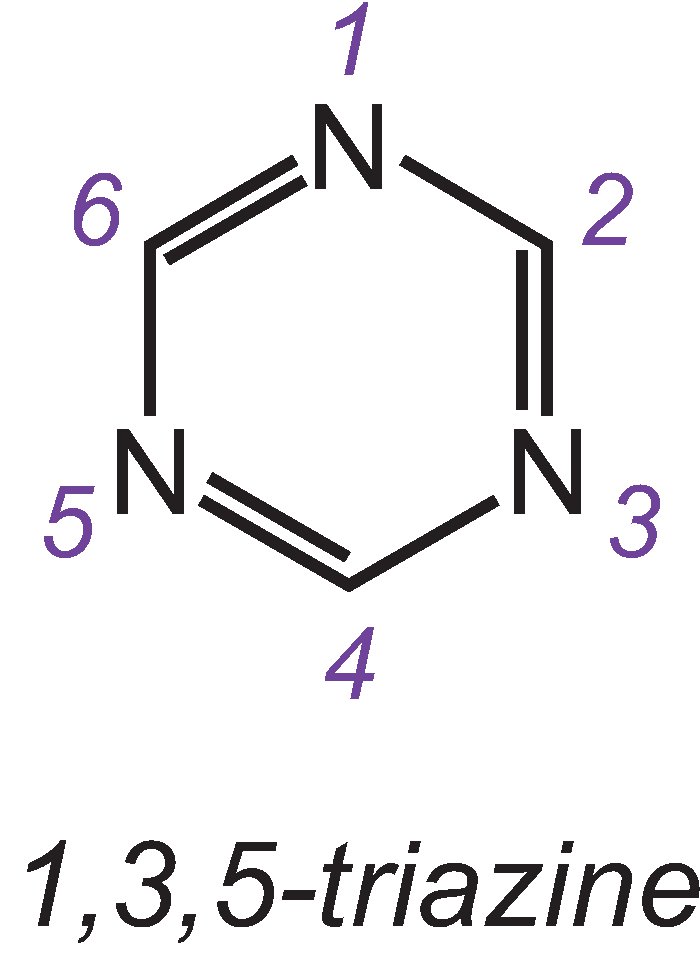
Um exemplo de um corante com um grupo de diclorotriazina é o C.I. Azul Reativo 109:
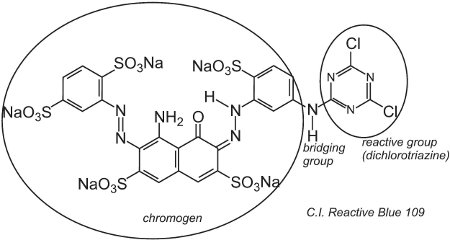
A reação entre os grupos -OH da celulose na fibra e os grupos -C-Cl na clorotriazina é por uma reação de substituição (nucleofílica) para formar ligações covalentes.
Um etenil (vinil) sulfona contém o grupo CH2=CHSO2 e o mais simples é a dietenilsulfona (divinilsulfona). O grupo de sulfona pode ser visto em C.I. Reactive Blue 19:
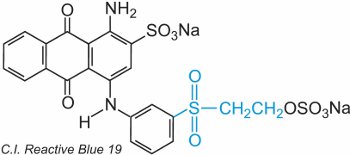
Neste exemplo, não há grupo de ponte.
O corante reage com a celulose por adição à dupla ligação enxofre-oxigénio.
Corantes reactivos, na solução aquosa, podem sofrer hidrólise do sulfona tornando-o não reactivo à celulose. Isto significa que o corante não reagido, se não for lavado adequadamente, permanecerá na superfície do tecido, dando uma cor aparente que se desprende com o tempo. Para reduzir este problema, os corantes foram concebidos com dois grupos reactivos diferentes de reactividade diferente. Estes corantes oferecem maior rapidez porque se um dos grupos for hidrolisado em solução, o outro reagirá com os grupos hidroxil do tecido. O primeiro destes incluiu tanto um grupo clorotriazina como um grupo vinilsulfona e um exemplo é C.I. Reactive Red 194:
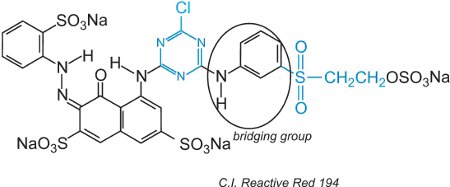
Beside os dois diferentes grupos reactivos, existe um cromogénio e um grupo ponte.
Todos os corantes reactivos têm um tamanho molecular relativamente pequeno e também têm dois ou mais grupos de ácido sulfónico no cromogénio, levando a uma alta solubilidade em água. Uma proporção de espécies de corantes (aniônicos) não reage com a fibra e é hidrolisada e o produto deve ser removido por lavagem.

Figure 3 Jeans são tingidos com anil e uma variedade de corantes sulfurosos, a escolha depende da cor desejada.
Por permissão da Lizzie Hubbard.
(ii) Corantes para cuba
Aproximadamente 80% dos corantes para cuba pertencem à classe química dos corantes antraquinona e cobrem toda a gama de cores. Um tipo, os corantes índigoides, inclui índigo:
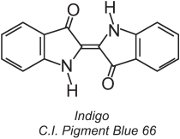
Todos os corantes de cuba são insolúveis em água. Para aplicá-los a uma fibra, por exemplo o algodão, são colocados numa solução alcalina (Tabela 4). O corante insolúvel é reduzido para formar um ânion incolor (leuco) que é solúvel e possui afinidade com a fibra. Este é então adsorvido pela fibra, por vezes na presença de cloreto de sódio, condições semelhantes às das tinturas directas. Após o processo de tingimento o corante pai insolúvel original é regenerado dentro da fibra por oxidação, geralmente usando uma solução de peróxido de hidrogênio ou simplesmente ar:
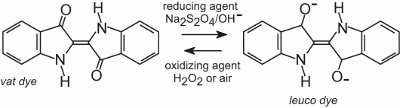
Os corantes são insolúveis dentro da estrutura da fibra e portanto possuem boa solidez de lavagem e também possuem alta solidez à luz.
(iii) Corantes de enxofre
Corantes de enxofre como corantes de cuba são aplicados aos têxteis (celulose, tabela 4) como uma forma aniônica solúvel e depois oxidada na forma insolúvel.
C.I. Sulphur Black 1 e C.I. Sulphur Blue 7 estão entre os corantes de enxofre mais amplamente utilizados. Como outros corantes de enxofre, suas estruturas são variáveis e largamente desconhecidas. Eles fornecem uma gama de pretos, marrons e azuis baço. Eles são no entanto muito mais baratos do que os corantes de cuba para produzir porque a sua preparação por aquecimento de vários compostos orgânicos com enxofre, é simples.
Pigmentos
Pigmentos são usados na coloração de tintas, tintas de impressão, cerâmicas e plásticos. Podem ser utilizados numa variedade muito maior de substâncias do que os corantes porque não dependem da solubilidade da água para a sua aplicação. Um pigmento é um sólido finamente dividido que é essencialmente insolúvel no seu meio de aplicação. Na maioria dos casos, o pigmento é adicionado a um meio líquido, por exemplo, uma tinta húmida ou um termoplástico fundido. O meio é então autorizado a solidificar por evaporação de solvente ou resfriamento e assim as moléculas do pigmento tornam-se fixadas mecanicamente no estado sólido.
Os cromóforos usados nos pigmentos são geralmente os mesmos usados nos corantes, mas os pigmentos são moléculas grandes e não têm grupos solubilizantes. Eles contêm grupos que formam ligações intermoleculares que ajudam a reduzir as solubilidades. Quanto maior a molécula, mais opaco é o pigmento.

| Figuras 4 e 5 Os corantes vermelho e amarelo são pigmentos azo (C.I. Pigmento Vermelho 57 e C.I. Pigmento Amarelo 13). O azul é o pigmento cobre ftalocianina. Por permissão da BASF. |
 |
Os pigmentos orgânicos geralmente produzem uma intensidade e brilho de cor superiores aos pigmentos inorgânicos como o amarelo cromado (cromato de chumbo(II)(VI)).
Os pigmentos orgânicos apresentam uma gama de propriedades de solidez que dependem da estrutura molecular e da natureza da associação intramolecular no estado sólido. Um aumento no tamanho molecular de um pigmento geralmente diminui a solubilidade do pigmento. Também muitos pigmentos têm o grupo amida (-NHCO-) incorporado, o que diminui ainda mais a sua solubilidade à medida que as moléculas são mantidas juntas em grandes estruturas por ligação de hidrogénio (entre o grupo N-H numa molécula e um grupo C=O noutra).
Muitos pigmentos orgânicos são baseados na química azo e dominam as áreas de sombra amarela, laranja e vermelha. Um exemplo de um pigmento monoazo simples é C.I. Pigmento Amarelo 1:
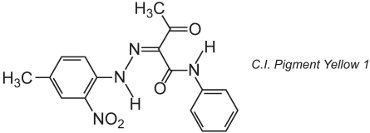
Esta forma é o tautômero de cetohidrazona.
Ftalocianinas de cobre fornecem a maioria dos pigmentos azuis e verdes. Eles são estruturalmente complexos mas são relativamente baratos de fazer. Eles fornecem excelente resistência à luz, calor, ácidos e álcalis.
Um exemplo é C.I. Pigment Blue 15:
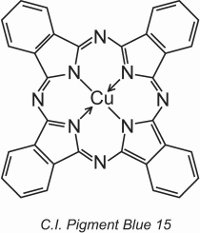
Earlier na unidade, a estrutura de um corante, C.I. Direct Blue 86, foi mostrado e pode ser visto como os grupos de ácido sulfônico naquela estrutura transformam um pigmento em um corante.
Tinturas e pigmentos funcionais (alta tecnologia)
Tinturas e pigmentos funcionais são produzidos em pequenos volumes em comparação com os compostos usados para tingir tecidos. No entanto, são objecto de muita pesquisa e interesse e estão a ser desenvolvidos para uma variedade de fins. Alguns destes são ilustrados abaixo.
(a) Cristais líquidos
Cristais líquidos têm desempenhado um papel importante em nossas vidas por muitos anos em várias formas de exibição de informação, por exemplo, calculadoras. Inicialmente eles só podiam exibir diferenças entre o claro e o escuro. Descobriu-se que, usando corantes, este contraste podia ser aumentado e telas coloridas podiam ser produzidas. Agora eles substituíram em grande parte as tecnologias tradicionais de exibição de diodos emissores de luz e tubos de raios catódicos. Os corantes utilizados foram especificamente concebidos para mudar a orientação com as moléculas de cristal líquido e, portanto, oferecem uma maior intensidade de cor. Diz-se que estes corantes exibem dicroísmo.
(b) Corantes laser
O termo laser é um acrônimo referente à amplificação de luz por emissão estimulada de radiação.
Lasers inorgânicos comuns foram usados, mas só tinham a capacidade de produzir radiação em alguns comprimentos de onda selecionados e em bandas muito estreitas. O uso de corantes tem permitido a produção de luz em todo o espectro de comprimentos de onda de 320 a 1200 nm. A aplicação de lasers de corantes inclui tecnologia de comunicação e microcirurgia.
(c) Impressão a jacto de tinta
A impressão a jacto de tinta é uma técnica sem impacto para produzir imagens direccionando pequenas gotas de tinta, idealmente sob controlo informático, em rápida sucessão para um substrato. Tem encontrado muitas aplicações. Devido aos requisitos de tamanho para que as gotas sejam capazes de alcançar uma boa definição, o uso de corantes tem sido favorecido em relação aos pigmentos. As gotas são menores (os pigmentos tendem a bloquear os bicos) e a solubilidade aquosa reduz o impacto ambiental e mantém o preço baixo. Os primeiros corantes eram os já utilizados em outras indústrias, mas caracterizavam-se por uma fraca solidez da água. Isto levou ao desenvolvimento de corantes específicos e sistemas fluidos únicos. Estes corantes são projetados para serem solúveis em sistemas ligeiramente alcalinos (pH 7,5 a 10) que são tornados insolúveis pelas condições ligeiramente ácidas (pH 4,5 a 6,5) no papel ou outro substrato. Esta tecnologia está tendo um grande impacto na impressão industrial de alto volume para embalagens, têxteis, revestimentos de parede e displays publicitários.
(d) Terapia fotodinâmica
Este é um tratamento para o câncer que utiliza uma combinação de luz laser, um composto fotossensibilizante (o corante) e oxigênio molecular. O corante é administrado ao paciente por via intravenosa e ao longo do tempo entra nas células cancerosas. A irradiação das células com luz laser pode iniciar a sua destruição.
O laser interage com o corante e promove-o ao seu estado excitado. Através de um processo complexo, são produzidas moléculas de oxigênio excitadas (mais reativas) que reagem com centros insaturados nas proteínas e lipídios da membrana celular. Este método de tratamento evita o uso de cirurgia invasiva.