Lärandemål
- Förklara varför alkoholers kokpunkter är högre än etrars och alkaners kokpunkter med liknande molmassa.
- Förklara varför alkoholer och etrar med fyra eller färre kolatomer är lösliga i vatten medan jämförbara alkaner inte är lösliga.
Alkoholer kan betraktas som derivat av vatten (H2O; skrivs även som HOH).

Likt H-O-H-bindningen i vatten är R-O-H-bindningen böjd och alkoholmolekyler är polära. Detta förhållande är särskilt tydligt i små molekyler och återspeglas i de fysikaliska och kemiska egenskaperna hos alkoholer med låg molmassa. Genom att ersätta en väteatom från en alkan med en OH-grupp kan molekylerna associeras genom vätebindning (figur \(\PageIndex{1}\)).
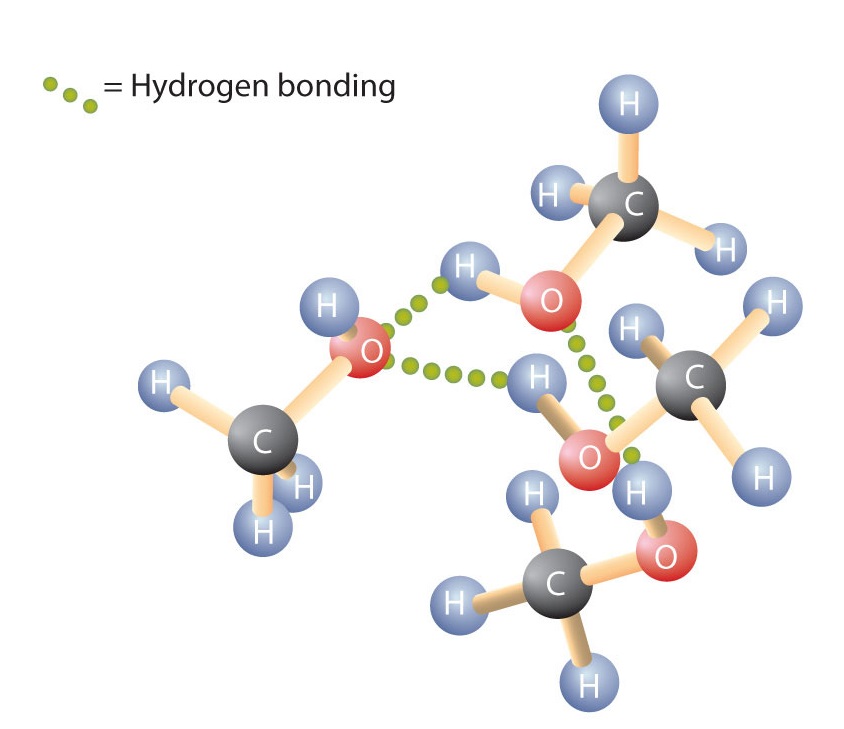
Håll dig i minnet att fysiska egenskaper till stor del bestäms av typen av intermolekylära krafter. I tabell \(\PageIndex{1}\) listas de molära massorna och kokpunkterna för några vanliga föreningar. Tabellen visar att ämnen med liknande molarmassa kan ha helt olika kokpunkter.
| Formel | Namn | Molarmassa | Kokpunkt (°C) |
|---|---|---|---|
| CH4 | metan | 16 | -164 |
| HOH | vatten | 18 | 100 |
| C2H6 | etan | 30 | -89 |
| CH3OH | metanol | 32 | 65 |
| C3H8 | propan | 44 | -42 |
| CH3CH2OH | etanol | 46 | 78 |
| C4H10 | butan | 58 | -1 |
| CH3CH2CH2OH | 1-propanol | 60 | 97 |
Alkaner är opolära och associeras därför endast genom relativt svaga dispersionskrafter. Alkaner med en till fyra kolatomer är gaser vid rumstemperatur. Däremot är även metanol (med en kolatom) en vätska vid rumstemperatur. Vätgasbindning ökar kraftigt alkoholernas kokpunkter jämfört med kolväten med jämförbar molmassa. Kokpunkten är ett grovt mått på den energimängd som krävs för att separera en vätskemolekyl från sina närmaste grannar. Om molekylerna interagerar genom vätebindning måste en relativt stor mängd energi tillföras för att bryta dessa intermolekylära attraktioner. Först då kan molekylen fly från vätskan till gasformigt tillstånd.
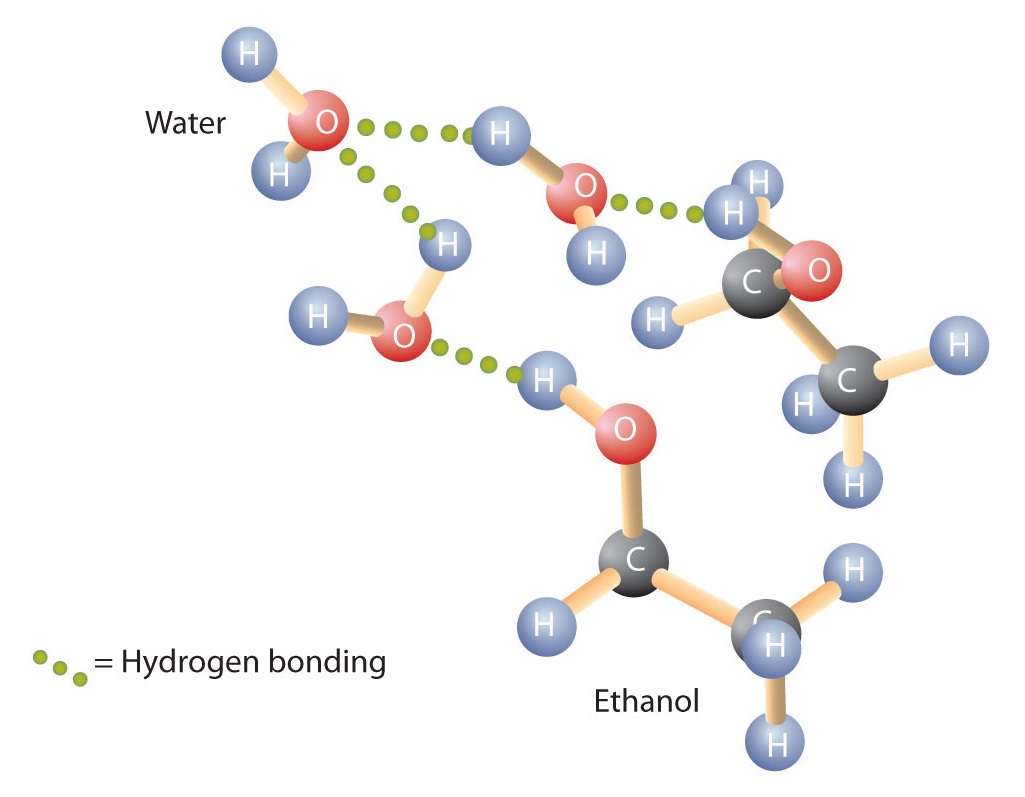
Alkoholer kan också ha vätebindning med vattenmolekyler (figur \(\PageIndex{2}\)). Medan kolväten är olösliga i vatten är alkoholer med en till tre kolatomer helt lösliga. När kedjans längd ökar minskar dock alkoholernas löslighet i vatten; molekylerna blir mer lika kolväten och mindre lika vatten. Alkoholen 1-dekanol (CH3CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2OH) är i princip olöslig i vatten. Vi finner ofta att gränsen för löslighet i en familj av organiska föreningar går vid fyra eller fem kolatomer.
Sammanfattning
Alkoholer har högre kokpunkt än etrar och alkaner med liknande molarmassa eftersom OH-gruppen gör det möjligt för alkoholmolekylerna att engagera sig i vätebindning. Alkoholer med fyra eller färre kolatomer är lösliga i vatten eftersom alkoholmolekylerna har vätebindning med vattenmolekyler; jämförbara alkanmolekyler kan inte ha vätebindning.
Konceptgenomgångsövningar
-
Varför är etanol mer löslig i vatten än 1-hexanol?
-
Varför har 1-butanol en lägre kokpunkt än 1-hexanol?
Svar
-
Etanol har en OH-grupp och endast 2 kolatomer; 1-hexanol har en OH-grupp för 6 kolatomer och liknar därmed mer ett (opolärt) kolväte än vad etanol är.
-
Molmassan för 1-hexanol är större än för 1-butanol.
Övningar
Svar på följande övningar utan att konsultera tabeller i texten.
-
Sortera dessa alkoholer i ordning efter stigande kokpunkt: etanol, metanol och 1-propanol.
-
Vad har den högre kokpunkten – butan eller 1-propanol?
-
Rangera dessa alkoholer i ordning efter ökande löslighet i vatten: 1-butanol, metanol och 1-oktanol.
-
Rangera dessa föreningar i ordning efter ökande löslighet i vatten: 1-butanol, etanol och pentan.
Svar
-
metanol < etanol < 1-propanol
-
1-oktanol < 1-butanol < metanol