Entropi
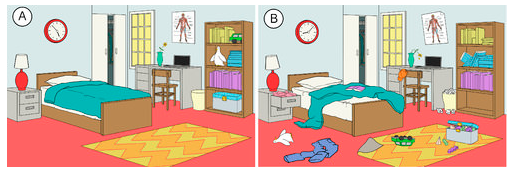
Det finns en tendens i naturen att system går mot ett tillstånd av större oordning eller slumpmässighet. Entropi är ett mått på graden av slumpmässighet eller oordning i ett system. Entropi är ett enkelt begrepp att förstå när man tänker på vardagliga situationer. Entropin i ett rum som nyligen har städats och organiserats är låg. Med tiden kommer det sannolikt att bli mer oordnat och därmed kommer dess entropi att öka (se figuren nedan). Den naturliga tendensen i ett system är att entropin ökar.
Kemiska reaktioner tenderar också att gå till så att systemets totala entropi ökar. Hur kan man se om en viss reaktion uppvisar en ökning eller minskning av entropin? Reaktanternas och produkternas molekylära tillstånd ger vissa ledtrådar. De allmänna fallen nedan illustrerar entropin på molekylär nivå.
- För ett givet ämne är entropin i flytande tillstånd större än entropin i fast tillstånd. På samma sätt är gasens entropi större än vätskans entropi. Därför ökar entropin i processer där fasta eller flytande reaktanter bildar gasformiga produkter. Entropin ökar också när fasta reaktanter bildar flytande produkter.
- Entropin ökar när ett ämne delas upp i flera delar. Upplösningsprocessen ökar entropin eftersom lösta partiklar separeras från varandra när en lösning bildas.
- Entropin ökar när temperaturen ökar. En temperaturökning innebär att ämnets partiklar har större rörelseenergi. De partiklar som rör sig snabbare har mer oordning än partiklar som rör sig långsammare vid en lägre temperatur.
- Entropin ökar i allmänhet i reaktioner där det totala antalet produktmolekyler är större än det totala antalet reaktantmolekyler. Ett undantag från denna regel är när en gas produceras från icke gasformiga reaktanter.
Exemplen nedan illustrerar hur entropiförändringen i en reaktion kan förutsägas.
\(\ce{Cl_2} \left( g \right) \rightarrow \ce{Cl_2} \left( l \right)\)
Entropen minskar eftersom en gas blir en vätska.
\(\ce{CaCO_3} \left( s \right) \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right)\)
Entropen ökar eftersom en gas produceras och antalet molekyler ökar.
\(\ce{N_2} \left( g \right) + 3 \ce{H_2} \left( g \right) \rightarrow 2 \ce{NH_3} \left( g \right)\)
Entropen minskar eftersom totalt fyra reaktantmolekyler bildar totalt två produktmolekyler. Alla är gaser.
\(\ce{AgNO_3} \left( aq \right) + \ce{NaCl} \left( aq \right) \rightarrow \ce{NaNO_3} \left( aq \right) + \ce{AgCl} \left( s \right)\)
Entropen minskar eftersom ett fast ämne bildas från vattenhaltiga reaktanter.
\(\ce{H_2} \left( g \right) + \ce{Cl_2} \left( g \right) \rightarrow 2 \ce{HCl} \left( g \right)\)
Entropsförändringen är okänd (men sannolikt inte noll), eftersom det finns lika många molekyler på båda sidor av ekvationen och alla är gaser.