Atommodellen
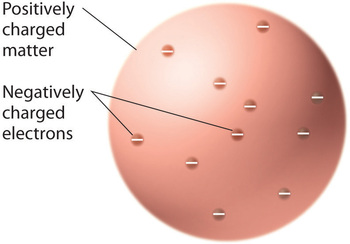
När forskarna kom fram till att all materia innehåller negativt laddade elektroner stod det klart att atomer, som är elektriskt neutrala, också måste innehålla positiva laddningar för att balansera de negativa. Thomson föreslog att elektronerna var inbäddade i en enhetlig sfär som innehöll både den positiva laddningen och större delen av atomens massa, ungefär som russin i plommonpudding eller chokladbitar i en kaka (Figur \(\PageIndex{9}\))
2.4.6
Figur \(\PageIndex{9}\): Thomsons modell av atomen i plommonpudding eller chokladkaka. I denna modell är elektronerna inbäddade i en enhetlig sfär med positiv laddning. Bilden används med tillstånd (CC BY-SA-NC).
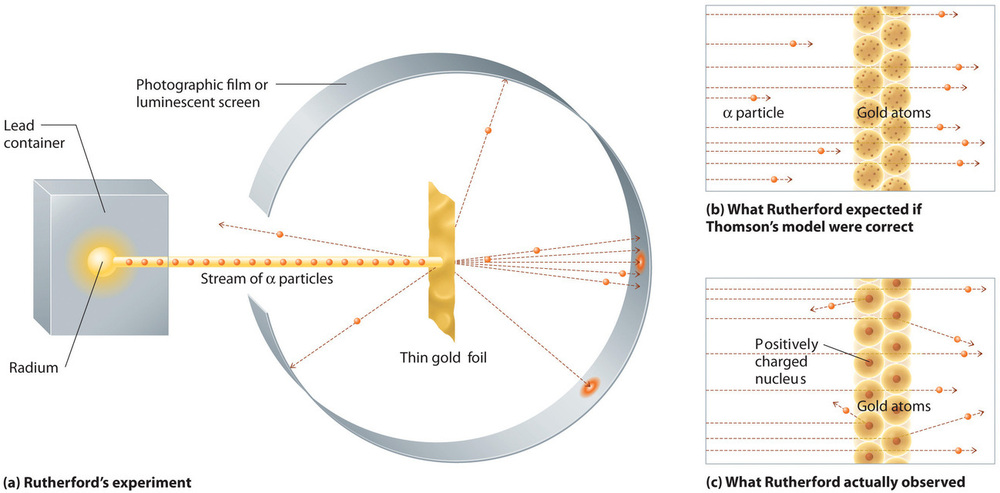
I ett enda berömt experiment visade Rutherford dock otvetydigt att Thomsons modell av atomen var felaktig. Rutherford riktade en ström av α-partiklar mot ett mycket tunt mål av guldfolie (figur \(\PageIndex{10a}\)) och undersökte hur α-partiklarna spreds av folien. Guld valdes eftersom det lätt kunde hamras till extremt tunna skivor, vilket minimerade antalet atomer i målet. Om Thomsons modell av atomen var korrekt skulle de positivt laddade α-partiklarna krascha genom guldmålets jämnt fördelade massa som kanonkulor genom sidan på ett trähus. De kanske rörde sig lite långsammare när de dök upp, men de borde i huvudsak passera rakt igenom målet (Figur \(\PageIndex{10b}\))Till Rutherfords förvåning avböjdes en liten del av α-partiklarna i stora vinklar, och en del reflekterades direkt tillbaka till källan (Figur \(\(\PageIndex{10c}\)). Enligt Rutherford ”var det nästan lika otroligt som om du sköt en 15-tums granat mot en bit silkespapper och den kom tillbaka och träffade dig.”
2.4.7
Figur \(\PageIndex{10}\): En sammanfattning av Rutherfords experiment. (a) En representation av den apparat som Rutherford använde för att upptäcka avböjningar i en ström av α-partiklar som riktades mot ett tunt mål av guldfolie. Partiklarna producerades av ett radiumprov. (b) Om Thomsons modell av atomen var korrekt borde α-partiklarna ha passerat rakt igenom guldfolien. (c) Ett litet antal α-partiklar avleddes dock i olika riktningar, bland annat rakt tillbaka till källan. Detta kunde bara vara sant om den positiva laddningen var mycket mer massiv än α-partikeln. Det tydde på att guldatomens massa är koncentrerad till ett mycket litet område i rymden, som han kallade kärnan. Bild används med tillstånd (CC BY-SA-NC).
Rutherfords resultat stämde inte överens med en modell där massan och den positiva laddningen är jämnt fördelade över atomens volym. Istället tyder de starkt på att både massan och den positiva laddningen är koncentrerade till en liten del av en atoms volym, som Rutherford kallade kärnan. Det var logiskt att en liten del av α-partiklarna kolliderade med de täta, positivt laddade atomkärnorna antingen på ett glidande sätt, vilket resulterade i stora avböjningar, eller nästan rakt mot huvudet, vilket ledde till att de reflekterades rakt tillbaka till källan.
Och även om Rutherford inte kunde förklara varför repulsioner mellan de positiva laddningarna i kärnor som innehöll mer än en positiv laddning inte ledde till att kärnan upplöstes, resonerade han att repulsioner mellan negativt laddade elektroner skulle leda till att elektronerna fördelades jämnt över atomens volym. idag vet man att starka kärnkrafter, som är mycket starkare än elektrostatiska växelverkningar, håller ihop protonerna och neutronerna i atomkärnan. För denna och andra insikter tilldelades Rutherford Nobelpriset i kemi 1908. Tyvärr skulle Rutherford ha föredragit att få Nobelpriset i fysik eftersom han ansåg att fysik var bättre än kemi. Enligt honom är all vetenskap antingen fysik eller frimärkssamling.”
 2.4.8
2.4.8
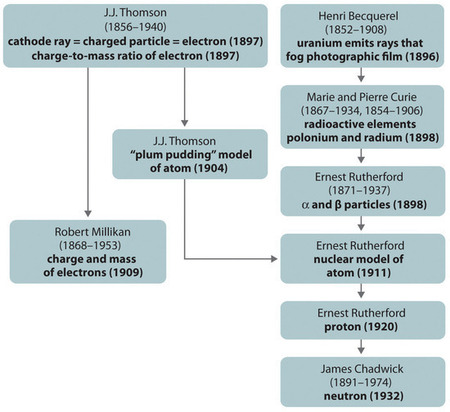
Figur \(\PageIndex{11}\): En sammanfattning av den historiska utvecklingen av modellerna för atomens beståndsdelar och struktur. Datumen inom parentes är de år då de viktigaste experimenten utfördes. Bilden används med tillstånd (CC BY-SA-NC).
Den historiska utvecklingen av de olika modellerna av atomens struktur sammanfattas i (Figur \(\(\PageIndex{11}\)). Rutherford fastställde att väteatomens kärna var en positivt laddad partikel, för vilken han myntade namnet proton 1920. Han föreslog också att kärnorna i andra grundämnen än väte måste innehålla elektriskt neutrala partiklar med ungefär samma massa som protonen. Neutronen upptäcktes dock inte förrän 1932, då James Chadwick (1891-1974, elev till Rutherford; Nobelpris i fysik 1935) upptäckte den. Som ett resultat av Rutherfords arbete stod det klart att en α-partikel innehåller två protoner och neutroner, och är därför kärnan i en heliumatom.
2.4.9
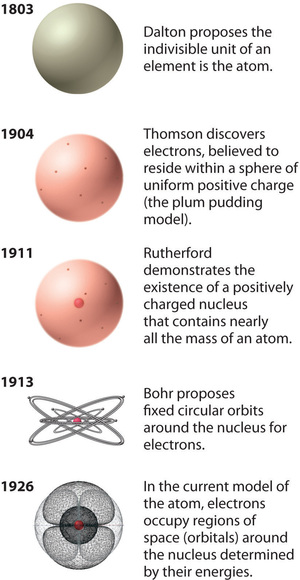
Figur \(\PageIndex{12}\): Atomteorins utveckling, illustrerad av modeller av syreatomen. Bohrs modell och den nuvarande modellen beskrivs i kapitel 6, ”Atomernas struktur”. Bilden används med tillstånd (CC BY-SA-NC).
Rutherfords modell av atomen är i stort sett densamma som den moderna modellen, förutom att man nu vet att elektronerna inte är jämnt fördelade över atomens volym. Istället fördelas de enligt en uppsättning principer som beskrivs av kvantmekaniken. Figur \(\PageIndex{12}\) visar hur atommodellen för atomen har utvecklats över tid från Daltons odelbara enhet till den moderna syn som lärs ut idag.