Autoimmun hemolytisk anemi (AIHA) förmedlas av antikroppar, och i de flesta fall är immunoglobulin (Ig) G den medierande antikroppen. Denna typ av AIHA kallas ”varm” AIHA eftersom IgG-antikroppar binder bäst vid kroppstemperatur. ”Kall” AIHA förmedlas av IgM-antikroppar, som binds maximalt vid temperaturer under 37 °C. AIHA orsakad av en läkemedelsreaktion är sällsynt, med en uppskattad årlig incidens på 1:1 000 000 för allvarlig läkemedelsrelaterad AIHA.1 I den här artikeln granskas hanteringen av de vanligaste typerna av AIHA, med fokus på varm, kall och läkemedelsinducerad AIHA; utvärderingen och diagnosen av AIHA granskas i en separat artikel.
Varm autoimmun hemolytisk anemi
I AIHA medieras hemolysen av antikroppar som binder sig till ytan av röda blodkroppar. AIHA där IgG-antikroppar är de felande antikropparna kallas varm AIHA. ”Varm” syftar på att antikroppen binder bäst vid kroppstemperatur (37 °C). Vid varm AIHA visar testerna IgG-molekyler som är bundna till de röda blodkropparnas yta, och 50 % av patienterna uppvisar även C3. Mellan 50 % och 90 % av AIHA-fallen beror på varma antikroppar.2,3 Incidensen av varm AIHA varierar beroende på serie men är ungefär 1 fall per 100 000 patienter per år; denna form av hemolys drabbar kvinnor oftare än män.4,5
Terapeutiska alternativ
Första linjen
Steroider. Målet med behandlingen vid varm AIHA kan vara svårt att definiera. De flesta håller dock med om att en hematokrit över 30 % (eller högre för att förhindra symtom) med en minimal ökning av retikulocytantalet – som återspeglar en betydligt långsammare hemolytisk process – är ett rimligt mål. Initial behandling av varm AIHA är prednison i en standarddos på 1 mg/kg dagligen (tabell 1).6,7 Patienterna bör också börja få protonpumpshämmare för att förebygga sår. Det kan ta upp till 3 veckor innan patienterna svarar på prednisonbehandling. När patientens hematokrit är över 30 % minskas prednisonet långsamt. Även om cirka 80 % av patienterna svarar på steroiderna kan endast 30 % av patienterna avvecklas helt från steroiderna. För patienter som kan bibehållas på en daglig steroiddos på 10 mg eller mindre kan steroider vara den mest rimliga långtidsbehandlingen. Eftersom aktiv hemolys leder till ett ökat behov av folsyra förskrivs patienter med varm AIHA dessutom ofta folsyra 1 mg dagligen för att förhindra megaloblastisk anemi på grund av folsyrabrist.
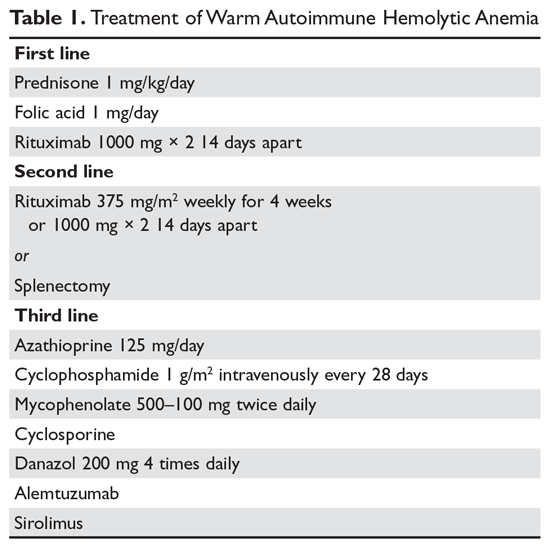
Rituximab. Allt oftare läggs rituximabbehandling (anti-CD20) till de initiala steroiderna. Två kliniska prövningar visade både ökade svar på lång och kort sikt vid användning av rituximab.8,9 Ett viktigt övervägande är att de flesta patienter svarar gradvis på rituximab under flera veckor, så man bör inte förvänta sig ett snabbt svar. De flesta studier har använt den traditionella doseringen 375 mg/m2 varje vecka i 4 veckor. Dessa svar verkar vara hållbara, men liksom vid immun trombocytopeni (ITP) är upprepad behandling med rituximab effektiv.
De viktigaste biverkningarna av rituximab är infusionsreaktioner, som ofta är värre vid den första dosen. Dessa reaktioner kan kontrolleras med antihistaminer, steroider och, vid svår rigor, meperidin. I sällsynta fall kan patienterna utveckla neutropeni (cirka 1:500) som verkar vara autoimmun till sin natur. Infektioner verkar endast öka minimalt vid användning av rituximab.10 En riskgrupp är kroniska bärare av hepatit B-virus, som kan drabbas av en reaktivering av viruset som kan vara dödlig. Därför måste patienter som övervägs för rituximab screenas för bärarskap av hepatit B-virus.11 Patienter som får rituximab löper en mycket liten risk för progressiv multifokal leukoencefalopati, som är vanligare hos patienter med cancer och hos kraftigt immunsupprimerade patienter. Den totala risken är okänd men är mindre än 1:50 000.