Det kemiska grundämnet helium klassificeras som en ädelgas och en icke-metall. Det upptäcktes 1895 av William Ramsay.

Datazon
| Klassificering: | Helium är en ädelgas och en icke-metallisk | |
| Färg: | Färgfri | Färglös |
| Atomvikt: | 4.00260 | |
| Tillstånd: | gas | |
| Smältpunkt: | -272,2 oC, 0,95 K | |
| Anmärkningar: Vid normalt atmosfärstryck stelnar inte helium och har därför ingen smältpunkt. Den smältpunkt som anges ovan gäller vid ett tryck på 25 atmosfärer. | ||
| Skokpunkt: | -268,9 oC, 4.2 K | |
| Elektroner: | 2 | |
| Protoner: | 2 | |
| Neutroner i den vanligaste isotopen: | 2 | |
| Elektronskal: | 2 | |
| Elektronkonfiguration: | 1s2 | |
| Täthet vid 20oC: | 0.0001787 g/cm3 | |
Visa mer, inklusive: Värmekällor, energier, oxidation,
reaktioner, föreningar, radier, ledningsförmåga
| Atomvolym: | 27,2 cm3/mol |
| Struktur: | vanligen hexagonalt tätt packat |
| (v.högt tryck som krävs för att stelna helium) | |
| Specifik värmekapacitet | 5.193 J g-1 K-1 |
| Smältningsvärme | 0.0138 kJ mol-1 |
| Förbränningsvärme | 0 |
| Förångningsvärme | 0.0845 kJ mol-1 |
| 1:a joniseringsenergi | 2372.3 kJ mol-1 |
| 2:a joniseringsenergi | – |
| 3:a joniseringsenergi | – |
| Elektronaffinitet | 0 kJ mol-1 |
| Minsta oxidationstal | 0 |
| Min. | 0 |
| Maximalt oxidationsnummer | 0 |
| Maximalt gemensamt oxidationsnummer. | 0 |
| Elektronegativitet (Paulingskala) | – |
| Volym för polariserbarhet | 0.198 Å3 |
| Reaktion med luft | ingen |
| Reaktion med 15 M HNO3 | ingen |
| Reaktion med 6 M HCl | ingen |
| Reaktion med 6 M NaOH | ingen |
| Oxid(er) | ingen |
| Hydrid(er) | ingen |
| Klorid(er) | ingen |
| Atomradie | 31 pm |
| Ionradie (1+ jon) | – |
| Ionisk radie (2+ jon) | – |
| Ionisk radie (3+ jon) | – |
| Jonisk radie (1- jon) | – |
| Jonisk radie (2-jon) | – |
| Jonisk radie (3-jon) | – |
| Värmeledningsförmåga | 0.15 W m-1 K-1 |
| Elektrisk ledningsförmåga | – |
| Frys- och smältpunkt: | -272,2 oC, 0.95 K |

Nasa: Joniserade heliumatomer vid cirka 60 000 °C i solens kromosfär avger det ultravioletta ljuset som syns på denna bild.
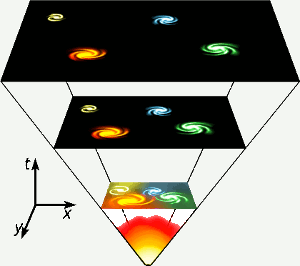
Helium tillverkades under de första tre minuterna av universums existens, när temperaturen överallt var tillräckligt hög för att kärnfusion skulle kunna ske. Denna korta fas med hög energi representeras längst ner i diagrammet. Helium tillverkas också genom kärnfusion av väte i stjärnor som vår egen. Bild: Gnixon
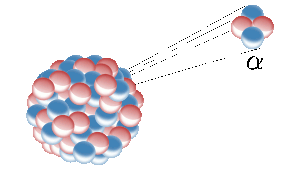
Helium på jorden kommer från kärnklyvning av radioaktiva grundämnen som uran. Här avger en radioaktiv kärna en heliumkärna (även kallad alfapartikel). Bild: Inductiveload

Heliums spektrum med framträdande gul linje. Bild: Nasa

William Ramsay pekar på det periodiska systemets sista kolumn som innehåller de ädla (eller inerta) gaserna. Ramsay tilldelades Nobelpriset i kemi 1904 för sitt arbete med upptäckten av de inerta gaserna. Bild: Vanity Fair
Upptäckten av helium
Historien om heliums upptäckt är sammanvävd med upptäckten av stjärnornas natur.
En gång i tiden trodde folk att vi aldrig skulle få veta vad stjärnor är gjorda av. År 1835 förklarade den franske filosofen Auguste Comte att ”vi aldrig på något sätt kommer att kunna studera deras kemiska sammansättning”. (1)
Comte trodde att vi bara skulle kunna lära oss vad stjärnmaterialet var om vi kunde få in det i laboratoriet.
Trots Comtes pessimism hade man redan hittat metoden för att upptäcka helium och stjärnornas sammansättning. År 1814 hade den tyske fysikern Joseph Fraunhofer tagit Isaac Newtons metod att dela solljuset med hjälp av ett prisma och gjort ett avgörande framsteg. Fraunhofer hade lagt märke till mörka linjer i regnbågen av färger som kommer från solljus som delas av ett prisma; linjerna han såg var den första observationen någonsin av en stjärnas spektrum. (2), (3)
1859/60 gjorde de tyska vetenskapsmännen Gustav Kirchhoff och Robert Bunsen enorma framsteg inom spektroskopin, bland annat genom att upptäcka att de mörka linjerna som Fraunhofer hade sett var som ett ämnets fingeravtryck.
Scenen var bäddad för att Kirchhoff och Bunsen skulle upptäcka nya grundämnen genom att studera ljuset från ämnen när de brann. 1860 upptäckte de cesium genom dess blå spektrallinjer och 1861 rubidium genom två röda spektrallinjer. Sedan upptäckte William Crookes thallium 1861 efter att ha observerat en ljusgrön spektrallinje.
Kirchhoff och Bunsen tittade på solens spektrum och kunde dra slutsatsen att järn fanns i dess glödande atmosfär. (4)
För heliums upptäckt behövdes ytterligare några år. I augusti 1868 skulle den första totala solförmörkelsen sedan Kirchhoff och Bunsens arbete hade publicerats inträffa.
Den franske astronomen Pierre Janssen väntade på en solförmörkelse för att med hjälp av ett spektroskop kunna iaktta prominenser i solens korona. Under de två veckorna efter solförmörkelsen utvecklade Janssen en metod för att registrera prominensernas spektrum utan att en solförmörkelse behövdes. I dessa spektrum observerade han en gul linje. (5)
Linjen befann sig i en liknande men inte identisk position som linjerna i natriums spektrum. Dessa kallades D1- och D2-linjerna. Den engelske forskaren Norman Lockyer studerade den nya gula linjen; senare skulle den kallas D3-linjen. han publicerade sin studie av linjen, medveten om att den kunde orsakas av ett nytt grundämne:
”…så då visste vi att vi inte hade att göra med väte; vi var alltså tvungna att ha att göra med ett grundämne som vi inte kunde få tag på i våra laboratorier, och därför tog jag på mig ansvaret för att prägla ordet helium, i första hand för laboratorieanvändning”. (6)
Namnet helium kom från det grekiska ordet för solen, helios.
Lockyer och Edward Frankland, hans medarbetare, hade ett antal andra idéer om de möjliga orsakerna till den gula linjen och tillkännagav därför inte ett nytt grundämne.
År 1871 var andra forskare medvetna om situationen. Lord Kelvin diskuterade ”reflektion av ljuset från det glödande väte och ’helium’ runt solen”. Användningen av ’helium’ följs av en fotnot för att förklara det:
”Frankland och Lockyer finner att de gula prominenterna ger en mycket bestämd ljus linje inte långt från D, men som hittills inte identifierats med någon jordisk flamma. Den tycks indikera ett nytt ämne, som de föreslår att kalla Helium.” (7)
Heliums existens accepterades dock inte av alla. (5)
Alla tvivel skingrades när den skotska kemisten William Ramsay isolerade helium 1895 i London. Ramsay hade tillsammans med andra upptäckt argon 1894; argon var den första av ädelgaserna som upptäcktes. År 1895 läste han en artikel av William Hillebrand som beskrev en oreaktiv gas som frigjordes när syra tillsattes till uranmineralet uranit. Hillebrand trodde att gasen var kväve.
Ramsay, som trodde att gasen kunde innehålla argon, upprepade Hillebrands experiment med ett annat uranmineral, cleveit, och samlade in gasen.
Hans spektroskop visade på förekomsten av kväve, argon och en annan gas. Ramsay misstänkte att det kunde vara helium eftersom det verkade finnas en D3-linje. (8) Eftersom han var medveten om att Lockyer och William Crookes hade ett bättre spektroskop än hans, skickade han dem ett prov av gasen. Tyvärr var provet inte lämpligt, så Lockyer skaffade ett prov av uranit, extraherade gasen och studerade den med spektroskop. Han skriver: (8)
”En efter en visade sig de okända linjerna som jag hade observerat i solen 1868 tillhöra gasen.”
Gasens spektrum var identiskt med solens ”helium”. Ett nytt grundämne vann sin plats i det periodiska systemet.
Besök Chemicools coola sida med fakta om helium.

Uppträdande och egenskaper
Skadliga effekter:
Helium är inte känt för att vara giftigt.
Egenskaper:
Helium är en lätt, luktfri, färglös, inert, monatomär gas. Den kan bilda diatomära molekyler, men endast svagt och vid temperaturer nära den absoluta nollpunkten.
Helium har den lägsta smältpunkten av alla grundämnen och dess kokpunkt är nära den absoluta nollpunkten.
Till skillnad från alla andra grundämnen stelnar inte helium utan förblir en vätska ner till den absoluta nollpunkten (0 K) under vanliga tryck.
Rösten hos någon som tillfälligtvis har inhalerat helium låter högljudd.
Användning av helium
Magnetresonanstomografi (MRI) är den största användaren av helium. Heliumet används för att kyla MR-scanners supraledande magneter.
Helium används för att fylla ballonger (blimps) och för att trycksätta raketer med flytande bränsle.
Blandningar av helium och syre används som konstgjord ”luft” för dykare och andra som arbetar under tryck. Helium används i stället för kväve i normal luft eftersom helium efter ett långt dyk lämnar kroppen snabbare än kväve, vilket möjliggör en snabbare dekompression.
Helium används som gasskydd i närheten av ljusbågssvetsning för att förhindra t.ex. att heta metallsvetsar reagerar med syre. Gasen används inom halvledarindustrin för att tillhandahålla en inert atmosfär för odling av kisel- och germaniumkristaller. Den används också som en högtemperaturgas vid tillverkning av titan och zirkonium och som bärgas vid gaskromatografi.
Förråd och isotoper
Förråd jordskorpan: 8 delar per miljard i vikt, 43 delar per miljard i mol
Förråd solsystemet: 23 % i vikt, 7,4 % i mol
Kostnad, ren: 5,2 dollar per 100 g
Kostnad, bulk: $ per 100 g
Källa: Nästan allt helium på jorden är resultatet av radioaktivt sönderfall. De största heliumkällorna kommer från naturgasfyndigheter i brunnar i Texas, Oklahoma och Kansas. Helium utvinns genom fraktionerad destillation av naturgasen, som innehåller upp till 7 % helium.
Isotoper: Helium har 8 isotoper vars halveringstider är kända, med masstal 3 till 10. Naturligt förekommande helium är en blandning av dess två stabila isotoper, 3He och 4He med naturliga halter på 0,0001% respektive 99,999%.

- Auguste Comte, Cours de Philosophie Positive at Project Gutenberg
- Keith J. Laidler, The World of Physical Chemistry, 1993, s179.
- The Era of Classical Spectroscopy, från MIT Spectroscopy.
- Gerard G. Emch, Mathematical and Conceptual Foundations of 20th-Century Physics, 1984, Elsevier Science Publishers, s211
- Helge Kragh, The Solar Element: A Reconsideration of Helium’s Early History. 2009, Annals of Science, 66:2, s157-182.
- J. Norman Lockyer, The Growth of our Knowledge of Helium. 1896, Science Progress, Vol 5., s249
- W. Thomson, Presidential Address, British Association for the Advancement of Science, 1871, (Address. XCIX).
- Sir Norman Lockyer, The Sun’s Place in Nature, 1897, p47-48
Citera denna sida
För att länka online, vänligen kopiera och klistra in något av följande:
<a href="https://www.chemicool.com/elements/helium.html">Helium</a>
eller
<a href="https://www.chemicool.com/elements/helium.html">Helium Element Facts</a>
För att citera denna sida i ett akademiskt dokument, vänligen använd följande MLA-kompatibla citat:
"Helium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/helium.html>.