Generiskt namn: natriumpolystyrensulfonat
Doseringsform: oral/rektal suspension
Medicinskt granskad av Drugs.com. Senast uppdaterad den 22 juli 2020.
- Översikt
- Biverkningar
- Dosering
- Professionell
- Interaktioner
- Mer
- Indikationer och användning för Kionex
- Kionex Dosering och administrering
- Allmänt om Kionex
- Rekommenderad dosering
- Förberedelse och administrering
- Doseringsformer och styrkor
- Kontraindikationer
- Varningar och försiktighetsåtgärder
- Tarmnekros
- Elektrolytstörningar
- Flödesöverbelastning hos patienter som är känsliga för högt natriumintag
- Risk för aspiration
- Bindning till andra oralt administrerade läkemedel
- Biverkningar
- Läkemedelsinteraktioner
- Allmänna interaktioner
- Kationsdonerande antacider
- Sorbitol
- Användning hos särskilda populationer
- Graviditet
- Avvänjning
- Pediatrisk användning
- Överdosering
- Kionex Beskrivning
- Kionex – Klinisk farmakologi
- Aktionsmekanism
- Farmakodynamik
- Farmakokinetik
- Nonklinisk toxikologi
- Karcinogenes, mutagenes, försämrad fertilitet
- Hur man får tag på/förvaring och hantering
- Patientrådgivning
- Förpackning/etikett PRINCIPAL DISPLAY PANEL
- Mer om Kionex (natriumpolystyrensulfonat)
- Konsumentresurser
- Professionella resurser
- Relaterade behandlingsguider
Indikationer och användning för Kionex
Kionexis indicerat för behandling av hyperkalemi.
Användningsbegränsning:
Kionex ska inte användas som akutbehandling av livshotande hyperkalemi på grund av dess fördröjda verkan .
Kionex Dosering och administrering
Allmänt om Kionex
Administrera Kionex minst 3 timmar före eller 3 timmar efter andra orala läkemedel. Patienter med gastropares kan kräva 6 timmars separation
Rekommenderad dosering
Terapins intensitet och varaktighet beror på hyperkalemiens svårighetsgrad och motståndskraft.
Oral
Den genomsnittliga totala dagliga vuxendosen av Kionex är 15 g till 60 g, administrerad som en 15-g-dos (fyra raka teskedar), en till fyra gånger dagligen.
Rektalt
Den genomsnittliga vuxendosen är 30 g till 50 g var sjätte timme.
Förberedelse och administrering
Förbered suspensionen färsk och använd inom 24 timmar.
Värm inte Kionex eftersom det kan förändra hartsens utbytesegenskaper.
En jämn tesked innehåller cirka 3,5 g Kionex och 15 mEq natrium.
Oral suspension
Suspendera varje dos i en liten mängd vatten eller sirap, cirka 3 till 4 ml vätska per gram harts. Administrera med patienten i upprätt läge.
Enema
Efter ett inledande rengörande lavemang, för in en mjuk gummislang i stor storlek (fransk 28) i rektum på en sträcka av cirka 20 cm, med spetsen väl inne i colon sigmoideum, och tejpa in den.
Administrera som en varm (kroppstemperatur) emulsion i 100 mL vattenhaltigt vehikel och spola med 50 till 100 ml vätska. En något tjockare suspension kan användas, men bildar inte en pasta.
Agitera emulsionen försiktigt under administreringen. Harts ska behållas så länge som möjligt och följas av ett renande lavemang med en icke-natriumhaltig lösning. Se till att en adekvat volym reningslösning (upp till 2 liter) används.
Doseringsformer och styrkor
Kionex är ett grädd- till ljusbrunt, finfördelat pulver och finns i 454 g burkar.
Kontraindikationer
Kionex är kontraindicerat hos patienter med följande tillstånd:
– Överkänslighet mot polystyrensulfonathartser – Obstruktiv tarmsjukdom – Nyfödda barn med nedsatt tarmmotilitet
Varningar och försiktighetsåtgärder
Tarmnekros
Fall av tarmnekros, varav vissa med dödlig utgång, och andra allvarliga gastrointestinala biverkningar (blödning, ischemisk kolit, perforation) har rapporterats i samband med användning av Kionex. Majoriteten av dessa fall rapporterade samtidig användning av sorbitol. Riskfaktorer för gastrointestinala biverkningar förekom i många av fallen, bland annat prematuritet, tidigare tarmsjukdom eller kirurgi, hypovolemi samt njurinsufficiens och njursvikt. Samtidig administrering av sorbitol rekommenderas inte.
– Använd endast hos patienter som har normal tarmfunktion. Undvik användning hos patienter som inte har haft en tarmrörelse efter en operation. – Undvik användning hos patienter som löper risk att utveckla förstoppning eller impaktion (inklusive patienter med anamnes på impaktion, kronisk förstoppning, inflammatorisk tarmsjukdom, ischemisk kolit, vaskulär intestinal ateroskleros, tidigare tarmresektion eller tarmobstruktion). Avbryt användningen hos patienter som utvecklar förstoppning.
Elektrolytstörningar
Kontrollera serumkalium under behandlingen eftersom allvarlig hypokalemi kan förekomma.
Kionex är inte helt selektivt för kalium, och små mängder av andra katjoner såsom magnesium och kalcium kan också förloras under behandlingen. Övervaka kalcium och magnesium hos patienter som får Kionex.
Flödesöverbelastning hos patienter som är känsliga för högt natriumintag
Varje 15 g-dos av Kionex innehåller 1500 mg (60 mEq) natrium. Övervaka patienter som är känsliga för natriumintag (hjärtsvikt, hypertoni, ödem) med avseende på tecken på vätskeöverbelastning. Justering av andra natriumkällor kan krävas.
Risk för aspiration
Fall av akut bronkit eller bronkopneumoni orsakade av inhalation av partiklar av natriumpolystyrensulfonat har rapporterats. Patienter med nedsatt kräkreflex, förändrad medvetandenivå eller patienter som är benägna att regurgitera kan löpa en ökad risk. Administrera Kionex med patienten i upprätt ställning.
Bindning till andra oralt administrerade läkemedel
Kionex kan binda oralt administrerade läkemedel, vilket kan minska deras gastrointestinala absorption och leda till minskad effekt. Administrera andra orala läkemedel minst 3 timmar före eller 3 timmar efter Kionex. Patienter med gastropares kan kräva en separation på 6 timmar. .
Biverkningar
Följande biverkningar diskuteras på andra ställen i märkningen:
– Intestinala nekroser – Elektrolytstörningar – Aspiration
Följande biverkningar har identifierats vid användning av Kionex efter godkännandet. Eftersom dessa reaktioner rapporteras frivilligt från en population av osäker storlek är det inte alltid möjligt att uppskatta deras frekvens på ett tillförlitligt sätt eller att fastställa ett orsakssamband med läkemedelsexponering.
Gastrointestinal: anorexi, förstoppning, diarré, fekal impaktion, gastrointestinala konkretioner (bezoarer), ischemisk kolit, illamående, ulcerationer, kräkningar, magirritation, tarmobstruktion (på grund av koncentrationen av aluminiumhydroxid)
Metabolisk: Systemisk alkalos
Läkemedelsinteraktioner
Allmänna interaktioner
Ingen formella studier av läkemedelsinteraktioner har utförts på människor.
Kionex har potential att binda andra läkemedel. I in vitro-bindningsstudier visades att Kionex signifikant binder de orala läkemedel (n=6) som testades. Minskad absorption av litium och tyroxin har också rapporterats vid samtidig administrering av Kionex. Bindning av Kionex till andra orala läkemedel kan orsaka minskad gastrointestinal absorption och förlust av effekt när det tas nära den tidpunkt då Kionex administreras. Administrera Kionex minst 3 timmar före eller 3 timmar efter andra orala läkemedel. Patienter med gastropares kan kräva en separation på 6 timmar. Övervaka kliniskt svar och/eller blodnivåer där så är möjligt.
Kationsdonerande antacider
Den samtidiga orala administreringen av Kionex med icke-absorberbara kationsdonerande antacider och laxermedel kan minska kaliumutbyteskapaciteten i hartset och öka risken för systemisk alkalos.
Sorbitol
Sorbitol kan bidra till risken för tarmnekros och samtidig användning rekommenderas inte.
Användning hos särskilda populationer
Graviditet
Risksammanfattning
Kionex absorberas inte systemiskt efter oral eller rektal administrering och användning hos modern förväntas inte resultera i fosterrisk.
Avvänjning
Risksammanfattning
Kionex absorberas inte systemiskt av mamman, så amning förväntas inte resultera i någon risk för spädbarnet.
Pediatrisk användning
Studier av säkerhet och effekt har inte utförts på pediatriska patienter.
I pediatriska patienter, liksom hos vuxna, förväntas Kionex binda kalium vid det praktiska utbytesförhållandet på 1mEq kalium per 1 gram kåda.
I neonatala patienter ska Kionex inte ges via oral väg. Hos både barn och nyfödda kan överdriven dosering eller otillräcklig spädning resultera i impaktion av hartset. Prematura barn eller barn med låg födelsevikt kan ha en ökad risk för gastrointestinala biverkningar med Kionex. användning .
Överdosering
Överdosering kan resultera i elektrolytstörningar inklusive hypokalemi, hypokalcemi och hypomagnesemi. Lämpliga åtgärder bör vidtas för att korrigera serumelektrolyter (kalium, kalcium, magnesium) och hartset bör avlägsnas från matsmältningskanalen genom lämplig användning av laxermedel eller lavemang.
Kionex Beskrivning
Kionex är en bensen, diethenylpolymer, med ethenylbenzen, sulfonat, natriumsalt och har följande strukturformel:
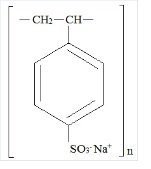
Läkemedlet är en grädd- till ljusbrun finfördelad, pulvriserad form av natriumpolystyrensulfonat, ett katjonbytesharts som framställs i natriumfasen och som har en in vitro utbyteskapacitet på cirka 3.1 mEq (in vivo cirka 1 mEq) kalium per gram. Natriuminnehållet är cirka 100 mg (4,1 mEq) per gram av läkemedlet. Det kan administreras oralt eller rektalt som lavemang.
Ett gram Kionex innehåller 4,1 mEq natrium.
Kionex – Klinisk farmakologi
Aktionsmekanism
Kionex är en icke-absorberad, katjonbytespolymer som innehåller en natriummotjon.
Kionex ökar den fekala kaliumutsöndringen genom bindning av kalium i lumen i mag-tarmkanalen. Bindning av kalium minskar koncentrationen av fritt kalium i mag-tarmlumen, vilket resulterar i en minskning av kaliumnivåerna i serum. Det praktiska utbytesförhållandet är 1 mEq K per 1 gram kåda.
När kådan passerar längs tarmen eller hålls kvar i tjocktarmen efter administrering genom lavemang frigörs natriumjonerna delvis och ersätts av kaliumjoner. Denna verkan sker främst i tjocktarmen, som utsöndrar kaliumjoner i större utsträckning än tunntarmen. Effektiviteten av denna process är begränsad och oförutsägbart varierande.
Farmakodynamik
Den effektiva sänkningen av serumkalium med Kionex kan ta timmar till dagar.
Farmakokinetik
Natrium-kaliumutbyteshartser har en in vivo-effektivitet på cirka 33 procent; följaktligen levereras cirka en tredjedel av hartseriets faktiska natriuminnehåll till kroppen.
Kionex absorberas inte systemiskt.
Läkemedelsinteraktioner
In vitro-bindningsstudier visade att Kionex binds signifikant till följande testade läkemedel – warfarin, metoprolol, fenytoin, furosemid, amlodipin och amoxicillin.
Nonklinisk toxikologi
Karcinogenes, mutagenes, försämrad fertilitet
Studier har inte utförts.
Hur man får tag på/förvaring och hantering
Kionex finns som ett grädd- till ljusbrunt, finmalet pulver i burkar om 1 pund (454 g), NDC 0574-2004-16.
Lagra vid 20° till 25°C (68° till 77°F) .
Patientrådgivning
Läkemedelsinteraktioner
Råd ge patienter som tar andra orala läkemedel att separera doseringen av Kionex med minst 3 timmar (före eller efter)
Rx Only
Förpackat av
Perrigo
Minneapolis, MN 55427
Revised 08/2017
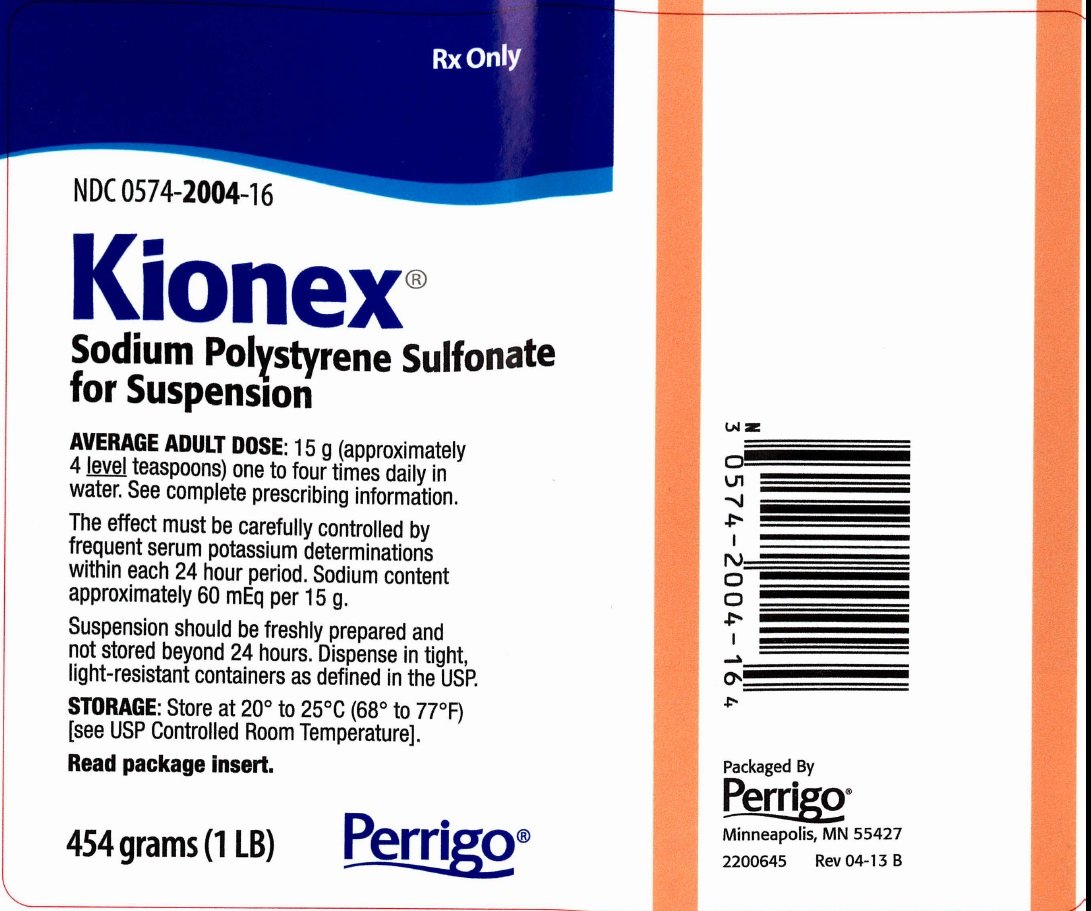
Förpackning/etikett PRINCIPAL DISPLAY PANEL
Endast på recept
NDC 0574-2004-16
Kionex®
Natriumpolystyrensulfonat för suspension
MÅLDOS FÖR VUXNA: 15 g (cirka 4 teskedar) en till fyra gånger dagligen i vatten. Se fullständig förskrivningsinformation.
Effekten måste kontrolleras noggrant genom frekventa serumkaliumbestämningar inom varje 24-timmarsperiod. Natriumhalt cirka 60 mEq per 15 g.
Suspensionen ska vara nyberedd och inte förvaras längre än 24 timmar. Dispenseras i täta, ljusbeständiga behållare enligt definitionen i USP.
LAGRING: Förvaras vid 20° till 25°C (68° till 77°F) .
Läs bipacksedeln.
454 gram (1 LB)
| Kionex natriumpolystyrensulfonatpulver, för suspension |
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
|
|||||||||||||||||||
Etikett – Paddock Laboratories, LLC (967694121)
Mer om Kionex (natriumpolystyrensulfonat)
- Biverkningar
- Under graviditet eller amning
- Doseringsinformation
- Läkemedelsinteraktioner
- En Español
- 4 Recensioner
- Läkemedelsklass:
- FDA-varningar (2)
Konsumentresurser
- Patientinformation
- Kionex (avancerad läsning)
Professionella resurser
- Förskrivningsinformation
- Natriumpolystyrensulfonat oralt pulver (FDA)
Andra varumärken Kayexalat, Kalexate
Relaterade behandlingsguider
- Hyperkalemi
Medicinsk ansvarsfriskrivning