Termerna luminescens, fotoluminescens, fluorescens och fosforescens används rutinmässigt i forskningsrapporter för att beskriva ljusutsläpp från ett prov. Detta kan vara förvirrande eftersom flera av termerna används synonymt och forskare med olika vetenskaplig bakgrund föredrar att använda ett namn framför ett annat. I den här artikeln besvarar vi frågan ”Vad är skillnaden mellan luminescens, fotoluminescens, fluorescens och fosforescens?”.
Vad är luminescens?
Luminescens är varje emission av ljus (elektromagnetiska vågor) från ett ämne som inte uppstår vid upphettning. Genom denna definition skiljer sig luminescens från glödning som är ljusemission på grund av en förhöjd temperatur hos ett ämne, t.ex. en glödande het glöd. Ordet luminescens kommer från det latinska ordet för ljus, lumen, och det latinska ordet escentia som betyder ”processen att” och är alltså processen att avge ljus.

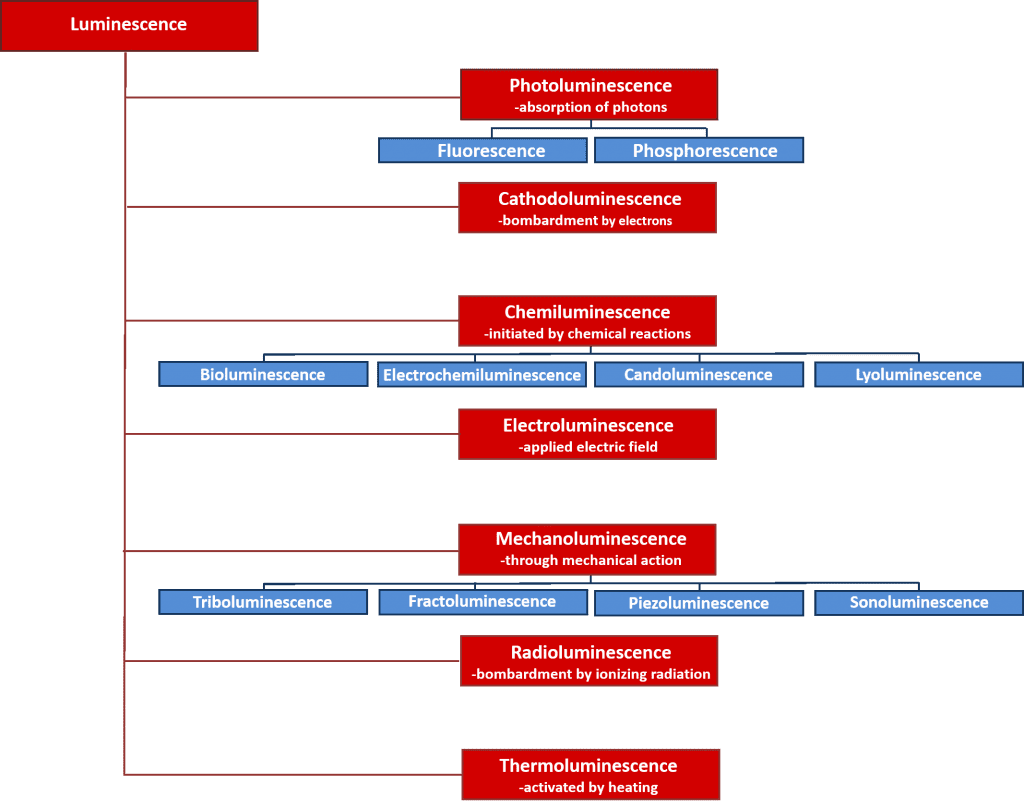
Det finns många typer av luminescens som kan klassificeras efter den energikälla som initierar luminescensprocessen. En översikt över de olika typerna av luminescens och deras energikällor ges i figur 2. Många av dessa luminescensprocesser har viktiga vetenskapliga och industriella tillämpningar, t.ex. elektroluminescens där ljus avges vid rekombination av elektroner och hål efter det att ett elektriskt fält har applicerats på ett material, och är den operativa principen bakom lysdioder, och kemiluminescens där ljuset avges genom en kemisk reaktion och används i biologiska tester och är orsaken till att glödlampor lyser. Fokus i denna artikel ligger dock på fotoluminescens som utgör grunden för den kraftfulla icke-förstörande spektroskopiska tekniken, fotoluminescensspektroskopi, som används flitigt inom både den akademiska världen och industrin.
Vad är fotoluminescens?
Fotoluminescens är avgivning av ljus från ett material efter absorption av ljus. Ordet i sig är intressant eftersom det är en kombination av det latinska ordet luminescens och det grekiska prefixet photo- för ljus. All luminescens som framkallas av absorption av fotoner kallas fotoluminescens. Det kan lika gärna vara ljusemission från en organisk färgämnesmolekyl i lösning (figur 3a), eller rekombination från band till band av elektroner och hål efter fotoexcitering av en halvledare (figur 3b).

Det är korrekt att beskriva all ljusemission som induceras av fotonabsorption som fotoluminescens, men det är vanligt, särskilt bland kemister, att ytterligare dela in fotoluminescens i fluorescens och fosforescens.
Vad är skillnaden mellan fluorescens och fosforescens?
Det finns olika definitioner av fluorescens och fosforescens där den enklaste är att fluorescens är omedelbar fotoluminescens som uppstår mycket kort efter fotoexcitering av ett ämne, medan fosforescens är långlivad fotoluminescens som fortsätter långt efter att fotoexciteringen har upphört. Även om detta är en enkel definition förklarar den inte varför en sådan skillnad i tidsskalor för fotoluminescens uppstår och vissa material kan hamna i en gråzon mellan de klassiska tidsskalorna för fluorescens och fosforescens. En grundligare definition måste baseras på kvantmekaniken för de exciterade och grundtillstånd som är involverade i emissionsprocessen. Med detta tillvägagångssätt kan fluorescens och fosforescens definieras som fotoluminescens där den strålande övergången inte kräver någon förändring av spinnmultipliciteten respektive fotoluminescens där den strålande övergången innebär en förändring av spinnmultipliciteten.
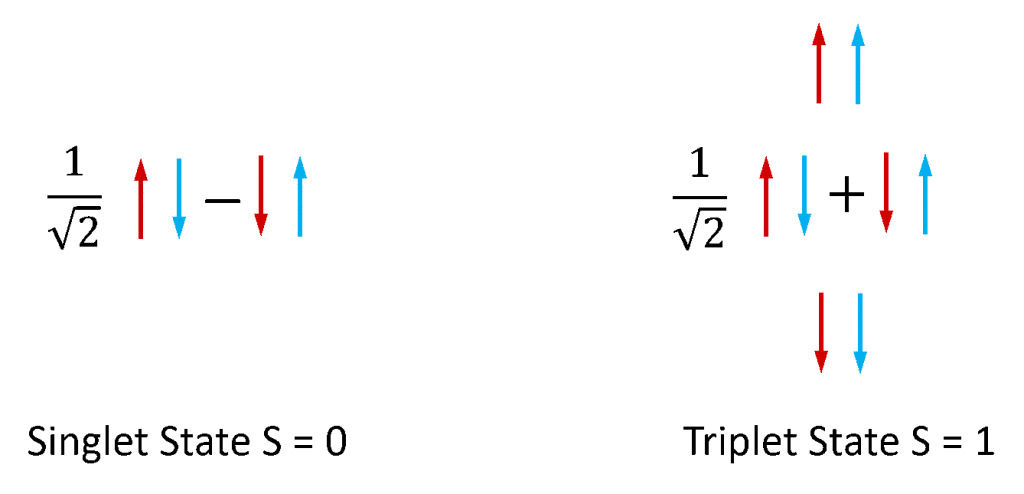
Fluorescens och fosforescens används oftast för att hänvisa till fotoluminescens från molekylära system. Elektroner i stabila molekyler finns alltid i par, eftersom molekyler med oparade elektroner är extremt reaktiva och instabila. Elektroner har ett inneboende vinkelmoment som kallas ”spinn” och ett elektronpar kan existera i ett av två totala spinntillstånd beroende på den relativa symmetrin hos de två elektronernas spinn. Om de två spinnarna befinner sig i en antisymmetrisk konfiguration har elektronparet ett totalt spinn på noll (S = 0), medan om de befinner sig i en symmetrisk konfiguration har paret ett totalt spinn på ett (S = 1). Som illustreras i figur 4 finns det en kombination av elektronspinnpartillstånden som är antisymmetriska och tre kombinationer av spinnpartillstånden som är symmetriska och S = 0- och S = 1-tillstånden kallas därför singlet- respektive tripletttillstånd.
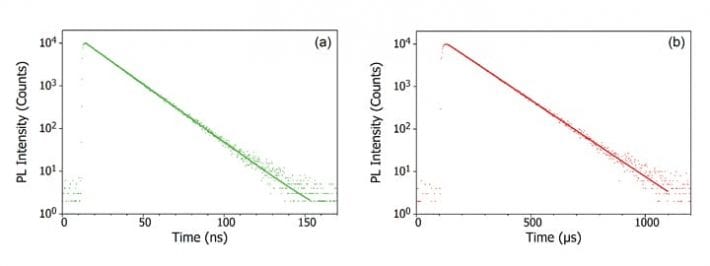
När en foton absorberas av molekylen, främjas en av elektronerna till en högre energinivå och molekylen befinner sig nu i ett exciterat tillstånd. En molekyls grundtillstånd är (nästan) alltid ett singuletttillstånd (S0) och på grund av bevarandet av vinkelmomentet måste det fotoexciterade tillståndet också vara ett singuletttillstånd (S1), vilket visas i Jablonski-diagrammet nedan. Sönderfallet av S1-tillståndet tillbaka till S0-tillståndet är en tillåten övergång (eftersom båda tillstånden har samma spinnmultiplicitet), vilket resulterar i omedelbar fotoluminescens som inträffar på tidsskalan picosekunder till nanosekunder och kallas fluorescens.
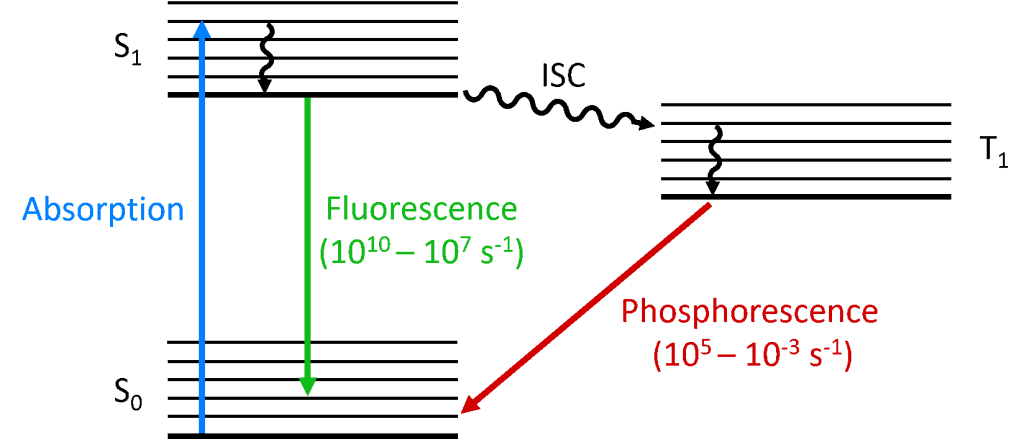
Alternativt kan molekylen genomgå intersystemövergång (ISC) till det exciterade tripletttillståndet (T1). ISC inträffar typiskt i molekyler med en hög grad av spin-orbitkoppling, kopplingen mellan orbitens vinkelmoment och elektronens spinnvinkelmoment, vilket möjliggör omvandling mellan singulett- och tripletttillstånd. Spin-orbitkopplingens styrka ökar med atomens massa, och fosforescerande molekyler måste därför innehålla tungmetaller som europium och iridium. Nedbrytningen av T1-tillståndet tillbaka till S0-tillståndet är en förbjuden övergång eftersom tillstånden har olika spinnmultiplicitet, på grund av bevarandet av vinkelmomentet. Spin-orbit-koppling luckrar dock upp denna begränsning och en strålningsövergång från T1 till S1 blir möjlig. Eftersom den är ”förbjuden” inträffar fotoluminescensen som är resultatet av T1- till S0-övergången på en mycket långsammare tidsskala, mikrosekunder till tusentals sekunder, och kallas fosforescens.
Det bör också noteras att emissionen från vissa material inte alltid faller in i den ena eller andra kategorin. Ett exempel på detta är termiskt aktiverad fördröjd fluorescens (TADF). Vid TADF ligger S1- och T1-nivåerna nära varandra i energi och är starkt kopplade, och omvänd ISC från T1 till S1 är därför möjlig. Detta ger upphov till en fördröjd S1- till S0-övergång som resulterar i fotoluminescens på en tidsskala mellan fluorescens och fosforescens, så kallad fördröjd fluorescens. För mer information om TADF och dess användning i högeffektiva OLED:er, läs inlägget ”Vad är TADF?”.
När man ska beskriva emissionen som fotoluminescens kontra fluorescens/fosforescens beror i slutändan på personliga preferenser. Kemister och biologer, som i första hand studerar molekylära system, föredrar att använda fluorescens och fosforescens eftersom det i dessa starkt lokaliserade molekylära system finns distinkta singlet- och tripletttillstånd. Fysiker däremot studerar främst halvledande material där elektronerna är mycket delokaliserade och där begreppet singel- och trippeltillstånd ofta inte längre är relevant. Detta är en av anledningarna till att fysiker tenderar att använda den bredare termen fotoluminescens för att beskriva ljusemission.
Oavsett vad man väljer att kalla det kan fotoluminescens, fluorescens och fosforescens ge en mängd information om molekylers och materials egenskaper, alltifrån bestämning av laddningsbärarnas livslängd i solceller till mätning av solvationsdynamiken kring miceller i levande celler.
Produkter för luminescens, fotoluminescens, fluorescens och fosforescens
För att mäta fotoluminescens krävs en fotoluminescensspektrometer och Edinburgh Instruments erbjuder en rad fotoluminescensspektrometrar med enkel fotonräkning för att mäta fotoluminescensspektrum, livslängder, anisotropi och kvantutbyten för dina prover.
Håll kontakten
Om du tyckte om att läsa den här artikeln och vill vara först med att se de senaste nyheterna, tillämpningarna och produktinformationen från Edinburgh Instruments, anmäl dig då till vårt nyhetsbrev via den röda anmälningsknappen nedan, och följ oss på sociala medier.