Vissa atomer är mer polära än andra på grund av att de är mer ”giriga” efter elektroner.
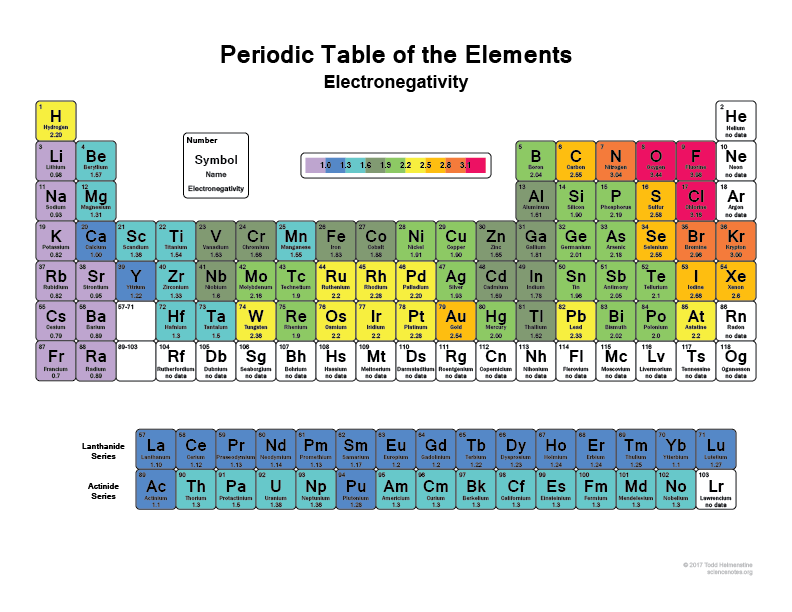
Ta en titt på ditt periodiska system, ju mer till höger och uppåt du går, desto mer elektronegativa blir atomerna (ädelgaserna räknas inte in, eftersom de har fulla skal och är ”lyckliga” och inte behöver några valenselektroner).
Jag tror att alla har hört att flourin (F), till exempel, är ett av de mest elektronegativa grundämnena, det kommer bokstavligen att slita elektroner från väteatomer eller kolatomer. Det gör även klor (Cl)
Kontrollera den här bilden:
Det är därför som vissa molekyler vid en bindning har superpolära områden eftersom de har något som väte som binder sig till något som flourin som i princip bara har elektronerna med sig för det mesta.
Denna fråga kan också förklaras med idén om elektronmoln och det faktum att mer elektronegativa atomer vanligtvis kommer att ha fler elektroner som stannar med dem för det mesta jämfört med mindre elektronegativa atomer.

Detta kallas dipolmomentet och utan att gå för mycket in på det ser du hur de flesta elektronerna är närmare syre än väte (eftersom syre är mer elektronegativt än väte)
Förresten låter ordet elektronegativt ibland motsägelsefullt, men det är elektronnegativt i stället för positivt, eftersom atomer som får elektroner i kemin har ett negativt tecken (exempel: #Cl^-# är ett klor som fått en elektron).