A T-alakú molekulageometria a kémiában néhány olyan molekula szerkezetét írja le, ahol egy központi atomhoz három ligandum tartozik. Általában a háromkoordinált vegyületek trigonális sík- vagy piramisgeometriát vesznek fel. A T-alakú molekulák példái a halogéntrifluoridok, mint például a ClF3.
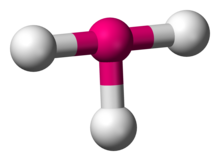
ClF3
C2v
90°, 180°
>0

A VSEPR elmélet szerint a T-alakú geometria akkor jön létre, ha a központi atomhoz három ligandum és két magányos elektronpár kapcsolódik, AXE jelöléssel AX3E2-nek írva. A T-alakú geometria a három egyenlítői és két axiális ligandummal rendelkező AX5 molekulák trigonális bipiramis molekulageometriájához kapcsolódik. Az AX3E2 molekulában a két magányos pár két egyenlítői pozíciót foglal el, a három ligandumatom pedig a két axiális pozíciót, valamint egy egyenlítői pozíciót. A három atom a központi atom egyik oldalán 90°-os szögben kötődik, ami a T alakot eredményezi.
A trifluoroxenát(II)-aniont, a XeF-
3-t vizsgálták, mint egy AX3E3 molekula lehetséges első példáját, amelyről a VSEPR érvelés alapján várható, hogy hat elektronpárral rendelkezik oktaéderes elrendezésben, ahol mind a három magányos pár, mind a három ligandum mer vagy T alakú orientációban van. Bár ezt az aniont gázfázisban kimutatták, az oldatban történő szintézisre és a kísérleti szerkezetmeghatározásra tett kísérletek sikertelenek voltak. Egy számításos kémiai vizsgálat torzított, síkbeli Y-alakú geometriát mutatott ki, ahol a legkisebb F-Xe-F kötésszög 69°, nem pedig 90°, mint a T-alakú geometriában.