Barviva se používají v mnoha průmyslových odvětvích – k barvení oděvů, barev, plastů, fotografií, tisků a keramiky. Barviva se nyní používají také v nových aplikacích a označují se jako funkční (high-tech), protože nejsou součástí výrobku pouze z estetických důvodů, ale pro specifické účely, například v chirurgii.
Barviva mohou být buď barviva, nebo pigmenty. Barviva jsou rozpustné barevné organické sloučeniny, které se obvykle aplikují na textilie z roztoku ve vodě. Jsou navrženy tak, aby se silně vázaly na molekuly polymerů, které tvoří textilní vlákno.
Pigmenty jsou nerozpustné sloučeniny používané v barvách, tiskařských barvách, keramice a plastech. Aplikují se pomocí disperze ve vhodném médiu. Většina používaných pigmentů jsou rovněž organické sloučeniny.
- Manipulace s barvou a použití barviv
- Barvení textilií
- Klasifikace barviv
- Klasifikace barviv podle jejich chemické struktury
- (a) Azobarviva
- b) Antrachinonová barviva
- c) ftalocyaniny
- Klasifikace barviv podle způsobu použití
- Barviva skupiny 1
- (i) Kyselá barviva
- (ii) Barviva s kovovými komplexy
- (iii) Přímá barviva
- (iv) Základní barviva
- (v) Disperzní barviva
- Barviva skupiny 2
- i) Reaktivní barviva
- (ii) Kádinková barviva
- (iii) Sírová barviva
- Pigmenty
- Funkční (high-tech) barviva a pigmenty
- (a) Displeje z tekutých krystalů
- (b) Laserová barviva
- (c) Inkoustový tisk
- (d) Fotodynamická terapie
Manipulace s barvou a použití barviv
Tento oddíl se zabývá některými chemickými aspekty barvy barviv a tím, jak cílový materiál, například vlákno, ovlivňuje způsob barvení a použité barvivo.
Barvivo v roztoku je barevné díky selektivní absorpci určitých vlnových délek světla specifickými vazbami v molekule. Světlo, které je propouštěno, pozorovatel vidí a zdá se mu barevné, protože některé vlnové délky viditelného spektra nyní chybí.

Obrázek 1 Mauvein byl vůbec prvním syntetickým barvivem. Vyrobil ji náhodou William Perkin v roce 1856, který se pokoušel syntetizovat chinin. Obzvláště populární se stala, když si královna Viktorie na Královské výstavě v Londýně v roce 1862 oblékla hedvábné šaty obarvené mauveinem.
S laskavým svolením Společnosti barvířů a koloristů.
Absorpce energie viditelného světla sloučeninou podporuje elektrony v molekule z nízkoenergetického stavu, základního stavu, do stavu s vyšší energií, excitovaného stavu. Říká se, že molekula během tohoto procesu excitace prošla elektronickým přechodem. Konkrétní excitační energie odpovídají konkrétním vlnovým délkám viditelného světla.
Je to n elektron (elektron ve dvojné nebo trojné vazbě), který je povýšen do excitovaného stavu. Ještě méně energie je k tomuto přechodu zapotřebí, pokud se v téže molekule střídají jednoduché a dvojné vazby (tj. konjugované dvojné vazby). Excitaci elektronu ještě více usnadňuje přítomnost aromatických kruhů kvůli zvýšené delokalizaci elektronů n.
Změnou struktury sloučeniny mohou chemici zabývající se barvením změnit vlnovou délku absorbovaného viditelného světla, a tím i barvu sloučeniny.
Molekuly většiny barevných organických sloučenin obsahují dvě části:
(i) jednoduchý arylový (aromatický) kruh, jako je benzen nebo benzenový kruh se substituentem. Případně se může jednat o sloučený kruhový systém, jako je naftalen (dva kruhy sloučené dohromady) nebo antracen (tři kruhy sloučené dohromady).
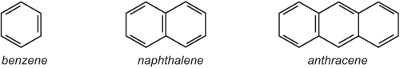
Kde se kruhy spojují, sdílejí dva atomy uhlíku, a proto má naftalen se dvěma kruhy 10, nikoliv 12 atomů uhlíku. Podobně antracen má 14 atomů uhlíku, nikoliv 18. Vzhledem k tomu, že naftalen a antracen obsahují delokalizované elektrony na všech kruzích, není vhodné používat symbol delokalizovaných elektronů, který se používá pro benzen v ostatních jednotkách, protože by to znamenalo dva nebo tři samostatné delokalizované systémy. Proto se v této jednotce používají kekuleovské struktury.
(ii) rozsáhlý systém konjugovaných dvojných vazeb obsahující nenasycené skupiny, známé jako chromofory, například:
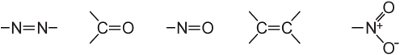
Intenzitu barvy lze v molekule barviva zvýšit přidáním substituentů obsahujících osamělé páry elektronů k arylovému kruhu, například:
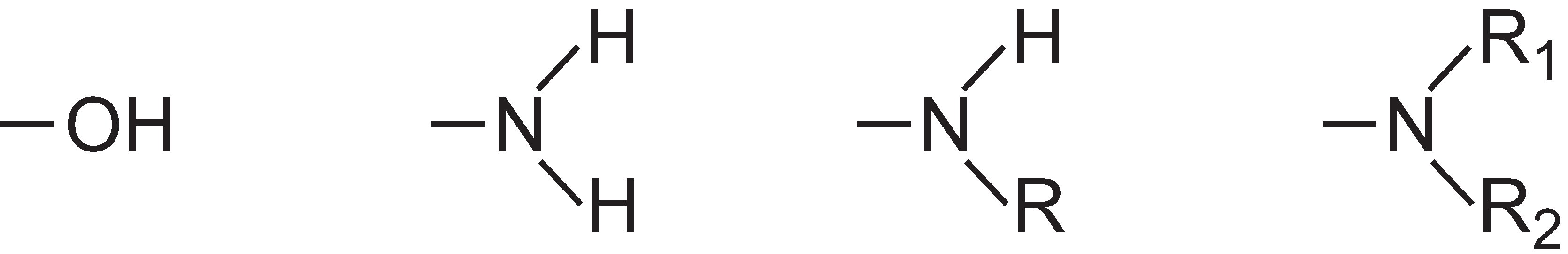
Tyto skupiny jsou známé jako auxochromy.
Někdy se celá struktura barviva nazývá chromogen.
Aby mělo barvivo průmyslový význam, musí chemici zabývající se barvivy také umět změnit rozpustnost sloučeniny a mohou být přidány skupiny, které učiní barvivo rozpustným ve vodě. Příkladem je skupina kyseliny sulfonové, -SO3H, nebo skupina kyseliny karboxylové, -COOH, nebo obvykle sodná sůl těchto kyselin, -SO3-Na+, respektive -COO-Na+.
Dalším klíčovým zájmem chemiků vyvíjejících barviva je zvýšit jejich reaktivitu s předmětem, který chtějí obarvit, například s molekulami vlákna. O tom je pojednáno níže a v celé jednotce jsou uvedeny příklady.
Barvení textilií
Chemická povaha barviva je dána chemickými a fyzikálními vlastnostmi vláken textilie, která má být obarvena. Čtyři hlavní typy vláken (tabulka 1) jsou bílkovinná, celulózová, regenerovaná (na bázi celulózy nebo jejích derivátů) a syntetická.
| Přírodní vlákna | Vlákna vyrobená člověkem | ||
|---|---|---|---|
| Bílkovinná | Celulózová | Regenerovaná | Syntetická |
| Vlna | Bavlna | Viskózové vlákno | Polyamidy |
| Hedvábí | Len | Celulóza etanoáty | Polyestery |
| Moshair | Ramie | Acrylics | |
| Cashmere | |||
| Termín regenerovaný se používá, pokud byl přírodní polymer chemicky upraven za vzniku jiného polymeru. Například přírodní celulóza z rostlin po úpravě anhydridem ethanolu (acetanhydridem) vytváří polymer, etanoát celulózy, což je hedvábí. |
|||
Tabulka 1 Klasifikace textilních vláken.
Během procesu barvení textilie je barvivo rozděleno mezi dvě fáze, pevnou fázi vlákna a vodnou fázi, a na konci procesu barvení je roztok vyčerpán a většina barviva je spojena s vláknem. Jakmile molekuly barviva proniknou do vlákna, dochází k okamžité interakci mezi oběma složkami, která zabraňuje desorpci molekul barviva zpět do roztoku. Typ interakce, ať už fyzikální nebo chemický, závisí na skupinách na molekulách barviva a v řetězcích vlákna (tabulka 2).
| Typ vazby | Přibližná relativní síla |
|---|---|
| kovalentní | 30,0 |
| iontové | 7. Vazba mezi barvivem a iontem se liší v závislosti na typu vazby.0 |
| vodíkové | 3,0 |
| jiné mezimolekulární | 1,0 |
Tabulka 2 Přibližné relativní síly vazeb mezi barvivem a látkou.

Obrázek 2 Před použitím barviva je třeba stanovit jeho světlostálost. Na těchto
stanovištích, která se nacházejí na severovýchodním pobřeží Austrálie, se provádí mnoho zkoušek
odolnosti proti povětrnostním vlivům, mezi něž patří i stálobarevnost. Polohu stojanů lze
měnit, ale na fotografii jsou pod úhlem 45° k vodorovné rovině.
S laskavým svolením Allunga Exposure Laboratory.
Barevná stálost barevné textilie je definována jako její odolnost vůči změnám při vystavení určitému souboru podmínek. Barvivo by nemělo být výrazně ovlivněno slunečním zářením (stálost na světle), teplem při žehlení (stálost na teple), potem (stálost na potu) a při praní (stálost na praní).
Klasifikace barviv
The Colour Index International, vydávaný Society of Dyers and Colourists v Bradfordu, je komplexní seznam známých komerčních barviv a pigmentů a je pravidelně aktualizován. Každému barvivu je přiřazen název a číslo Colour Index (C.I.). Například:
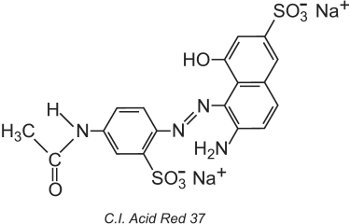
Všechna barviva v seznamu byla klasifikována podle své chemické struktury a způsobu použití.
Klasifikace barviv podle jejich chemické struktury
Barevný index zařazuje barviva známé struktury do jedné z 25 strukturních tříd podle chemického typu. Mezi nejdůležitější patří:
a) azobarviva
b) antrachinonová barviva
c) ftalocyaniny
(a) Azobarviva
Azobarviva představují největší chemickou třídu, která obsahuje nejméně 66 % všech barviv. Charakteristickým znakem je přítomnost jedné nebo více azoskupin ve strukturách,

spolu s hydroxylovými skupinami, aminovými a substituovanými aminovými skupinami jako auxochromy.
Aromatické azosloučeniny se vyrábějí z aromatických aminů prostřednictvím příslušné diazoniové soli.
Diazoniová sůl vzniká při působení aromatického aminu s kyselinou dusičnou (dusičnou(III)). Kyselina dusičná vzniká in situ přidáním zředěné kyseliny chlorovodíkové do chladného roztoku dusitanu sodného při teplotě cca 278 K. V následujícím příkladu byl z fenylaminu (anilinu), nejjednoduššího aromatického aminu, vytvořen roztok benzendiazoniumchloridu:

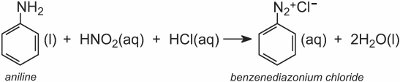
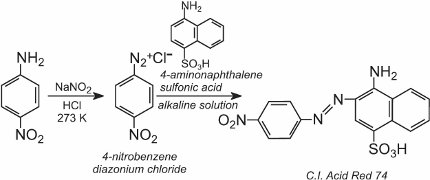
K chladnému roztoku se pak přidá roztok jiné sloučeniny, například jiného aromatického aminu nebo fenolu, a vznikne azosloučenina, která je barevná. Jedním z příkladů je vznik červeného barviva, když se k roztoku 4-nitrobenzendiazoniumchloridu přidá vodný roztok kyseliny 4-aminonaftalensulfonové (kyselina naftionová) za vzniku C.I. Kyselá červeň 74:
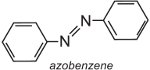
Azobenzen je chromoforem těchto azobarviv,
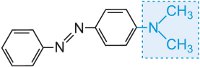
a barvu molekuly lze měnit a intenzitu barvy zvyšovat změnou auxochromů (tabulka 3).
| Struktura | Pozorovaná barva |
|---|---|
 |
žlutá-.zelená |
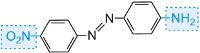 |
žlutá |
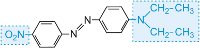 |
červená |
 |
modrá |
 |
Tabulka 3 Molekulární struktury některých azobarviv s vyznačením auxochromů.
Některá azobarviva, ta, která obsahují hydroxyskupinu ortho (nebo para) k azoskupině, například C.I. Acid Orange 7, vykazují tautomerii, proces, při kterém molekula existuje jako dvě nebo více různých struktur v rovnováze. Atom vodíku na hydroxylové skupině je schopen migrovat k atomu dusíku azoskupiny a naopak:
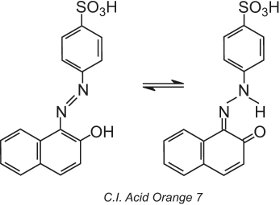
Tento typ tautomerie zahrnuje rovnováhu mezi hydroxyazo tautomerem a ketohydrazonovým tautomerem, ačkoli ketohydrazonový tautomer obecně převládá a pozorovaná barva má delší vlnovou délku (bathochromní posun).
b) Antrachinonová barviva
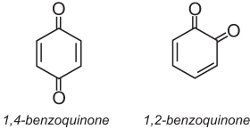
Antrachinonová barviva tvoří asi 15 % barviv a mají strukturu založenou na chinonech. Nejjednodušším chinonem je benzochinon, který má dva izomery:
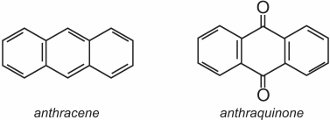
Antrachinon, nejjednodušší z antrachinonů, je založen na antracenu:
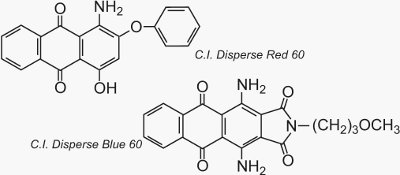
Dva známé příklady antrachinonů, které se používají jako barviva, jsou C.I. Disperse Red 60 a C.I. Disperse Blue 60:
c) ftalocyaniny
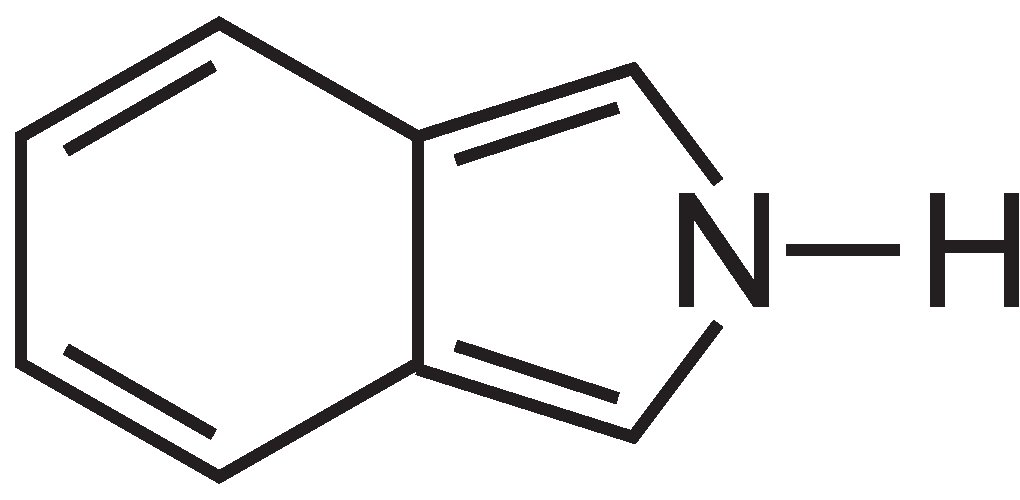
Ftalocyaniny se v podstatě skládají ze čtyř molekul isoindolu:
Tyto molekuly jsou ve ftalocyaninu vzájemně spojeny atomy dusíku. Struktura ftalocyaninu je:
Tyto molekuly jsou ve ftalocyaninu vzájemně spojeny atomy dusíku. Struktura ftalocyaninu je:
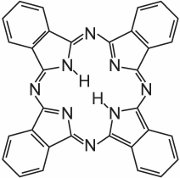
Ftalocyaniny se koordinují s atomy kovů. Nejdůležitější, podílející se asi 2 % na všech barvivech, jsou měďnaté ftalocyaniny, používané pro své zářivě modré a zelené barvy. Příkladem je C.I. Direct Blue 86:
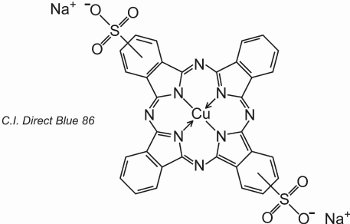
Skupiny kyseliny sulfonové napomáhají rozpustnosti barviva ve vodě.
Ze vzorce vyplývá, že skupiny kyseliny sulfonové mohou být v různých polohách na aromatických kruzích.
Klasifikace barviv podle způsobu použití
Klasifikace podle způsobu použití je důležitá pro textilní barvíře, kteří používají barvivo k získání požadované barvy. Pro získání požadovaného odstínu musí barvíř obvykle vytvořit směsi barviv a musí zajistit jejich kompatibilitu.
Základní vlastnosti, které řídí přenos barviva z roztoku na vlákno, jsou:
- pH roztoku v barvicí lázni (pro kyselá a zásaditá barviva)
- elektrolyt (roztok síranu sodného nebo chloridu)
- teplota (v rozmezí od okolí do 400 K)
- chemikálie, známé jako dispergátory, které vytvářejí stabilní vodnou disperzi barviv s velmi nízkou rozpustností
Tabulka 4 uvádí barviva pod jejich technologickými názvy, které označují způsob jejich použití, spolu s vlákny, na která se aplikují.
| Barvivo | Vlákno |
|---|---|
| Skupina 1 | |
| Kyselina | Vlna a jiná proteinová vlákna, polyamidy |
| Kovový komplex | Vlna a jiná proteinová vlákna, polyamidy |
| Přímé | Bavlna, len, viskóza |
| Základní | Akryl |
| Disperzní | Polyestery, polyamidy, etanoáty |
| skupina 2 | |
| reaktivní | bavlna, len, viskóza, vlna, hedvábí |
| Vat | bavlna, len, viskóza |
| Síra | Bavlna, len |
Tabulka 4 Technologická klasifikace barviv.
Barviva skupiny 1
Barviva této skupiny se vyznačují rozpustností ve vodě. V důsledku toho nejsou při praní nijak zvlášť rychlá. Způsob aplikace zahrnuje pouze jednostupňový proces.
(i) Kyselá barviva
Důležitými chemickými typy jsou azobarviva, antrachinony a ftalocyaniny, které pokrývají celé viditelné spektrum, a poskytují tak úplnou barevnou škálu. Tato barviva jsou rozpustná ve vodě za vzniku aniontových forem. Obvykle se aplikují při teplotě přibližně 373 K. Zatímco vlna a jiná proteinová vlákna nad touto teplotou snadno degradují, polyamidová vlákna (například nylon) lze ošetřovat při teplotě 393 K, aniž by došlo k jejich poškození (tabulka 4).
Zvolené pH roztoku v barvicí lázni závisí na individuálních vlastnostech barviv. Nižších hodnot se dosáhne přidáním kyseliny sírové a vyšších hodnot přidáním roztoků kyseliny ethanoové a síranu amonného nebo ethanoátu amonného. Síran sodný může být přidán za účelem kontroly difuze aniontů barviva ve struktuře vlákna.
Ze samotné podstaty struktury barviva se mezi barvivem a vláknem vytvoří iontové vazby, vodíkové vazby a další mezimolekulární interakce (tabulka 2), čímž se barviva stávají rychlými. Příkladem typického kyselého barviva je C.I. kyselá červeň 73:
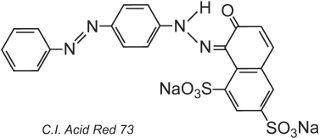
Jedna z azoskupin v tomto tautomeru je přítomna jako ketohydrazonová forma.
(ii) Barviva s kovovými komplexy
Chemické typy jsou azobarviva a antrachinony poskytující úplnou barevnou škálu. Jsou však matnější než kyselá barviva, protože ve struktuře barviva je přítomen atom kovu. Často se používají soli chromu, ačkoli se upřednostňují také soli kobaltu a niklu.
Atom kovu tvoří koordinační komplex se dvěma molekulami monoazosloučeniny obsahující hydroxylové, karboxylové nebo aminoskupiny v polohách 2,2′ vzhledem k azoskupině. Tyto sloučeniny se nazývají barviva „1:2 komplex kovu“. Příkladem je C.I. Acid Violet 78:
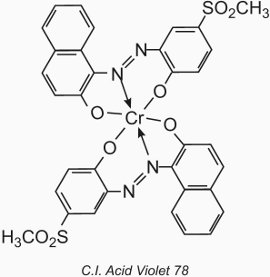
Jejich použití na vlnu je podobné jako u kyselých barviv, ale hodnota pH je omezena na rozsah 4,5 až 6,0 (tabulka 4).
(iii) Přímá barviva
Přímá barviva jsou zvláště užitečná pro barvení vláken vyrobených z celulózy (tabulky 1 a 4).
Syntetizují se se skupinami kyseliny sulfonové, které jim dodávají rozpustnost ve vodě, disociují za vzniku sodných kationtů a aniontové formy barviva. Jsou také navrženy tak, aby měly co nejlineárnější a nejplanárnější strukturu. To umožňuje navázání barviva na celulózové řetězce ve vlákně, často prostřednictvím mezimolekulární vazby (včetně vodíkové).
Používají se v barvicí lázni ve vodném roztoku, který obsahuje chlorid sodný. Sůl snižuje elektrické odpudivé síly mezi záporným nábojem na povrchu vlákna a aniontovým druhem barviva.
Většina přímých barviv jsou azosloučeniny, často obsahující dvě nebo tři azoskupiny. Příkladem je C.I. Direct Orange 25, který má skupiny -OH, -NHCO- a -N=N, které mají potenciál vytvářet vodíkové vazby s hydroxylovými skupinami v celulose:
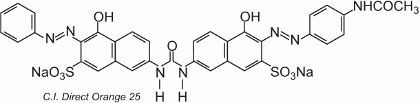
Barvivo vykazuje tautomerii, protože k azoskupinám jsou dvě hydroxylové skupiny orto. Jeden z tautomerů v rovnováze s touto formou je
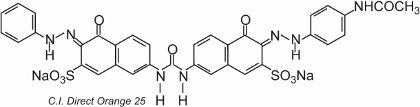
kde jsou dvě ketohydrazonové skupiny.
Další příklad, C.I. Direct Blue 71, má tři azoskupiny, z nichž jedna je přítomna jako ketohydrazonový tautomer:
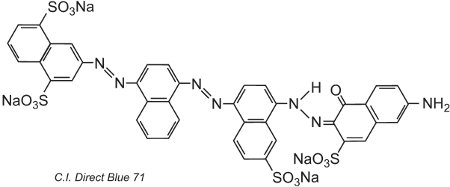
(iv) Základní barviva
Základní barviva patřila mezi první syntetická barviva. Mauvein je skutečně základní barvivo. Chromofor je přítomen jako kationt a dnes se používají při barvení akrylových vláken (obvykle kopolymer s propenonitrilem (akrylonitril) a malým množstvím kopolomeru, které obsahují sulfonátové, -SO3-, a karboxylátové, -CO2-, skupiny). Jedná se o iontové interakce (tabulky 2 a 4).
Existuje asi 100 bazických (kationtových) barviv, jejichž barvy zahrnují červenou, žlutou a modrou s jasnými výraznými odstíny. Některá jsou založena na chromoforových systémech azobarviv a antrachinonů. Mnohé jsou také založeny na arylkarboniových iontech. Příkladem je C.I. Basic Green 4 (známá jako malachitová zeleň) a C.I. Basic Red 9.
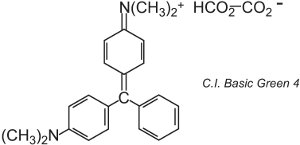 |
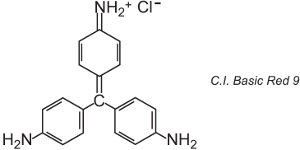 |
Oboje jsou triarylmethany, skupina barviv, která při relativně malých změnách struktury vytvářejí řadu červených, zelených a fialových odstínů.
Používají se také další, tzv. polymethová barviva (obsahují jednu nebo více skupin -CH=). Za svou barvu vděčí přítomnosti konjugovaného systému. Příkladem takového barviva je C.I. Basic Yellow 28, což je diazacyanin:
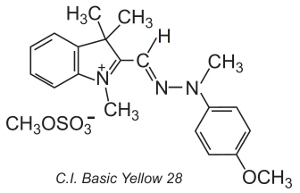
Barviva se často aplikují v roztoku elektrolytu, který řídí rychlost difuze ve struktuře vlákna, při teplotách kolem 370 K.
(v) Disperzní barviva
Tato barviva jsou v podstatě hydrofobní a jsou téměř nerozpustná ve vodě. Mají však afinitu k hydrofobním vláknům, například polyesterům, a používají se jako velmi jemné disperze ve vodě (tabulka 4).
Většina disperzních barviv jsou azosloučeniny a mohou dávat barvy v celém spektru. Některá z nich jsou barviva na bázi antrachinonů pro červenou, fialovou, modrou a zelenou barvu.
Polyesterová vlákna lze barvit při teplotě 400 K pod tlakem, což umožňuje použití větších molekulárních struktur barviv, které dosahují lepší stálosti, například:
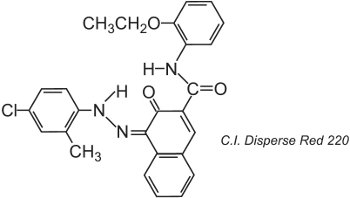
Zobrazená struktura je tautomer ketohydrazonu.
Barviva skupiny 2
Ačkoli se barviva této skupiny aplikují dvoustupňovým procesem (což kontrastuje s jednostupňovým procesem u barviv skupiny 1), mají tato barviva výhody, zejména pokud jde o stálost.
i) Reaktivní barviva
Reaktivní barviva mají mimořádný význam pro barvení bavlny, neboť umožňují jasně intenzivní zbarvení s vysokou stálostí. Přibližně 95 % reaktivních barviv jsou azobarviva pokrývající celou škálu barev. Modrou a zelenou barvu poskytují také antrachinonové a ftalocyaninové struktury.
Jak název těchto barviv napovídá, reagují s vláknem, ať už celulózovým (bavlna) nebo bílkovinným (vlna), za vzniku kovalentních vazeb (tabulka 4). Tyto dvě fáze, nejprve barvení a poté reakce, mohou probíhat odděleně nebo současně. Charakteristickým strukturním rysem je přítomnost jedné nebo více reaktivních skupin. Obvykle jsou barviva znázorněna jako
D-B-RG
, kde D je chromogen, B přemosťující skupina a RG reaktivní skupina.
Nejdůležitější reaktivní skupiny jsou chlorované triaziny a vinylsulfones.
Jedním ze tří izomerů nejjednoduššího triazinu je:
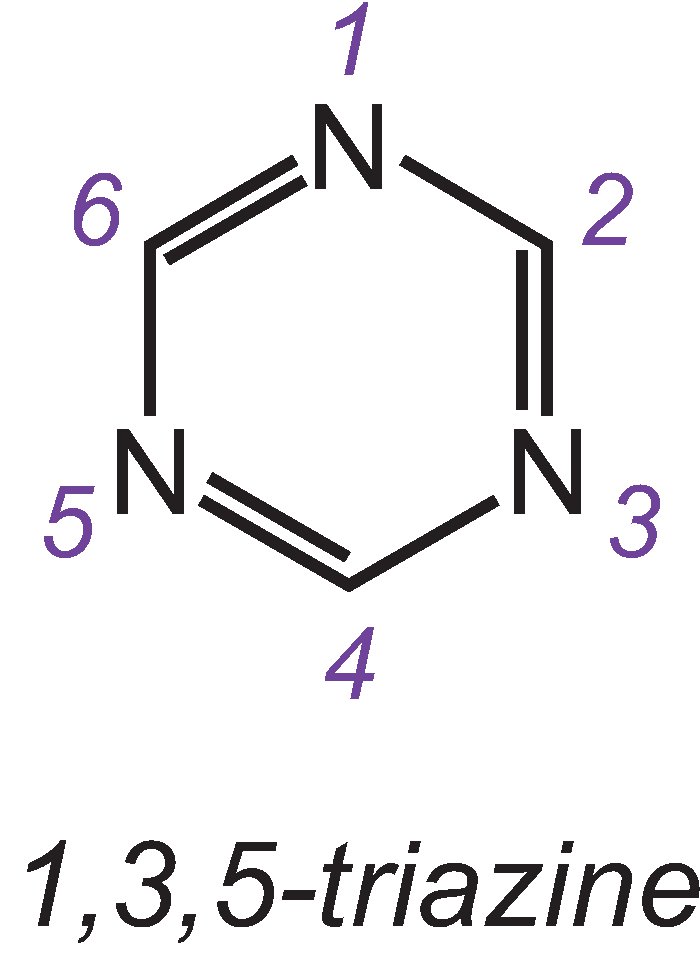
Příkladem barviva s dichlorotriazinovou skupinou je C.I. Reaktivní modř 109:
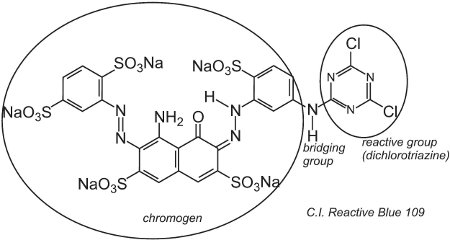
Reakce mezi -OH skupinami celulózy ve vlákně a -C-Cl skupinami v chlorotriazinu probíhá (nukleofilní) substituční reakcí za vzniku kovalentních vazeb.
Ethenylsulfon (vinyl) obsahuje skupinu CH2=CHSO2 a nejjednodušší je diethenylsulfon (divinylsulfon). Sulfonovou skupinu lze vidět v C.I. Reactive Blue 19:
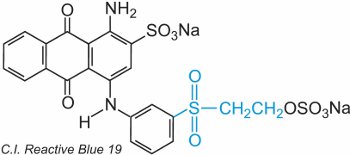
V tomto příkladu není žádná přemosťující skupina.
Barvivo reaguje s celulosou adicí na dvojnou vazbu síry a kyslíku.
Reaktivní barviva mohou ve vodném roztoku podléhat hydrolýze sulfonu, čímž se stane nereaktivním vůči celulose. To znamená, že nezreagované barvivo, pokud není řádně vymyto, zůstane na povrchu tkaniny a vytvoří zdánlivou barvu, která se časem vymývá. K omezení tohoto problému byla navržena barviva se dvěma různými reaktivními skupinami s rozdílnou reaktivitou. Tato barviva nabízejí lepší stálost, protože pokud je jedna ze skupin v roztoku hydrolyzována, druhá reaguje s hydroxylovými skupinami v tkanině. První z nich obsahovala jak chlorotriazinovou, tak vinylsulfonovou skupinu a příkladem je C.I. Reactive Red 194:
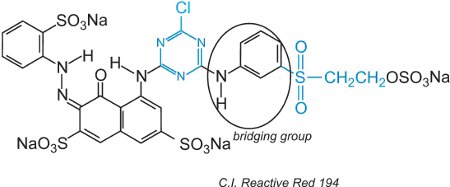
Kromě dvou různých reaktivních skupin je zde chromogen a přemosťující skupina.
Všechna reaktivní barviva mají relativně malou molekulovou velikost a mají také dvě nebo více skupin kyseliny sulfonové v chromogenu, což vede k vysoké rozpustnosti ve vodě. Část druhů barviv (aniontová) s vláknem nereaguje, hydrolyzuje se a produkt se musí odstranit praním.

Obrázek 3 Džíny se barví indigem a různými sirnými barvivy, přičemž výběr závisí na požadované barvě.
S laskavým svolením Lizzie Hubbard.
(ii) Kádinková barviva
Přibližně 80 % kádinkových barviv patří do chemické třídy antrachinonových barviv a pokrývají celou barevnou škálu. Jeden typ, indigoidní barviva, zahrnuje indigo:
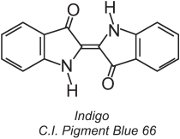
Všechna kádinková barviva jsou nerozpustná ve vodě. Pro jejich aplikaci na vlákno, například bavlnu, se umístí do alkalického roztoku (tabulka 4). Nerozpustné barvivo se redukuje za vzniku bezbarvého (leuko)aniontu, který je rozpustný a má afinitu k vláknu. To je pak vláknem adsorbováno, někdy za přítomnosti chloridu sodného, což jsou podobné podmínky jako u přímých barviv. Po procesu barvení se původní nerozpustné mateřské barvivo regeneruje uvnitř vlákna oxidací, obvykle pomocí roztoku peroxidu vodíku nebo jednoduše vzduchem:
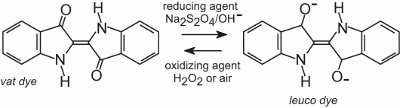
Barviva jsou ve struktuře vlákna nerozpustná, a proto mají dobrou odolnost proti praní a mají také vysokou odolnost proti světlu.
(iii) Sírová barviva
Sírová barviva se stejně jako kádinková barviva aplikují na textil (celulózu, tabulka 4) jako rozpustná aniontová forma a poté se oxidují do nerozpustné formy.
C.I. Sulphur Black 1 a C.I. Sulphur Blue 7 patří mezi nejpoužívanější sírová barviva. Stejně jako u ostatních sirných barviv je jejich struktura proměnlivá a z velké části neznámá. Poskytují řadu černých, hnědých a matných modrých barev. Jejich výroba je však mnohem levnější než výroba kádinových barviv, protože jejich příprava zahříváním různých organických sloučenin se sírou je jednoduchá.
Pigmenty
Pigmenty se používají při barvení barev, tiskařských barev, keramiky a plastů. Lze je použít na mnohem širší škálu látek než barviva, protože jejich použití není závislé na rozpustnosti ve vodě. Pigment je jemně rozptýlená pevná látka, která je v podstatě nerozpustná ve svém aplikačním médiu. Ve většině případů se pigment přidává do kapalného média, např. do mokré barvy nebo roztaveného termoplastu. Prostředí se pak nechá ztuhnout odpařením rozpouštědla nebo ochlazením, a tak se molekuly pigmentu mechanicky fixují v pevném stavu.
Chromofory používané v pigmentech jsou obvykle stejné jako chromofory používané v barvivech, ale pigmenty jsou velké molekuly a nemají rozpouštěcí skupiny. Obsahují skupiny, které vytvářejí mezimolekulární vazby, které pomáhají snižovat rozpustnost. Čím větší je molekula, tím je pigment neprůhlednější.

| Obrázky 4 a 5 Červené a žluté barvivo jsou azobarviva (C.I. Pigment Red 57 a C.I. Pigment Yellow 13). Modrá barva je pigment měďnatý ftalocyanin. S laskavým svolením společnosti BASF. |
 |
Organické pigmenty obecně vytvářejí vyšší intenzitu a jas barvy než anorganické pigmenty, jako je chromová žluť (chroman(II) olovnatý(VI)).
Organické pigmenty vykazují řadu vlastností stálosti, které závisí na molekulární struktuře a povaze vnitromolekulárního spojení v pevném stavu. Zvýšení molekulární velikosti pigmentu obecně snižuje rozpustnost pigmentu. Také mnoho pigmentů má začleněnou amidovou skupinu (-NHCO-), která dále snižuje jeho rozpustnost, protože molekuly jsou drženy pohromadě ve velkých strukturách vodíkovou vazbou (mezi skupinou N-H v jedné molekule a skupinou C=O v druhé).
Mnoho organických pigmentů je založeno na azochemii a dominují v oblasti žlutých, oranžových a červených odstínů. Příkladem jednoduchého monoazo pigmentu je C.I. Pigment Yellow 1:
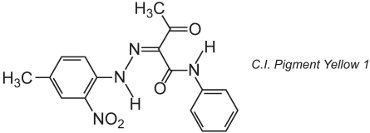
Tato forma je ketohydrazonový tautomer.
Měděné ftalocyaniny poskytují většinu modrých a zelených pigmentů. Jsou strukturně složité, ale jejich výroba je relativně levná. Poskytují vynikající odolnost vůči světlu, teplu, kyselinám a louhům.
Příkladem je C.I. Pigment Blue 15:
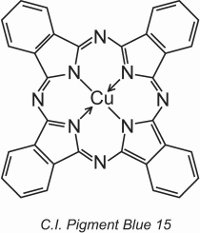
Dříve v jednotce byla popsána struktura barviva, C.I. Direct Blue 86, byla zobrazena a je vidět, jak skupiny kyseliny sulfonové v této struktuře přeměňují pigment na barvivo.
Funkční (high-tech) barviva a pigmenty
Funkční barviva a pigmenty se vyrábějí v malých objemech ve srovnání se sloučeninami používanými k barvení textilií. Jsou však předmětem velkého výzkumu a zájmu a jsou vyvíjeny pro různé účely. Některé z nich jsou uvedeny níže.
(a) Displeje z tekutých krystalů
Tekuté krystaly hrají již mnoho let důležitou roli v našem životě v různých formách zobrazování informací, např. v kalkulačkách. Zpočátku dokázaly zobrazovat pouze rozdíly mezi světlem a tmou. Bylo zjištěno, že pomocí barviv lze tento kontrast zvýšit a vyrobit barevné obrazovky. V současné době z velké části nahradily tradiční zobrazovací technologie světelných diod a katodových trubic. Použitá barviva byla speciálně navržena tak, aby měnila orientaci s molekulami tekutých krystalů, a proto nabízejí vyšší intenzitu barev. Říká se, že tato barviva vykazují dichroismus.
(b) Laserová barviva
Termín laser je zkratka označující zesílení světla stimulovanou emisí záření.
Obvykle se používaly anorganické lasery, které však měly schopnost produkovat záření pouze v několika vybraných vlnových délkách a ve velmi úzkém pásmu. Použití barviv umožnilo produkovat světlo v celém spektru od vlnových délek 320 do 1200 nm. Použití barvicích laserů zahrnuje komunikační technologie a mikrochirurgii.
(c) Inkoustový tisk
Inkoustový tisk je neimpaktní technika pro vytváření obrazů nasměrováním malých kapiček inkoustu, ideálně pod kontrolou počítače, v rychlém sledu na podklad. Našel mnoho aplikací. Vzhledem k požadavkům na velikost kapiček, aby bylo možné dosáhnout dobrého rozlišení, se upřednostňuje použití barviv před pigmenty. Kapičky jsou menší (pigmenty mají tendenci blokovat trysky) a rozpustnost ve vodě snižuje dopad na životní prostředí a udržuje nízkou cenu. Prvními barvivy byla barviva, která se již používala v jiných průmyslových odvětvích, ale vyznačovala se špatnou voděodolností. To vedlo k vývoji specifických barviv a jedinečných kapalinových systémů. Tato barviva jsou navržena tak, aby byla rozpustná v mírně alkalických systémech (pH 7,5 až 10), které se stávají nerozpustnými v mírně kyselých podmínkách (pH 4,5 až 6,5) na papíru nebo jiném podkladu. Tato technologie má velký vliv na velkoobjemový průmyslový tisk obalů, textilií, tapet a reklamních displejů.
(d) Fotodynamická terapie
Jedná se o léčbu rakoviny, která využívá kombinaci laserového světla, fotosenzibilizující sloučeniny (barviva) a molekulárního kyslíku. Barvivo se pacientovi podává nitrožilně a postupem času proniká do rakovinných buněk. Ozáření buněk laserovým světlem může zahájit jejich destrukci.
Laser interaguje s barvivem a podporuje ho do excitovaného stavu. Složitým procesem vznikají excitované (reaktivnější) molekuly kyslíku, které reagují s nenasycenými centry v bílkovinách a lipidech v buněčné membráně. Tento způsob léčby umožňuje vyhnout se použití invazivního chirurgického zákroku.