Klasser af krystallinske faste stoffer
Krystallinske stoffer kan beskrives ved hjælp af de typer partikler, de indeholder, og de typer af kemiske bindinger, der finder sted mellem partiklerne. Der findes fire typer af krystaller: Der findes fire typer krystaller: (1) ioniske, (2) metalliske, (3) kovalente netværk og (4) molekylære. Egenskaber og flere eksempler på hver type er anført i den følgende tabel og er beskrevet i tabellen nedenfor.
| Type af krystallinsk fast stof | Eksempler (formler) | Smeltepunkt (°C) | Normalt kogepunkt (°C) | |
|---|---|---|---|---|
| Ionisk | \(\ce{NaCl}\) | 801 | 1413 | |
| \(\ce{CaF_2}\) | 1418 | 1533 | ||
| Metallic | \(\ce{Hg}}\) | -39 | 630 | |
| \(\ce{Na}\) | 371 | 883 | ||
| \(\ce{Au}\) | 1064 | 2856 | ||
| \(\ce{W}\) | 3410 | 5660 | ||
| Kovalent netværk | \(\ce{B}\) | 2076 | 3927 | |
| \(\ce{C}\) (diamant) | 3500 | 3930 | 3930 | |
| \(\ce{SiO_2}\) | 1600 | 2230 | ||
| Molekylær | \(\ce{H_2}\) | -259 | -253 | |
| \(\ce{I_2}\) | 114 | 184 | ||
| \(\ce{NH_3}\) | -78 | -33 | ||
| \(\ce{H_2O}\) | 0 | 100 |
Ioniske krystaller – Den ioniske krystalstruktur består af skiftevis positivt ladede kationer og negativt ladede anioner (se figuren nedenfor). Ionerne kan enten være monatomære eller polyatomære. Generelt dannes ioniske krystaller af en kombination af metaller i gruppe 1 eller 2 og ikke-metaller i gruppe 16 eller 17 eller ikke-metalliske polyatomiske ioner. Ioniske krystaller er hårde og skøre og har et højt smeltepunkt. Ioniske forbindelser leder ikke elektricitet som faste stoffer, men leder elektricitet, når de er smeltet eller i vandig opløsning.
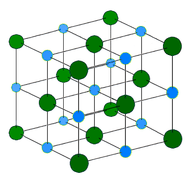
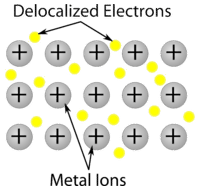
Metalkrystal – Metalkrystaller – Metalkrystaller består af metalkationer omgivet af et “hav” af mobile valenselektroner (se figuren nedenfor). Disse elektroner, også kaldet delokaliserede elektroner, hører ikke til et enkelt atom, men er i stand til at bevæge sig gennem hele krystallen. Som følge heraf er metaller gode ledere af elektricitet. Som det fremgår af tabellen ovenfor, spænder smeltepunkterne for metalliske krystaller over et bredt område.
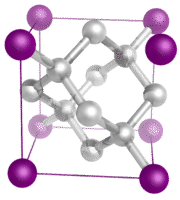
Kovalente netværkskrystaller – En kovalent netværkskrystal består af atomer ved gitterpunkterne i krystallet, hvor hvert atom er kovalent bundet til sine nærmeste naboatomer (se figuren nedenfor). Det kovalent bundne netværk er tredimensionelt og indeholder et meget stort antal atomer. Netværksfaste stoffer omfatter diamant, kvarts, mange metalloider og oxider af overgangsmetaller og metalloider. Netværksfaste stoffer er hårde og skøre og har ekstremt høje smelte- og kogepunkter. Da de består af atomer i stedet for ioner, leder de ikke elektricitet i nogen tilstand.
Molekylære krystaller – Molekylære krystaller består typisk af molekyler ved gitterpunkterne i krystallen, der holdes sammen af relativt svage intermolekylære kræfter (se figuren nedenfor). De intermolekylære kræfter kan være dispersionskræfter i tilfælde af upolære krystaller, eller dipol-dipolkræfter i tilfælde af polære krystaller. Nogle molekylære krystaller, som f.eks. is, har molekyler, der holdes sammen af hydrogenbindinger. Når en af ædelgasserne afkøles og størkner, er gitterpunkterne individuelle atomer snarere end molekyler. I alle tilfælde er de intermolekylære kræfter, der holder partiklerne sammen, langt svagere end enten ioniske eller kovalente bindinger. Som følge heraf er smelte- og kogepunkterne for molekylære krystaller meget lavere. Da molekylære krystaller ikke har ioner eller frie elektroner, er de dårlige elektriske ledere.

Nogle generelle egenskaber for de fire hovedklasser af faste stoffer er opsummeret i tabel \(\PageIndex{2}\).
| Ioniske faste stoffer | Molekylære faste stoffer | Kovalente faste stoffer | Metalliske faste stoffer | |
|---|---|---|---|---|
| *Der findes mange undtagelser. F.eks. har grafit en relativt høj elektrisk ledningsevne inden for kulstofplanerne, og diamant har den højeste termiske ledningsevne af alle kendte stoffer. | ||||
| dårlige ledere af varme og elektricitet | dårlige ledere af varme og elektricitet | dårlige ledere af varme og elektricitet* | gode ledere af varme og elektricitet | |
| relativt højt smeltepunkt | lavt smeltepunkt | højt smeltepunkt | Smeltepunkter afhænger stærkt af elektronkonfiguration | |
| hårdt men sprødt; splintres under spænding | blød | meget hård og skør | let deformeres under spænding; duktil og formbar | |
| relativt tæt | lav massefylde | lav massefylde | lav massefylde | normaltvis høj massefylde |
| dump overflade | mørk overflade | mørk overflade | mørk overflade | lyst |
Eksempel \(\PageIndex{1}\)
Klassificer \(\ce{Ge}\), \(\ce{RbI}\), \(\ce{C6(CH3)6}\) og \(\ce{Zn}}\) som ioniske, molekylære, kovalente eller metalliske faste stoffer og anbring dem i rækkefølge efter stigende smeltepunkter.
Givet: forbindelser
Spørgsmål: klassificering og rækkefølge af smeltepunkter
Strategi:
- Lokaliser det eller de bestanddelelement(er) i det periodiske system. På baggrund af deres positioner skal du forudsige, om hvert fast stof er ionisk, molekylært, kovalent eller metallisk.
- Ranger de faste stoffer i rækkefølge efter stigende smeltepunkter på baggrund af din klassifikation, begyndende med de molekylære faste stoffer.
Løsning:
A. Germanium ligger i p-blokken lige under Si, langs den diagonale linje af halvmetalliske grundstoffer, hvilket tyder på, at elementært Ge sandsynligvis vil have samme struktur som Si (diamantstrukturen). Ge er således sandsynligvis et kovalent fast stof.
RbI indeholder et metal fra gruppe 1 og et ikke-metal fra gruppe 17, så det er et ionisk fast stof, der indeholder Rb+- og I-ioner.
Forbindelsen \(\ce{C6(CH3)6}\) er et kulbrinte (hexamethylbenzen), som består af isolerede molekyler, der stabler sig til et molekylært fast stof uden kovalente bindinger mellem dem.
Zn er et d-blok-element, så det er et metallisk fast stof.
B. Det er ligetil at anbringe disse stoffer i rækkefølge efter stigende smeltepunkt, med en enkelt undtagelse. Vi forventer, at C6(CH3)6 har det laveste smeltepunkt, og at Ge har det højeste smeltepunkt, med RbI et sted midt imellem. Metallernes smeltepunkter er imidlertid vanskelige at forudsige på grundlag af de hidtil præsenterede modeller. Da Zn har en fyldt valensskal, bør det ikke have et særlig højt smeltepunkt, så et rimeligt gæt er
C6(CH3)6 < Zn ~ RbI < Ge.
De faktiske smeltepunkter er C6(CH3)6, 166°C; Zn, 419°C; RbI, 642°C; og Ge, 938°C. Dette stemmer overens med vores forudsigelse.
Ovelse \(\PageIndex{1}\)
Klassificer CO2, BaBr2, GaAs og AgZn som ioniske, kovalente, molekylære eller metalliske faste stoffer, og anbring dem derefter i rækkefølge efter stigende smeltepunkter.
Svar
CO2 (molekylært) < AgZn (metallisk) ~ BaBr2 (ionisk) < GaAs (kovalent).
De faktiske smeltepunkter er: CO2, ca. -15,6 °C; AgZn, ca. 700 °C; BaBr2, 856 °C; og GaAs, 1238 °C.