Klasy ciał stałych krystalicznych
Substancje krystaliczne mogą być opisane przez rodzaje cząstek w nich i rodzaje wiązań chemicznych, które mają miejsce między cząstkami. Istnieją cztery rodzaje kryształów: (1) jonowe, (2) metaliczne, (3) sieci kowalencyjne i (4) molekularne. Właściwości i kilka przykładów każdego typu są wymienione w poniższej tabeli i są opisane w tabeli poniżej.
| Typ ciała stałego krystalicznego | Przykłady (wzory) | Kolejność topnienia (°C) | Normalna temperatura wrzenia (°C) |
|---|---|---|---|
| Jonowe | (^NaCl}) | 801 | 1413 |
| (^CaF_2}) | 1418 | 1533 | |
| Metaliczny | (^Hg}) | -.39 | 630 |
| (\Na}) | 371 | 883 | |
| (\NAu}) | 1064 | 2856 | |
| (\W}) | 3410 | 5660 | |
| Sieć kowalencyjna | (diament) | 2076 | 3927 |
| (diament) | 3500 | 3930 | |
| (ce{SiO_2}}) | 1600 | 2230 | |
| Molekularny | (ce{H_2}}) | -.259 | -253 |
| (\ce{I_2}}) | 114 | 184 | |
| (\NH_3}) | -78 | -.33 | |
| (^H_2O}) | 0 | 100 |
Kryształy jonowe – Struktura kryształu jonowego składa się z naprzemiennie występujących dodatnio naładowanych kationów i ujemnie naładowanych anionów (patrz rysunek poniżej). Jony mogą być jednoatomowe lub wieloatomowe. Ogólnie rzecz biorąc, kryształy jonowe tworzą się z kombinacji metali grupy 1 lub 2 i niemetali grupy 16 lub 17 lub niemetalicznych jonów wieloatomowych. Kryształy jonowe są twarde i kruche oraz mają wysokie temperatury topnienia. Związki jonowe nie przewodzą prądu elektrycznego jako ciała stałe, ale przewodzą prąd elektryczny, gdy są stopione lub w roztworze wodnym.
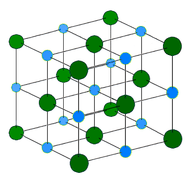
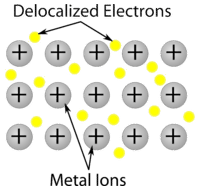
Kryształ metaliczny – Kryształy metaliczne składają się z kationów metali otoczonych „morzem” ruchomych elektronów walencyjnych (patrz rysunek poniżej). Elektrony te, zwane również elektronami delokalizowanymi, nie należą do żadnego atomu, ale są w stanie poruszać się po całym krysztale. W rezultacie, metale są dobrymi przewodnikami elektryczności. Jak widać w powyższej tabeli, temperatury topnienia kryształów metalicznych obejmują szeroki zakres.
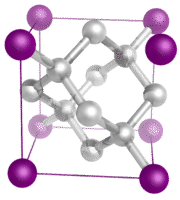
Kryształy molekularne – Kryształy molekularne zazwyczaj składają się z cząsteczek w punktach sieciowych kryształu, utrzymywanych razem przez stosunkowo słabe siły międzycząsteczkowe (patrz rysunek poniżej). Siły międzycząsteczkowe mogą być siłami dyspersyjnymi w przypadku kryształów niepolarnych lub siłami dipolowo-dipolowymi w przypadku kryształów polarnych. Niektóre kryształy molekularne, takie jak lód, mają cząsteczki utrzymywane razem przez wiązania wodorowe. Kiedy jeden z gazów szlachetnych jest schłodzony i zestalony, punktami sieci są pojedyncze atomy, a nie cząsteczki. We wszystkich przypadkach, siły międzycząsteczkowe trzymające cząsteczki razem są znacznie słabsze niż wiązania jonowe lub kowalencyjne. W rezultacie, temperatury topnienia i wrzenia kryształów molekularnych są znacznie niższe. Brak jonów lub wolnych elektronów sprawia, że kryształy molekularne są słabymi przewodnikami elektrycznymi.

Niektóre ogólne właściwości czterech głównych klas ciał stałych zestawiono w tabeli
| Ionic Solids | Molecular Solids | Covalent Solids | Metallic Solids | |
|---|---|---|---|---|
| *Istnieją liczne wyjątki. Na przykład, grafit ma stosunkowo wysoką przewodność elektryczną w obrębie płaszczyzn węglowych, a diament ma najwyższą przewodność cieplną spośród wszystkich znanych substancji. | ||||
| słabe przewodniki ciepła i energii elektrycznej | słabe przewodniki ciepła i energii elektrycznej | słabe przewodniki ciepła i energii elektrycznej* | dobre przewodniki ciepła i energii elektrycznej | dobre przewodniki ciepła i energii elektrycznej |
| relatywnie wysoka temperatura topnienia | niska temperatura topnienia | wysoka temperatura topnienia | punkty topnienia silnie zależą od konfiguracji elektronów | |
| twarde, ale kruche; kruszą się pod wpływem naprężeń | miękkie | bardzo twarde i kruche | łatwo odkształcające się pod wpływem naprężeń; ciągliwy i plastyczny | |
| stosunkowo gęsty | mała gęstość | mała gęstość | zwykle duża gęstość | |
| tępy surface | dull surface | dull surface | lustrous | |
Przykład \(\PageIndex{1}})
Klasyfikuj \(\ce{Ge}}, \RbI}}, C6(CH3)6}} i Zn}} jako jonowe, molekularne, kowalencyjne lub metaliczne ciała stałe i ułóż je w kolejności rosnących temperatur topnienia.
Dane: związki
Pytanie o: klasyfikację i kolejność temperatur topnienia
Strategia:
- Zlokalizuj element(y) składowe w układzie okresowym. Na podstawie ich pozycji, przewidzieć, czy każde ciało stałe jest jonowe, cząsteczkowe, kowalencyjne lub metaliczne.
- Ułóż ciała stałe w kolejności rosnących temperatur topnienia w oparciu o klasyfikację, zaczynając od ciał stałych molekularnych.
Rozwiązanie:
A. Germanu leży w bloku p tuż pod Si, wzdłuż ukośnej linii półmetalicznych elementów, co sugeruje, że elementarne Ge jest prawdopodobne, aby mieć taką samą strukturę jak Si (struktura diamentu). Tak więc Ge jest prawdopodobnie kowalencyjnym ciałem stałym.
RbI zawiera metal z grupy 1 i niemetal z grupy 17, więc jest to jonowe ciało stałe zawierające jony Rb+ i I-.
Związek \(\}C6(CH3)6} jest węglowodorem (heksametylobenzenem), który składa się z izolowanych cząsteczek, które układają się w stos tworząc molekularne ciało stałe bez wiązań kowalencyjnych między sobą.
Zn jest pierwiastkiem d-blokowym, jest więc metalicznym ciałem stałym.
B. Ułożenie tych substancji w kolejności rosnących temperatur topnienia jest proste, z jednym wyjątkiem. Spodziewamy się, że C6(CH3)6 ma najniższą temperaturę topnienia i Ge ma najwyższą temperaturę topnienia, z RbI gdzieś pomiędzy. Temperatury topnienia metali są jednak trudne do przewidzenia na podstawie przedstawionych do tej pory modeli. Ponieważ Zn ma wypełnioną powłokę walencyjną, nie powinien mieć szczególnie wysokiej temperatury topnienia, więc rozsądne przypuszczenie to
C6(CH3)6 < Zn ~ RbI < Ge.
Rzeczywiste temperatury topnienia to C6(CH3)6, 166°C; Zn, 419°C; RbI, 642°C; i Ge, 938°C. Zgadza się to z naszym przewidywaniem.
Ćwiczenie
Sklasyfikuj CO2, BaBr2, GaAs i AgZn jako ciała stałe jonowe, kowalencyjne, cząsteczkowe lub metaliczne, a następnie ułóż je w kolejności rosnących temperatur topnienia.
Odpowiedź
CO2 (molekularne) < AgZn (metaliczne) ~ BaBr2 (jonowe) < GaAs (kowalencyjne).
Faktyczne temperatury topnienia to: CO2, około -15,6°C; AgZn, około 700°C; BaBr2, 856°C; i GaAs, 1238°C.
.