Classi di Solidi Cristallini
Le sostanze cristalline possono essere descritte dai tipi di particelle che le compongono e dai tipi di legame chimico che avvengono tra le particelle. Ci sono quattro tipi di cristalli: (1) ionico, (2) metallico, (3) rete covalente, e (4) molecolare. Le proprietà e diversi esempi di ogni tipo sono elencati nella seguente tabella e sono descritti nella tabella sottostante.
| Tipo di solido cristallino | Esempi (formule) | Punto di fusione (°C) | Punto di ebollizione normale (°C) |
|---|---|---|---|
| Ionico | (\ce{NaCl}) | 801 | 1413 |
| \(\ce{CaF_2}) | 1418 | 1533 | |
| Metallico | \(\ce{Hg}) | -39 | 630 |
| (\ce{Na}) | 371 | 883 | |
| \(\ce{Au}) | 1064 | 2856 | |
| (\ce{W}) | 3410 | 5660 | |
| Rete covalente | \(\ce{B}) | 2076 | 3927 |
| \(\ce{C}) (diamante) | 3500 | 3930 | |
| \(\ce{SiO_2}) | 1600 | 2230 | |
| Molecolare | \(\ce{H_2}) | -259 | -253 |
| \(\ce{I_2}) | 114 | 184 | |
| (\ce{NH_3}) | -78 | -33 | |
| \(\ce{H_2O}) | 0 | 100 |
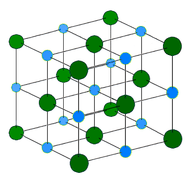
Cristalli ionici – La struttura del cristallo ionico consiste nell’alternanza di cationi con carica positiva e anioni con carica negativa (vedi figura sotto). Gli ioni possono essere monoatomici o poliatomici. Generalmente, i cristalli ionici si formano da una combinazione di metalli del gruppo 1 o 2 e ioni non metallici del gruppo 16 o 17 o poliatomici non metallici. I cristalli ionici sono duri e fragili e hanno alti punti di fusione. I composti ionici non conducono elettricità come solidi, ma conducono elettricità quando sono fusi o in soluzione acquosa.
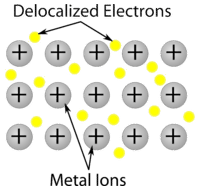
Cristalli a rete covalente – Un cristallo a rete covalente consiste di atomi nei punti del reticolo del cristallo, con ogni atomo legato covalentemente agli atomi vicini (vedi figura sotto). La rete di legami covalenti è tridimensionale e contiene un numero molto grande di atomi. I solidi a rete includono il diamante, il quarzo, molti metalloidi e gli ossidi di metalli di transizione e metalloidi. I solidi a rete sono duri e fragili, con punti di fusione e di ebollizione estremamente alti. Essendo composti da atomi piuttosto che da ioni, non conducono elettricità in nessun stato.
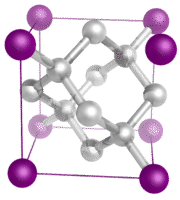
Cristalli molecolari – I cristalli molecolari consistono tipicamente di molecole nei punti del reticolo del cristallo, tenute insieme da forze intermolecolari relativamente deboli (vedi figura sotto). Le forze intermolecolari possono essere forze di dispersione nel caso di cristalli non polari, o forze dipolo-dipolo nel caso di cristalli polari. Alcuni cristalli molecolari, come il ghiaccio, hanno molecole tenute insieme da legami idrogeno. Quando uno dei gas nobili viene raffreddato e solidificato, i punti del reticolo sono atomi individuali piuttosto che molecole. In tutti i casi, le forze intermolecolari che tengono insieme le particelle sono molto più deboli dei legami ionici o covalenti. Di conseguenza, i punti di fusione e di ebollizione dei cristalli molecolari sono molto più bassi. Mancando ioni o elettroni liberi, i cristalli molecolari sono poveri conduttori elettrici.

Alcune proprietà generali delle quattro maggiori classi di solidi sono riassunte nella Tabella \(\PageIndex{2}).
| Solidi ionici | Solidi molecolari | Solidi covalenti | Solidi metallici |
|---|---|---|---|
| *Molte eccezioni esistono. Per esempio, la grafite ha una conduttività elettrica relativamente alta all’interno dei piani di carbonio, e il diamante ha la più alta conduttività termica di qualsiasi sostanza conosciuta. | |||
| poco conduttori di calore ed elettricità | poco conduttori di calore ed elettricità | poco conduttori di calore ed elettricità* | buoni conduttori di calore ed elettricità |
| punto di fusione relativamente alto | punto di fusione basso | punto di fusione alto | i punti di fusione dipendono fortemente dalla configurazione elettronica |
| duro ma fragile; si frantuma sotto sforzo | morbido | molto duro e fragile | si deforma facilmente sotto sforzo; duttile e malleabile |
| relativamente denso | a bassa densità | a bassa densità | di solito ad alta densità |
| poco denso superficie | superficie opaca | superficie opaca | lustre |
Esempio \(\PageIndex{1})
Classificare \(\ce{Ge}), \(\ce{RbI}}), \ce{C6(CH3)6}, e \ce{Zn} come solidi ionici, molecolari, covalenti o metallici e disponili in ordine crescente di punto di fusione.
Dato: composti
Chiesto: classificazione e ordine dei punti di fusione
Strategia:
- Posiziona l’elemento o gli elementi componenti nella tavola periodica. Basandoti sulla loro posizione, predici se ogni solido è ionico, molecolare, covalente o metallico.
- Ordina i solidi in ordine crescente di punto di fusione in base alla tua classificazione, iniziando dai solidi molecolari.
Soluzione:
A. Il germanio si trova nel blocco p appena sotto Si, lungo la linea diagonale degli elementi semi-metallici, il che suggerisce che il Ge elementare ha probabilmente la stessa struttura del Si (la struttura del diamante). Quindi Ge è probabilmente un solido covalente.
RbI contiene un metallo del gruppo 1 e un non metallo del gruppo 17, quindi è un solido ionico contenente ioni Rb+ e I-.
Il composto \(\ce{C6(CH3)6}\ è un idrocarburo (esametilbenzene), che consiste di molecole isolate che si impilano per formare un solido molecolare senza legami covalenti tra loro.
Zn è un elemento del blocco d, quindi è un solido metallico.
B. Sistemare queste sostanze in ordine di punti di fusione crescenti è semplice, con un’eccezione. Ci aspettiamo che C6(CH3)6 abbia il punto di fusione più basso e che Ge abbia il punto di fusione più alto, con RbI da qualche parte nel mezzo. I punti di fusione dei metalli, tuttavia, sono difficili da prevedere sulla base dei modelli presentati finora. Poiché lo Zn ha un guscio di valenza pieno, non dovrebbe avere un punto di fusione particolarmente alto, quindi un’ipotesi ragionevole è
C6(CH3)6 < Zn ~ RbI < Ge.
I punti di fusione reali sono C6(CH3)6, 166°C; Zn, 419°C; RbI, 642°C; e Ge, 938°C. Questo concorda con la nostra previsione.
Esercizio \(\PageIndex{1})
Classificare CO2, BaBr2, GaAs, e AgZn come solidi ionici, covalenti, molecolari o metallici e poi disporli in ordine crescente di punti di fusione.
Risposta
CO2 (molecolare) < AgZn (metallico) ~ BaBr2 (ionico) < GaAs (covalente).
I punti di fusione attuali sono: CO2, circa -15,6°C; AgZn, circa 700°C; BaBr2, 856°C; e GaAs, 1238°C.