Klassen von kristallinen Festkörpern
Kristalline Substanzen können durch die Art der Teilchen in ihnen und die Art der chemischen Bindung, die zwischen den Teilchen stattfindet, beschrieben werden. Es gibt vier Arten von Kristallen: (1) ionisch, (2) metallisch, (3) kovalentes Netzwerk und (4) molekular. Die Eigenschaften und einige Beispiele für jeden Typ sind in der folgenden Tabelle aufgeführt und werden in der folgenden Tabelle beschrieben.
| Typ des kristallinen Feststoffs | Beispiele (Formeln) | Schmelzpunkt (°C) | Normaler Siedepunkt (°C) |
|---|---|---|---|
| Ionisch | \(\ce{NaCl}\) | 801 | 1413 |
| \(\ce{CaF_2}\) | 1418 | 1533 | |
| Metallisch | \(\ce{Hg}\) | -39 | 630 |
| \(\ce{Na}\) | 371 | 883 | |
| \(\ce{Au}\) | 1064 | 2856 | |
| \(\ce{W}\) | 3410 | 5660 | |
| Kovalentes Netzwerk | \(\ce{B}\) | 2076 | 3927 |
| \(\ce{C}\) (Diamant) | 3500 | 3930 | |
| \(\ce{SiO_2}\) | 1600 | 2230 | |
| Molekular | \(\ce{H_2}\) | -259 | -253 |
| \(\ce{I_2}\) | 114 | 184 | |
| \(\ce{NH_3}\) | -78 | -33 | |
| \(\ce{H_2O}\) | 0 | 100 |
Ionische Kristalle – Die ionische Kristallstruktur besteht aus abwechselnd positiv geladenen Kationen und negativ geladenen Anionen (siehe Abbildung unten). Die Ionen können entweder einatomig oder mehratomig sein. Im Allgemeinen bilden sich Ionenkristalle aus einer Kombination von Metallen der Gruppe 1 oder 2 und Nichtmetallen der Gruppe 16 oder 17 oder nichtmetallischen mehratomigen Ionen. Ionische Kristalle sind hart und spröde und haben einen hohen Schmelzpunkt. Ionische Verbindungen leiten als Festkörper keine Elektrizität, aber sie leiten Elektrizität, wenn sie geschmolzen oder in wässriger Lösung vorliegen.
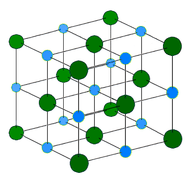
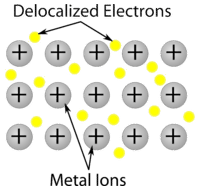
Metallic crystal – Metallische Kristalle bestehen aus Metallkationen, die von einem „Meer“ beweglicher Valenzelektronen umgeben sind (siehe Abbildung unten). Diese Elektronen, die auch als delokalisierte Elektronen bezeichnet werden, gehören nicht zu einem bestimmten Atom, sondern können sich durch den gesamten Kristall bewegen. Infolgedessen sind Metalle gute Stromleiter. Wie aus der obigen Tabelle hervorgeht, liegen die Schmelzpunkte von Metallkristallen in einem weiten Bereich.
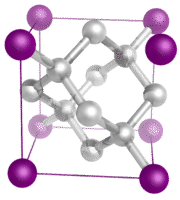
Kovalente Netzwerkkristalle – Ein kovalentes Netzwerkkristall besteht aus Atomen an den Gitterpunkten des Kristalls, wobei jedes Atom kovalent an seine nächsten Nachbaratome gebunden ist (siehe Abbildung unten). Das kovalent gebundene Netzwerk ist dreidimensional und enthält eine sehr große Anzahl von Atomen. Zu den Netzwerkfestkörpern gehören Diamant, Quarz, viele Metalloide und Oxide von Übergangsmetallen und Metalloiden. Netzwerkfeststoffe sind hart und spröde und haben extrem hohe Schmelz- und Siedepunkte. Da sie aus Atomen und nicht aus Ionen bestehen, leiten sie in keinem Zustand Elektrizität.
Molekulare Kristalle – Molekulare Kristalle bestehen typischerweise aus Molekülen an den Gitterpunkten des Kristalls, die durch relativ schwache intermolekulare Kräfte zusammengehalten werden (siehe Abbildung unten). Bei den zwischenmolekularen Kräften kann es sich um Dispersionskräfte im Fall von unpolaren Kristallen oder um Dipol-Dipol-Kräfte im Fall von polaren Kristallen handeln. Einige Molekülkristalle, wie z. B. Eis, haben Moleküle, die durch Wasserstoffbrückenbindungen zusammengehalten werden. Wenn eines der Edelgase abgekühlt und verfestigt wird, bestehen die Gitterpunkte aus einzelnen Atomen und nicht aus Molekülen. In allen Fällen sind die zwischenmolekularen Kräfte, die die Teilchen zusammenhalten, viel schwächer als ionische oder kovalente Bindungen. Infolgedessen sind die Schmelz- und Siedepunkte von Molekülkristallen viel niedriger. Da ihnen Ionen oder freie Elektronen fehlen, sind Molekülkristalle schlechte elektrische Leiter.

Einige allgemeine Eigenschaften der vier Hauptklassen von Feststoffen sind in Tabelle \(\PageIndex{2}\) zusammengefasst.
| Ionische Feststoffe | Molekulare Feststoffe | Kovalente Feststoffe | Metallische Feststoffe |
|---|---|---|---|
| *Es gibt viele Ausnahmen. Zum Beispiel hat Graphit eine relativ hohe elektrische Leitfähigkeit innerhalb der Kohlenstoffebenen, und Diamant hat die höchste Wärmeleitfähigkeit aller bekannten Stoffe. | |||
| schlechte Wärme- und Stromleiter | schlechte Wärme- und Stromleiter | schlechte Wärme- und Stromleiter* | gute Wärme- und Stromleiter |
| relativ hoher Schmelzpunkt | niedriger Schmelzpunkt | hoher Schmelzpunkt | Schmelzpunkte hängen stark von der Elektronenkonfiguration ab |
| hart aber spröde; zerbrechen unter Spannung | weich | sehr hart und spröde | leicht verformbar unter Spannung; dehnbar und verformbar |
| relativ dicht | geringe Dichte | geringe Dichte | gewöhnlich hohe Dichte |
| dumpf Oberfläche | stumpfe Oberfläche | stumpfe Oberfläche | glänzend |
Beispiel \(\PageIndex{1}\)
Klassifizieren \(\ce{Ge}\), \(\ce{RbI}\), \(\ce{C6(CH3)6}\) und \(\ce{Zn}\) als ionische, molekulare, kovalente oder metallische Festkörper und ordnen Sie sie in der Reihenfolge steigender Schmelzpunkte.
Gegeben: Verbindungen
Gefragt: Klassifizierung und Reihenfolge der Schmelzpunkte
Strategie:
- Lokalisiere das/die Element(e) im Periodensystem. Bestimmen Sie anhand ihrer Position, ob es sich um einen ionischen, molekularen, kovalenten oder metallischen Festkörper handelt.
- Reihen Sie die Festkörper in der Reihenfolge der steigenden Schmelzpunkte auf der Grundlage Ihrer Klassifizierung, beginnend mit den molekularen Festkörpern.
Lösung:
A. Germanium liegt im p-Block direkt unter Si, entlang der diagonalen Linie der halbmetallischen Elemente, was darauf schließen lässt, dass elementares Ge wahrscheinlich die gleiche Struktur wie Si hat (die Diamantstruktur). Ge ist also wahrscheinlich ein kovalenter Festkörper.
RbI enthält ein Metall der Gruppe 1 und ein Nichtmetall der Gruppe 17, ist also ein ionischer Festkörper mit Rb+ und I- Ionen.
Die Verbindung \(\ce{C6(CH3)6}\) ist ein Kohlenwasserstoff (Hexamethylbenzol), der aus isolierten Molekülen besteht, die sich zu einem molekularen Festkörper ohne kovalente Bindungen zwischen ihnen stapeln.
Zn ist ein d-Blockelement, also ein metallischer Festkörper.
B. Die Anordnung dieser Stoffe in der Reihenfolge der zunehmenden Schmelzpunkte ist einfach, mit einer Ausnahme. Wir erwarten, dass C6(CH3)6 den niedrigsten und Ge den höchsten Schmelzpunkt hat, wobei RbI irgendwo dazwischen liegt. Die Schmelzpunkte der Metalle sind jedoch auf der Grundlage der bisher vorgestellten Modelle schwer vorherzusagen. Da Zn eine gefüllte Valenzschale hat, sollte es keinen besonders hohen Schmelzpunkt haben, so dass eine vernünftige Schätzung
C6(CH3)6 < Zn ~ RbI < Ge lautet.
Die tatsächlichen Schmelzpunkte sind C6(CH3)6, 166°C; Zn, 419°C; RbI, 642°C; und Ge, 938°C. Dies stimmt mit unserer Vorhersage überein.
Übung \(\PageIndex{1}\)
Klassifizieren Sie CO2, BaBr2, GaAs und AgZn als ionische, kovalente, molekulare oder metallische Festkörper und ordnen Sie sie dann in der Reihenfolge der zunehmenden Schmelzpunkte.
Antwort
CO2 (molekular) < AgZn (metallisch) ~ BaBr2 (ionisch) < GaAs (kovalent).
Die tatsächlichen Schmelzpunkte sind: CO2, etwa -15,6°C; AgZn, etwa 700°C; BaBr2, 856°C; und GaAs, 1238°C.