Clases de Sólidos Cristalinos
Las sustancias cristalinas pueden describirse por los tipos de partículas que las componen y los tipos de enlace químico que tienen lugar entre las partículas. Hay cuatro tipos de cristales: (1) iónicos, (2) metálicos, (3) red covalente y (4) moleculares. Las propiedades y varios ejemplos de cada tipo se enumeran en la siguiente tabla y se describen en el cuadro siguiente.
| Tipo de sólido cristalino | Ejemplos (fórmulas) | Punto de fusión (°C) | Punto de ebullición normal (°C) |
|---|---|---|---|
| Iónico | (\ce{NaCl}) | 801 | 1413 |
| (\ce{CaF_2}) | 1418 | 1533 | |
| Metálico | (\ce{Hg}) | -39 | 630 |
| (c. Na) | 371 | 883 | |
| (c. Au) | 1064 | 2856 | |
| (\ce{W}) | 3410 | 5660 | |
| Red covalente | (\ce{B}) | 2076 | 3927 |
| (\ce{C}) (diamante) | 3500 | 3930 | |
| (\ce{SiO_2}) | 1600 | 2230 | |
| Molecular | (\ce{H_2}) | -259 | -253 |
| (cé {I_2}) | 114 | 184 | |
| (cé {NH_3}) | -78 | -33 | |
| (\ce{H_2O}) | 0 | 100 |
Cristales iónicos – La estructura cristalina iónica está formada por cationes de carga positiva y aniones de carga negativa alternados (véase la figura siguiente). Los iones pueden ser monatómicos o poliatómicos. Por lo general, los cristales iónicos se forman a partir de una combinación de metales del grupo 1 o 2 y no metales del grupo 16 o 17 o iones poliatómicos no metálicos. Los cristales iónicos son duros y frágiles y tienen puntos de fusión elevados. Los compuestos iónicos no conducen la electricidad como sólidos, pero sí conducen la electricidad cuando están fundidos o en solución acuosa.
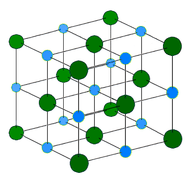
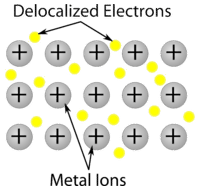
Cristales de red covalente: un cristal de red covalente está formado por átomos en los puntos de la red del cristal, estando cada átomo unido covalentemente a sus átomos vecinos más cercanos (véase la figura siguiente). La red de enlaces covalentes es tridimensional y contiene un gran número de átomos. Los sólidos de red incluyen el diamante, el cuarzo, muchos metaloides y los óxidos de metales de transición y metaloides. Los sólidos de red son duros y frágiles, con puntos de fusión y ebullición extremadamente altos. Al estar compuestos por átomos y no por iones, no conducen la electricidad en ningún estado.
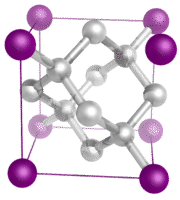
Cristales moleculares – Los cristales moleculares suelen estar formados por moléculas en los puntos de la red del cristal, que se mantienen unidas por fuerzas intermoleculares relativamente débiles (véase la figura siguiente). Las fuerzas intermoleculares pueden ser fuerzas de dispersión en el caso de los cristales no polares, o fuerzas dipolo-dipolo en el caso de los cristales polares. Algunos cristales moleculares, como el hielo, tienen moléculas unidas por enlaces de hidrógeno. Cuando uno de los gases nobles se enfría y solidifica, los puntos de la red son átomos individuales en lugar de moléculas. En todos los casos, las fuerzas intermoleculares que mantienen unidas las partículas son mucho más débiles que los enlaces iónicos o covalentes. En consecuencia, los puntos de fusión y ebullición de los cristales moleculares son mucho más bajos. Al carecer de iones o electrones libres, los cristales moleculares son malos conductores eléctricos.

Algunas propiedades generales de las cuatro clases principales de sólidos se resumen en la Tabla \(\PageIndex{2})
| Sólidos iónicos | Sólidos moleculares | Sólidos covalentes | Sólidos metálicos |
|---|---|---|---|
| *Existen muchas excepciones. Por ejemplo, el grafito tiene una conductividad eléctrica relativamente alta dentro de los planos de carbono, y el diamante tiene la mayor conductividad térmica de cualquier sustancia conocida. | |||
| Malos conductores de calor y electricidad | Malos conductores de calor y electricidad | Malos conductores de calor y electricidad* | Buenos conductores de calor y electricidad |
| punto de fusión relativamente alto | punto de fusión bajo | punto de fusión alto | los puntos de fusión dependen mucho de la configuración electrónica |
| duro pero frágil; se rompen bajo tensión | blandos | muy duros y frágiles | se deforman fácilmente bajo tensión; dúctil y maleable |
| relativamente densa | baja densidad | baja densidad | generalmente alta densidad |
| sin brillo superficie | superficie opaca | superficie opaca | lustre |
Ejemplo \(\ce{1})
Clasificar \(\ce{Ge}), \(\ce{RbI}), (\ce{C6(CH3)6}), y (\ce{Zn}) como sólidos iónicos, moleculares, covalentes o metálicos y ordénelos en orden de aumento de los puntos de fusión.
Dado: compuestos
Se pide: clasificación y orden de los puntos de fusión
Estrategia:
- Ubicar el o los elementos componentes en la tabla periódica. Basándose en sus posiciones, prediga si cada sólido es iónico, molecular, covalente o metálico.
- Ordenar los sólidos en orden de aumento de los puntos de fusión basándose en su clasificación, empezando por los sólidos moleculares.
Solución:
A. El germanio se encuentra en el bloque p justo debajo del Si, a lo largo de la línea diagonal de los elementos semimetálicos, lo que sugiere que es probable que el Ge elemental tenga la misma estructura que el Si (la estructura del diamante). Así, el Ge es probablemente un sólido covalente.
El RbI contiene un metal del grupo 1 y un no metal del grupo 17, por lo que es un sólido iónico que contiene iones Rb+ e I-.
El compuesto \ce{C6(CH3)6}\Nes un hidrocarburo (hexametilbenceno), que consiste en moléculas aisladas que se apilan para formar un sólido molecular sin enlaces covalentes entre ellas.
El Zn es un elemento del bloque d, por lo que es un sólido metálico.
B. La disposición de estas sustancias en orden de aumento de los puntos de fusión es sencilla, con una excepción. Esperamos que el C6(CH3)6 tenga el punto de fusión más bajo y que el Ge tenga el punto de fusión más alto, con el RbI en algún punto intermedio. Sin embargo, los puntos de fusión de los metales son difíciles de predecir según los modelos presentados hasta ahora. Debido a que el Zn tiene una cáscara de valencia llena, no debería tener un punto de fusión particularmente alto, por lo que una conjetura razonable es
C6(CH3)6 < Zn ~ RbI < Ge.
Los puntos de fusión reales son C6(CH3)6, 166°C; Zn, 419°C; RbI, 642°C; y Ge, 938°C. Esto concuerda con nuestra predicción.
Ejercicio \N(\PageIndex{1})
Clasifique el CO2, el BaBr2, el GaAs y el AgZn como sólidos iónicos, covalentes, moleculares o metálicos y, a continuación, ordénelos en orden de aumento de los puntos de fusión.
Respuesta
CO2 (molecular) < AgZn (metálico) ~ BaBr2 (iónico) < GaAs (covalente).
Los puntos de fusión reales son: CO2, unos -15,6°C; AgZn, unos 700°C; BaBr2, 856°C; y GaAs, 1238°C.