Les colorants sont utilisés dans de nombreuses industries – pour colorer les vêtements, les peintures, les plastiques, les photographies, les impressions et les céramiques. Les colorants sont également utilisés aujourd’hui dans de nouvelles applications et sont qualifiés de fonctionnels (haute technologie) car ils ne sont pas seulement inclus dans le produit pour des raisons esthétiques mais à des fins spécifiques, par exemple en chirurgie.
Les colorants peuvent être des colorants ou des pigments. Les colorants sont des composés organiques colorés solubles qui sont généralement appliqués sur les textiles à partir d’une solution dans l’eau. Ils sont conçus pour se lier fortement aux molécules de polymère qui composent la fibre textile.
Les pigments sont des composés insolubles utilisés dans les peintures, les encres d’imprimerie, les céramiques et les plastiques. Ils sont appliqués en utilisant une dispersion dans un milieu approprié. La plupart des pigments utilisés sont également des composés organiques.
- Manipulation de la couleur et application des colorants
- La coloration des textiles
- Classification des colorants
- Classification des colorants par leur structure chimique
- (a) Colorants azoïques
- (b) Colorants anthraquinoniques
- (c) Phtalocyanines
- Classification des colorants par les méthodes d’application
- Colorants du groupe 1
- (i) Colorants acides
- (ii) Colorants complexes métalliques
- (iii) Colorants directs
- (iv) Colorants basiques
- (v) Colorants dispersés
- Colorants du groupe 2
- i) Colorants réactifs
- (ii) Colorants de cuve
- (iii) Colorants au soufre
- Pigments
- Colorants et pigments fonctionnels (de haute technologie)
- (a) Affichages à cristaux liquides
- (b) Colorants laser
- (c) Impression par jet d’encre
- (d) Thérapie photodynamique
Manipulation de la couleur et application des colorants
Cette section examine une partie de la chimie derrière la couleur des colorants et comment le matériau cible, par exemple une fibre, influence la méthode de teinture et le colorant utilisé.
Un colorant en solution est coloré en raison de l’absorption sélective de certaines longueurs d’onde de la lumière par des liaisons spécifiques dans la molécule. La lumière transmise est vue par l’observateur et apparaît colorée parce que certaines des longueurs d’onde du spectre visible sont maintenant absentes.

Figure 1 La Mauveine a été le tout premier colorant synthétique. Elle a été produite accidentellement par William Perkin en 1856 qui essayait de synthétiser la quinine. Elle devint particulièrement populaire lorsque la reine Victoria porta une robe de soie teinte à la mauveine lors de l’exposition royale de 1862 à Londres.
Avec l’aimable autorisation de la Society of Dyers and Colourists.
L’absorption de l’énergie de la lumière visible par le composé fait passer les électrons de la molécule d’un état de faible énergie, l’état fondamental, à un état de plus haute énergie, l’état excité. On dit que la molécule a subi une transition électronique au cours de ce processus d’excitation. Des énergies d’excitation particulières correspondent à des longueurs d’onde particulières de la lumière visible.
C’est un électron n (un électron dans une liaison double ou triple) qui est promu à l’état excité. Il faut encore moins d’énergie pour cette transition si des liaisons simples et doubles alternées (c’est-à-dire des doubles liaisons conjuguées) existent dans la même molécule. L’excitation de l’électron est rendue encore plus facile par la présence de cycles aromatiques en raison de la délocalisation accrue des électrons n.
En modifiant la structure du composé, les chimistes coloristes peuvent modifier la longueur d’onde de la lumière visible absorbée et donc la couleur du composé.
Les molécules de la plupart des composés organiques colorés contiennent deux parties :
(i) un cycle aryle (aromatique) unique tel que le benzène ou un cycle benzénique avec un substituant. Alternativement, il peut y avoir un système d’anneaux fusionnés tel que le naphtalène (deux anneaux fusionnés ensemble) ou l’anthracène (trois anneaux fusionnés ensemble).
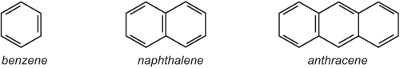
Là où les anneaux se rejoignent, ils partagent deux atomes de carbone et ainsi le naphtalène avec deux anneaux a 10 atomes de carbone, et non 12. De même, l’anthracène a 14 atomes de carbone et non 18. Comme le naphtalène et l’anthracène contiennent des électrons délocalisés sur tous les cycles, il est inapproprié d’utiliser le symbole de délocalisation utilisé pour le benzène dans les autres unités, car cela indiquerait deux ou trois systèmes délocalisés distincts. Ainsi, dans cette unité, on utilise des structures Kekule.
(ii) un système étendu de double liaison conjuguée contenant des groupes insaturés, connus sous le nom de chromophores, tels que :
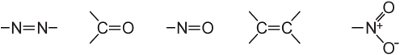
L’intensité de la couleur peut être augmentée dans une molécule de colorant par l’addition de substituants contenant des paires d’électrons solitaires sur le cycle aryle, tels que :
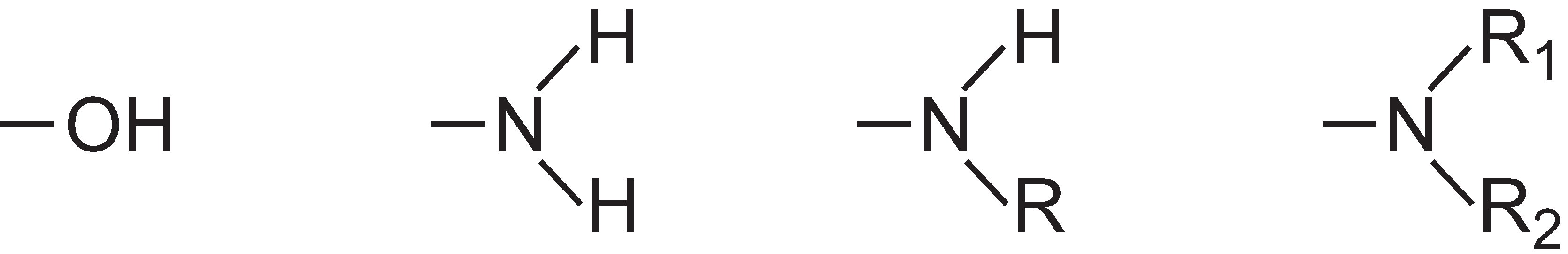
Ces groupes sont connus sous le nom d’auxochromes.
Parfois, la structure entière du colorant est appelée le chromogène.
Pour rendre le colorant important industriellement, les chimistes de la couleur doivent également être en mesure de modifier la solubilité du composé, et des groupes peuvent être inclus pour rendre le colorant soluble dans l’eau. Les exemples incluent le groupe acide sulfonique, -SO3H, ou le groupe acide carboxylique, -COOH, ou plus généralement, le sel de sodium de ces acides, -SO3-Na+ et -COO-Na+, respectivement.
Une autre préoccupation clé des chimistes développant des colorants est d’améliorer sa réactivité avec l’objet qu’ils veulent colorer, par exemple les molécules de la fibre. Ceci est discuté ci-dessous et des exemples sont donnés tout au long de l’unité.
La coloration des textiles
La nature chimique d’un colorant est déterminée par les propriétés chimiques et physiques des fibres du textile à colorer. Les quatre principaux types de fibres (tableau 1) sont les fibres protéiques, cellulosiques, régénérées (à base de cellulose ou de dérivés) et synthétiques.
| Fibres naturelles | Fibres synthétiques | ||
|---|---|---|---|
| Protéine | Cellulose | Régénérée | Synthétique |
| Laine | Coton | Viscose rayonne | Polyamides |
| Soie | Linen | Célulose éthanoates | Polyesters |
| Mohair | Ramie | Acryliques | |
| Cachemire | . | ||
| Le terme régénéré est utilisé lorsqu’un polymère naturel a été traité chimiquement pour former un autre polymère. Par exemple, la cellulose naturelle des plantes, lorsqu’elle est traitée avec de l’anhydride éthanoïque (anhydride acétique), produit un polymère, l’éthanoate de cellulose, qui est la rayonne. |
|||
Tableau 1 Classification des fibres textiles.
Pendant le processus de teinture d’un textile, le colorant est distribué entre les deux phases, la phase solide de la fibre et la phase aqueuse, et à la fin du processus de teinture, la solution est épuisée et la plupart du colorant est associé à la fibre. Une fois que les molécules de colorant ont pénétré dans la fibre, il y a une interaction immédiate entre les deux composants, ce qui empêche la désorption des molécules de colorant dans la solution. Le type d’interaction, physique ou chimique, dépendra des groupes présents sur les molécules de colorant et dans les chaînes de la fibre (tableau 2).
| Type de liaison | Force relative approximative |
|---|---|
| covalente | 30,0 |
| ionique | 7.0 |
| hydrogène | 3,0 |
| autre intermoléculaire | 1,0 |
Tableau 2 Forces relatives approximatives de liaison entre un colorant et un tissu.

Figure 2 Avant d’utiliser un colorant, il faut déterminer sa solidité à la lumière. Ces
racks, situés sur la côte nord-est de l’Australie, sont utilisés pour de nombreux tests de
maturité, parmi lesquels la solidité des couleurs. La position des claies peut
être modifiée mais sur la photo, elles forment un angle de 45° par rapport à l’horizontale.
Avec l’aimable autorisation du laboratoire d’exposition d’Allunga.
La solidité des couleurs d’un textile coloré est définie comme sa résistance au changement lorsqu’il est soumis à un ensemble particulier de conditions. Le colorant ne doit pas être fortement affecté par la lumière du soleil (solidité à la lumière), la chaleur lorsque le tissu est repassé (solidité à la chaleur), la transpiration (solidité à la transpiration) et lorsqu’il est lavé (solidité au lavage).
Classification des colorants
Le Colour Index International, produit par la Society of Dyers and Colourists, à Bradford, est une liste complète des colorants et pigments commerciaux connus et est mis à jour régulièrement. Chaque colorant se voit attribuer un nom et un numéro de Colour Index (C.I.). Par exemple:
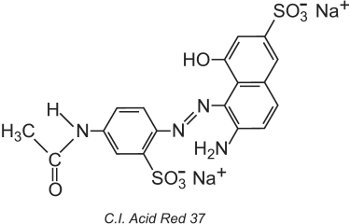
Tous les colorants de la liste ont été classés par leur structure chimique et par leur méthode d’application.
Classification des colorants par leur structure chimique
Le Colour Index affecte les colorants de structure connue à l’une des 25 classes structurelles selon le type chimique. Parmi les plus importantes figurent :
a) les colorants azoïques
b) les colorants anthraquinoniques
c) les phtalocyanines
(a) Colorants azoïques
Les colorants azoïques constituent la classe chimique la plus importante, contenant au moins 66% de tous les colorants. La caractéristique est la présence dans les structures d’un ou plusieurs groupes azoïques,

ainsi que des groupes hydroxyle, amine et amine substituée comme auxochromes.
Les composés azoïques aromatiques sont produits à partir d’amines aromatiques via le sel de diazonium correspondant.
Un sel de diazonium est formé lorsqu’une amine aromatique est traitée avec de l’acide nitreux (nitrique (III)). L’acide nitreux est formé in situ en ajoutant de l’acide chlorhydrique dilué à une solution fraîche de nitrite de sodium à environ 278 K. Dans l’exemple suivant, une solution de chlorure de benzènediazonium a été formée à partir de la phénylamine (aniline), l’amine aromatique la plus simple :

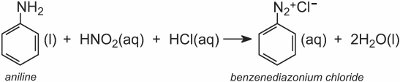
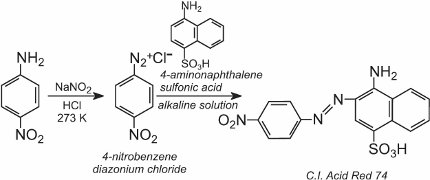
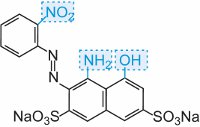
Une solution d’un autre composé tel qu’une autre amine aromatique ou un phénol est ensuite ajoutée à la solution froide et produit un composé azoïque qui est coloré. Un exemple est la formation d’un colorant rouge lorsqu’une solution aqueuse d’acide 4-aminonaphtalènesulfonique (acide naphthionique) est ajoutée à une solution de chlorure de 4-nitrobenzènediazonium pour former le C.I.. Rouge acide 74:
L’azobenzène est le chromophore de ces colorants azoïques,
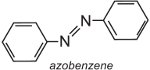
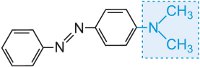
et la couleur de la molécule peut être modifiée et l’intensité de la couleur augmentée en faisant varier les auxochromes (tableau 3).
| Structure | Couleur observée |
|---|---|
 |
jaune-…vert |
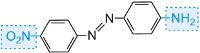 |
jaune |
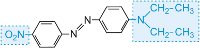 |
rouge |
 |
bleu |
 |
Tableau 3 Les structures moléculaires de quelques colorants azoïques montrant les auxochromes.
Certains colorants azoïques, ceux qui contiennent un groupe hydroxy en ortho (ou en para) du groupe azoïque, par exemple l’orange acide C.I. 7, présentent un tautomérisme, un processus dans lequel la molécule existe sous la forme de deux ou plusieurs structures différentes en équilibre. L’atome d’hydrogène du groupe hydroxyle est capable de migrer vers l’atome d’azote du groupe azoïque et vice versa :
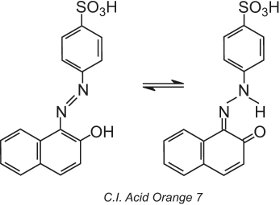
Ce type de tautomérie implique un équilibre entre un tautomère hydroxyazoïque et un tautomère cétohydrazone, bien que le tautomère cétohydrazone domine généralement et que la couleur observée soit de plus grande longueur d’onde (un décalage bathochrome).
(b) Colorants anthraquinoniques
Les colorants anthraquinoniques représentent environ 15% des colorants et ont des structures basées sur les quinones. La quinone la plus simple est la benzoquinone, qui a deux isomères :
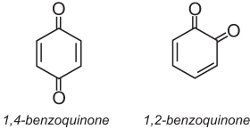
L’anthraquinone, la plus simple des anthraquinones, est basée sur l’anthracène :
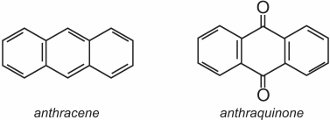
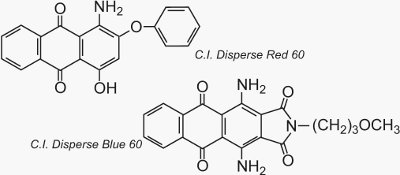
Deux exemples bien connus d’anthraquinones qui sont utilisées comme colorants sont C.I.. Disperse Red 60 et C.I. Disperse Blue 60:
(c) Phtalocyanines
Les phtalocyanines sont essentiellement constituées de quatre molécules d’isoindole:
Ces molécules sont reliées entre elles dans une phtalocyanine par des atomes d’azote. La structure de la phtalocyanine est:
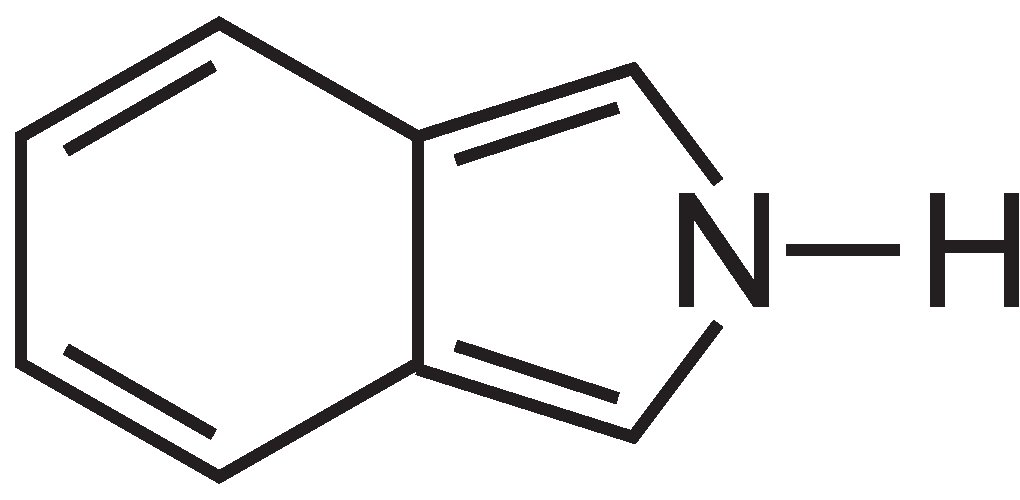
Ces molécules sont reliées entre elles dans une phtalocyanine par des atomes d’azote. La structure de la phtalocyanine est:
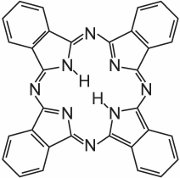
Les phtalocyanines se coordonnent avec les atomes métalliques. Les plus importantes, contribuant à environ 2% de tous les colorants, sont les phtalocyanines de cuivre, utilisées pour leurs couleurs bleues et vertes brillantes. Un exemple est C.I. Direct Blue 86:
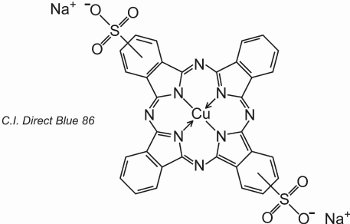
Les groupes d’acide sulfonique aident à la solubilité du colorant dans l’eau.
La formule indique que les groupes d’acide sulfonique peuvent être à différentes positions sur les cycles aromatiques.
Classification des colorants par les méthodes d’application
La classification par la méthode d’application est importante pour le teinturier textile qui applique le colorant pour produire la couleur requise. Pour obtenir la teinte requise, le teinturier doit généralement faire des mélanges de colorants et doit s’assurer que ceux-ci sont compatibles.
Les caractéristiques de base qui contrôlent le transfert du colorant de la solution à la fibre sont :
- le pH de la solution dans le bain de teinture (pour les colorants acides et basiques)
- un électrolyte (une solution de sulfate ou de chlorure de sodium)
- la température (dans la gamme de l’ambiante à 400 K)
- des produits chimiques, connus sous le nom d’agents dispersants, qui produisent une dispersion aqueuse stable de colorants de très faible solubilité
Le tableau 4 énumère les colorants sous leurs noms technologiques qui indiquent leur mode d’application, ainsi que les fibres sur lesquelles ils sont appliqués.
| Colorant | Fibre |
|---|---|
| Groupe 1 | |
| Acide | Laine et autres fibres protéiques, polyamides |
| Complexe métallique | Laine et autres fibres protéiques, polyamides |
| Direct | Coton, lin, viscose |
| Basique | Acrylique |
| Dispersé | Polyesters, polyamides, éthanoates |
| Groupe 2 | |
| Réactif | Coton, lin, viscose, laine, soie |
| TVA | Coton, lin, viscose |
| Soufre | Coton, lin |
Tableau 4 Classification technologique des colorants.
Colorants du groupe 1
Les colorants de ce groupe sont caractérisés par leur solubilité dans l’eau. Par conséquent, ils ne sont pas particulièrement rapides au lavage. La méthode d’application n’implique qu’un processus en une seule étape.
(i) Colorants acides
Les types chimiques importants sont l’azoïque, l’anthraquinone et la phtalocyanine, qui couvrent l’ensemble du spectre visible et donnent ainsi une gamme complète de couleurs. Ces colorants sont solubles dans l’eau et donnent des espèces anioniques. Ils sont généralement appliqués à environ 373 K. Alors que la laine et d’autres fibres protéiques se dégradent facilement au-dessus de cette température, les fibres polyamides (par exemple, les nylons) peuvent être traitées à 393 K sans qu’aucun dommage ne leur soit causé (tableau 4).
Le pH choisi pour la solution dans le bain de teinture dépend des propriétés individuelles des colorants. Les valeurs les plus basses sont obtenues en ajoutant de l’acide sulfurique et les valeurs les plus élevées en ajoutant des solutions d’acide éthanoïque et de sulfate d’ammonium ou d’éthanoate d’ammonium. Le sulfate de sodium peut être ajouté pour contrôler la diffusion des anions du colorant dans la structure de la fibre.
De par la nature même de la structure du colorant, des liaisons ioniques, des liaisons hydrogène et d’autres interactions intermoléculaires (tableau 2) se formeront entre le colorant et la fibre rendant ainsi les colorants rapides. Un exemple de colorant acide typique est le C.I. Acid Red 73:
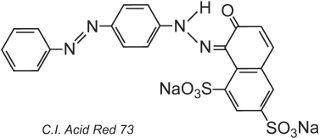
Un des groupes azoïques de ce tautomère est présent sous la forme cétohydrazone.
(ii) Colorants complexes métalliques
Les types chimiques sont azoïques et anthraquinoniques donnant une gamme complète de couleurs. Cependant, ils sont plus ternes que les colorants acides en raison de la présence dans la structure du colorant d’un atome de métal. Les sels de chrome sont souvent utilisés bien que les sels de cobalt et de nickel soient également favorisés.
L’atome de métal forme un complexe de coordination avec deux molécules d’un composé monoazoïque contenant des groupes hydroxyle, carboxyle ou amino en position 2,2′ par rapport au groupe azoïque. Ces composés sont appelés colorants « complexes métalliques 1:2 ». Un exemple est le C.I. Acid Violet 78:
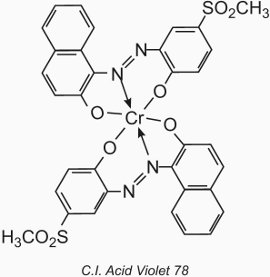
Leur application à la laine est similaire à celle des colorants acides, mais la valeur du pH est limitée à la gamme de 4,5 à 6,0 (tableau 4).
(iii) Colorants directs
Les colorants directs sont particulièrement utiles pour la teinture des fibres en cellulose (tableaux 1 et 4).
Ils sont synthétisés avec des groupes acide sulfonique pour leur conférer une solubilité dans l’eau, se dissociant pour donner des cations sodium et l’espèce colorante anionique. Ils sont également conçus de manière à ce que leur structure soit aussi linéaire et plane que possible. Cela permet au colorant de se fixer aux chaînes cellulosiques de la fibre, souvent par liaison intermoléculaire (y compris l’hydrogène).
Ils sont appliqués dans le bain de teinture en solution aqueuse qui contient du chlorure de sodium. Le sel réduit les forces électriques de répulsion entre la charge négative de la surface de la fibre et l’espèce de colorant anionique.
La plupart des colorants directs sont des composés azoïques, contenant souvent deux ou trois groupes azoïques. On peut citer par exemple le C.I. Direct Orange 25 qui possède des groupes -OH, -NHCO- et -N=N- qui ont tous le potentiel de former des liaisons hydrogène avec les groupes hydroxyle de la cellulose :
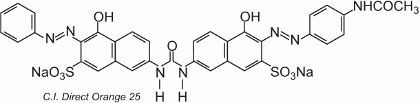
Le colorant présente un tautomérisme, car il y a deux groupes hydroxyle en ortho des groupes azoïques. Un des tautomères en équilibre avec cette forme est
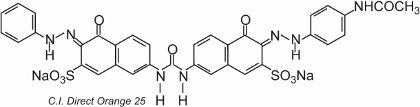
où il y a deux groupes cétohydrazone.
Un autre exemple, le C.I. Direct Blue 71, possède trois groupes azoïques, dont l’un est présent sous forme de tautomère cétohydrazone:
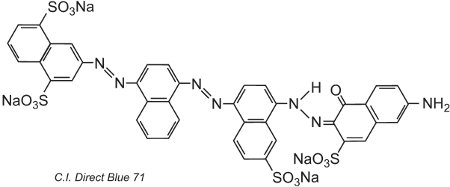
(iv) Colorants basiques
Les colorants basiques ont été parmi les premiers colorants synthétiques. En effet, la Mauveine est un colorant basique. Le chromophore est présent sous forme de cation et ils sont utilisés de nos jours pour la teinture des fibres acryliques (généralement un copolymère avec du propénonitrile (acrylonitrile) et une petite quantité d’un co-monomère qui contiennent des groupes sulfonate, -SO3-, et carboxylate, -CO2-,). Il s’agit d’interactions ion-ion (tableaux 2 et 4).
Il existe une centaine de colorants basiques (cationiques) dont les couleurs couvrent les rouges, les jaunes et les bleus, avec des nuances fortes et vives. Certains sont basés sur les systèmes chromophores azoïques et anthraquinoniques. Beaucoup sont également basés sur des ions arylcarbonium. On peut citer par exemple le C.I. Basic Green 4 (connu sous le nom de Malachite Green) et le C.I. Basic Red 9.
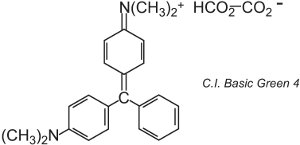 |
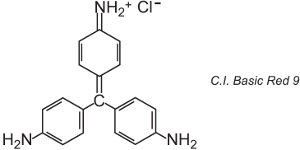 |
Ce sont tous deux des triarylméthanes, un groupe de colorants qui, avec des changements relativement faibles de structure, produisent une gamme de teintes rouges, vertes et violettes.
D’autres, dits colorants polyméthiniques (ils contiennent un ou plusieurs groupes -CH=) sont également utilisés. Ils doivent leur couleur à la présence d’un système conjugué. Un exemple d’un tel colorant est le C.I. Basic Yellow 28 qui est une diazacyanine:
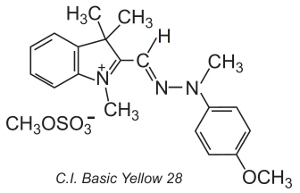
Les colorants sont souvent appliqués dans une solution d’un électrolyte, qui contrôle la vitesse de diffusion dans la structure de la fibre, à des températures d’environ 370 K.
(v) Colorants dispersés
Ces colorants sont essentiellement hydrophobes et sont presque insolubles dans l’eau. Cependant, ils ont une affinité pour les fibres hydrophobes, par exemple les polyesters, et sont appliqués sous forme de dispersions très fines dans l’eau (tableau 4).
La plupart des colorants dispersés sont des composés azoïques et peuvent donner des couleurs dans tout le spectre. Certains sont des colorants à base d’anthraquinone pour les rouges, les violets, les bleus et les verts.
Les fibres de polyester peuvent être teintes à 400 K sous pression, ce qui permet d’utiliser des structures de colorants de plus grande taille moléculaire qui permettent d’obtenir une meilleure solidité, par exemple :
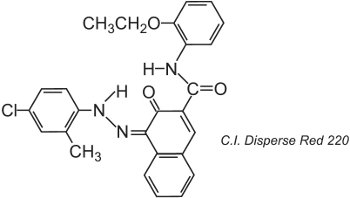
La structure représentée est le tautomère cétohydrazone.
Colorants du groupe 2
Bien que les colorants de ce groupe soient appliqués par un procédé en deux étapes (ce qui contraste avec le procédé en une seule étape pour les colorants du groupe 1), les colorants présentent des avantages, notamment en matière de solidité.
i) Colorants réactifs
Les colorants réactifs ont une importance exceptionnelle pour la teinture du coton, permettant une coloration intense et brillante avec une solidité élevée. Environ 95% des colorants réactifs sont des colorants azoïques couvrant toute la gamme des couleurs. Les bleus et les verts sont également fournis par les structures anthraquinone et phtalocyanine.
Comme leur nom l’indique, ces colorants réagissent avec la fibre, qu’elle soit cellulosique (coton) ou protéique (laine) pour former des liaisons covalentes (tableau 4). Les deux étapes, d’abord la teinture, puis la réaction, peuvent se dérouler séparément ou simultanément. Le trait structurel caractéristique est la présence d’un ou plusieurs groupes réactifs. Typiquement, les colorants sont représentés comme
D-B-RG
où D est le chromogène, B un groupe de pontage et RG le groupe réactif.
Les groupes réactifs les plus importants sont les triazines chlorées et les vinylsulfones.
L’un des trois isomères de la triazine la plus simple est:
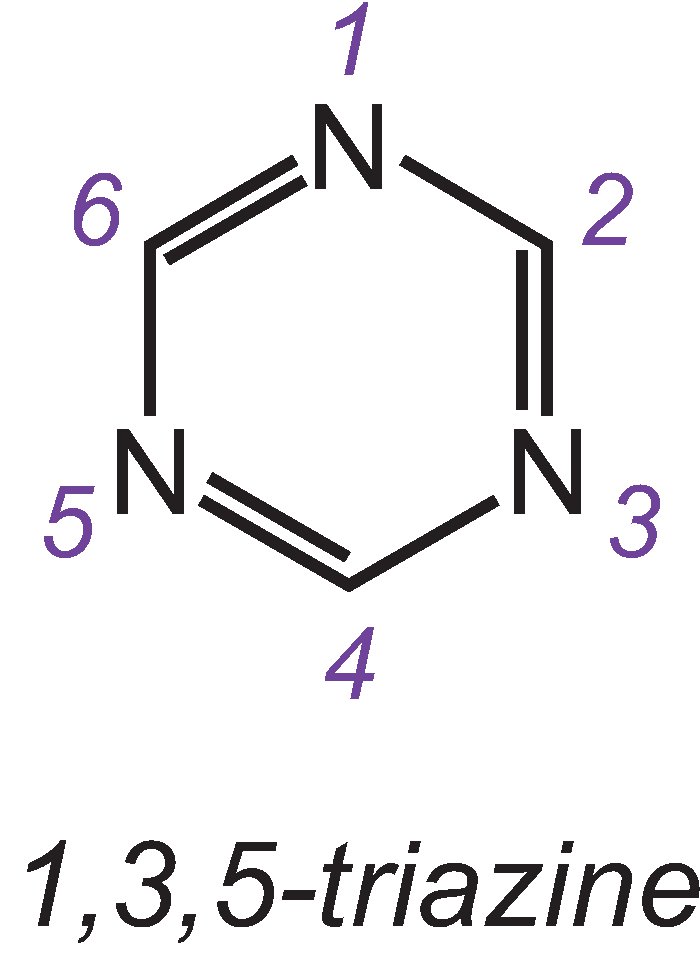
Un exemple de colorant avec un groupe dichlorotriazine est C.I. Bleu réactif 109:
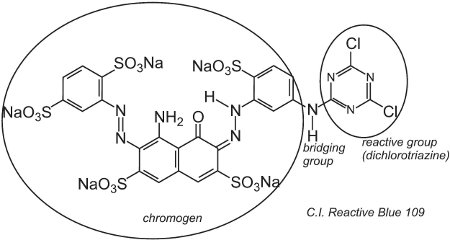
La réaction entre les groupes -OH de la cellulose dans la fibre et les groupes -C-Cl dans la chlorotriazine se fait par une réaction de substitution (nucléophile) pour former des liaisons covalentes.
Une éthényl (vinyl) sulfone contient le groupe CH2=CHSO2 et la plus simple est la diéthénylsulfone (divinylsulfone). Le groupe sulfone peut être vu dans le bleu réactif 19 de C.I.:
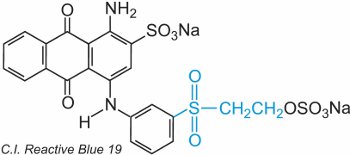
Dans cet exemple, il n’y a pas de groupe de pontage.
Le colorant réagit avec la cellulose par addition à la double liaison soufre-oxygène.
Les colorants réactifs, dans la solution aqueuse, peuvent subir une hydrolyse de la sulfone, la rendant non réactive à la cellulose. Cela signifie que le colorant qui n’a pas réagi, s’il n’est pas éliminé correctement par lavage, restera à la surface du tissu, donnant une couleur apparente qui s’effacera avec le temps. Pour réduire ce problème, des colorants ont été conçus avec deux groupes réactifs différents de réactivité différente. Ces colorants offrent une meilleure solidité car si l’un des groupes est hydrolysé en solution, l’autre réagit avec les groupes hydroxyles du tissu. Le premier d’entre eux comprenait à la fois un groupe chlorotriazine et un groupe vinylsulfone et un exemple est le C.I. Reactive Red 194:
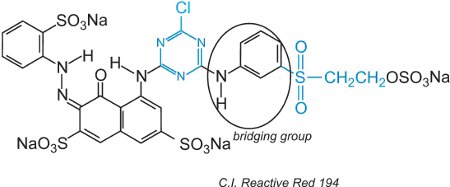
En plus des deux groupes réactifs différents, il y a un chromogène et un groupe de pontage.
Tous les colorants réactifs ont une taille moléculaire relativement petite et ils ont également deux ou plusieurs groupes acide sulfonique dans le chromogène, ce qui conduit à une solubilité élevée dans l’eau. Une partie des espèces de colorants (anioniques) ne réagit pas avec la fibre et est hydrolysée et le produit doit être éliminé par lavage.

Figure 3 Les jeans sont teints avec de l’indigo et une variété de colorants sulfurés, le choix dépendant de la couleur désirée.
Avec l’aimable autorisation de Lizzie Hubbard.
(ii) Colorants de cuve
Environ 80% des colorants de cuve appartiennent à la classe chimique des anthraquinones et couvrent toute la gamme des couleurs. Un type, les colorants indigoïdes, comprend l’indigo:
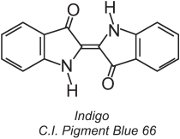
Tous les colorants de cuve sont insolubles dans l’eau. Pour les appliquer sur une fibre, par exemple le coton, on les place dans une solution alcaline (tableau 4). Le colorant insoluble est réduit pour former un anion incolore (leuco) qui est soluble et possède une affinité pour la fibre. Il est ensuite adsorbé par la fibre, parfois en présence de chlorure de sodium, dans des conditions similaires à celles des colorants directs. Après le processus de teinture, le colorant parent insoluble d’origine est régénéré à l’intérieur de la fibre par oxydation, généralement en utilisant une solution de peroxyde d’hydrogène ou simplement de l’air :
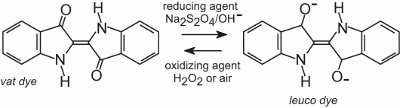
Les colorants sont insolubles dans la structure de la fibre et ont donc une bonne résistance au lavage et ils possèdent également une grande résistance à la lumière.
(iii) Colorants au soufre
Les colorants au soufre comme les colorants de cuve sont appliqués sur les textiles (cellulose, tableau 4) sous une forme anionique soluble et ensuite oxydés en forme insoluble.
Le noir de soufre C.I. 1 et le bleu de soufre C.I. 7 sont parmi les colorants au soufre les plus utilisés. Comme les autres colorants au soufre, leurs structures sont variables et largement inconnues. Ils fournissent une gamme de noirs, de bruns et de bleus ternes. Ils sont cependant beaucoup moins chers à produire que les colorants de cuve car leur préparation par chauffage de divers composés organiques avec du soufre, est simple.
Pigments
Les pigments sont utilisés dans la coloration des peintures, des encres d’imprimerie, des céramiques et des plastiques. Ils peuvent être utilisés sur une variété beaucoup plus grande de substances que les colorants car ils ne dépendent pas de la solubilité dans l’eau pour leur application. Un pigment est un solide finement divisé qui est essentiellement insoluble dans son milieu d’application. Dans la plupart des cas, le pigment est ajouté à un milieu liquide, par exemple une peinture humide ou un thermoplastique fondu. On laisse ensuite le milieu se solidifier par évaporation du solvant ou par refroidissement et ainsi les molécules de pigment se fixent mécaniquement à l’état solide.
Les chromophores utilisés dans les pigments sont généralement les mêmes que ceux utilisés dans les colorants mais les pigments sont de grosses molécules et ne possèdent pas de groupes solubilisants. Ils contiennent des groupes qui forment des liaisons intermoléculaires qui contribuent à réduire les solubilités. Plus la molécule est grande, plus le pigment est opaque.

| Figures 4 et 5 Les colorants rouges et jaunes sont des pigments azoïques (C.I. Pigment Red 57 et C.I. Pigment Yellow 13). Le bleu est le pigment phtalocyanine de cuivre. Avec l’aimable autorisation de BASF. |
 |
Les pigments organiques produisent généralement une intensité et un éclat de couleur plus élevés que les pigments inorganiques tels que le jaune de chrome (chromate(II) de plomb(VI)).
Les pigments organiques présentent une gamme de propriétés de solidité qui dépendent de la structure moléculaire et de la nature de l’association intramoléculaire à l’état solide. Une augmentation de la taille moléculaire d’un pigment diminue généralement la solubilité du pigment. De plus, de nombreux pigments ont le groupe amide (-NHCO-) incorporé, ce qui diminue encore sa solubilité car les molécules sont maintenues ensemble dans de grandes structures par la liaison hydrogène (entre le groupe N-H dans une molécule et un groupe C=O dans une autre).
De nombreux pigments organiques sont basés sur la chimie azoïque et dominent les zones de teintes jaunes, orange et rouges. Un exemple de pigment monoazoïque simple est le C.I. Pigment Yellow 1:
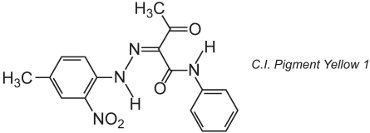
Cette forme est le tautomère cétohydrazone.
Les phtalocyanines de cuivre fournissent la majorité des pigments bleus et verts. Elles sont structurellement complexes mais leur fabrication est relativement peu coûteuse. Elles offrent une excellente résistance à la lumière, à la chaleur, aux acides et aux alcalis.
Un exemple est le C.I. Pigment Blue 15:
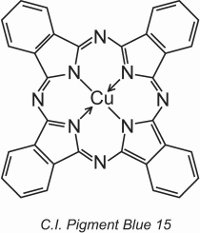
Auparavant, dans l’unité, la structure d’un colorant, le C.I. Direct Blue 86, a été affichée et on peut voir comment les groupes acide sulfonique de cette structure transforment un pigment en un colorant.
Colorants et pigments fonctionnels (de haute technologie)
Les colorants et pigments fonctionnels sont produits en petits volumes par rapport aux composés utilisés pour la teinture des textiles. Cependant, ils font l’objet de nombreuses recherches et d’un grand intérêt et sont en cours de développement à des fins diverses. Certains d’entre eux sont illustrés ci-dessous.
(a) Affichages à cristaux liquides
Les cristaux liquides jouent un rôle important dans notre vie depuis de nombreuses années sous diverses formes d’affichage d’informations, par exemple les calculatrices. Au départ, ils ne pouvaient afficher que les différences entre la lumière et l’obscurité. On a découvert qu’en utilisant des colorants, on pouvait augmenter ce contraste et produire des écrans colorés. Ils ont aujourd’hui largement remplacé les technologies d’affichage traditionnelles que sont les diodes électroluminescentes et les tubes cathodiques. Les colorants utilisés ont été spécifiquement conçus pour changer d’orientation avec les molécules de cristaux liquides et offrent donc une plus grande intensité de couleur. On dit que ces colorants présentent un dichroïsme.
(b) Colorants laser
Le terme laser est un acronyme désignant l’amplification de la lumière par émission stimulée de rayonnement.
Communément, des lasers inorganiques étaient utilisés mais ils n’avaient la capacité de produire un rayonnement qu’à quelques longueurs d’onde sélectionnées et dans des bandes très étroites. L’utilisation de colorants a permis de produire de la lumière dans tout le spectre, de 320 à 1200 nm de longueur d’onde. L’application des lasers à colorants comprend la technologie de la communication, et la microchirurgie.
(c) Impression par jet d’encre
L’impression par jet d’encre est une technique sans impact pour produire des images en dirigeant de petites gouttelettes d’encre, idéalement sous contrôle informatique, en succession rapide sur un substrat. Elle a trouvé de nombreuses applications. En raison de la taille requise des gouttelettes pour obtenir une bonne définition, l’utilisation de colorants a été préférée à celle de pigments. Les gouttelettes sont plus petites (les pigments ont tendance à bloquer les buses) et la solubilité aqueuse réduit l’impact environnemental et maintient le prix bas. Les premiers colorants étaient ceux déjà utilisés dans d’autres industries, mais ils se caractérisaient par une mauvaise résistance à l’eau. Cela a conduit au développement de colorants spécifiques et de systèmes fluides uniques. Ces colorants sont conçus pour être solubles dans des systèmes légèrement alcalins (pH 7,5 à 10) qui sont rendus insolubles par les conditions légèrement acides (pH 4,5 à 6,5) du papier ou d’un autre substrat. Cette technologie a un grand impact sur l’impression industrielle à haut volume pour les emballages, les textiles, les revêtements muraux et les affichages publicitaires.
(d) Thérapie photodynamique
C’est un traitement du cancer qui utilise une combinaison de lumière laser, d’un composé photosensibilisant (le colorant) et d’oxygène moléculaire. Le colorant est administré au patient par voie intraveineuse et, avec le temps, pénètre dans les cellules cancéreuses. L’irradiation des cellules avec la lumière laser peut commencer leur destruction.
Le laser interagit avec le colorant et le fait passer à son état excité. Grâce à un processus complexe, des molécules d’oxygène excitées (plus réactives) sont produites et réagissent avec les centres insaturés des protéines et des lipides de la membrane cellulaire. Cette méthode de traitement évite le recours à la chirurgie invasive.