結晶性固体のクラス
結晶物質は、その中の粒子の種類と粒子間で起こる化学結合の種類で説明することができます。 結晶には4つのタイプがある。 (1)イオン性、(2)金属性、(3)共有結合ネットワーク、(4)分子性の4種類です。 各タイプの性質といくつかの例を次の表に示し、説明する。
| 結晶性固体の種類 | 例(式) | 融点(℃) | |
|---|---|---|---|
| Ionic | (\ce{NaCl}) | 801 | 1413 |
| (\ce{CaF_2}) | 1418 | 1533 | |
| Metallic | (\ce{Hg}) | -> | 630 |
| (\ce{Na}) | 371 | 883 | |
| (\ce{Au}) | 1064 | 2856 | |
| (\ce{W}) | 3410 | 5660 | |
| Covalent Network | (\ce{B}) | 2076 | 3927 |
| (\ce{C}) (Diamond) | 3500 | 3930 | |
| (\ce{SiO_2}) | 1600 | 2230 | |
| Molecular | (\ce{H_2}) | -)259 | -253 |
| (\ce{I_2}) | 114 | 184 | |
| (\ce{NH_3}) | -78 | -> | |
| \(\ce{H_2O}) | 0 | 100 |
イオン結晶 – イオン結晶は正電荷のカチオン、負電荷のアニオンからなる交互構造(下図参照)です。 イオンは単原子または多原子のいずれかである。 一般にイオン結晶は、1族または2族の金属と16族または17族の非金属、あるいは非金属の多原子イオンの組み合わせで形成されています。 イオン結晶は硬くてもろく、融点が高いのが特徴です。 イオン性化合物は固体では電気を通さないが、溶けたり水溶液になると電気を通す
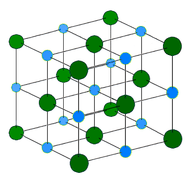
共有結合ネットワーク結晶 – 結晶の格子点に原子があり、各原子はその直近の原子と共有結合している(下図参照)。 共有結合したネットワークは3次元的であり、非常に多くの原子を含んでいる。 ネットワーク固体には、ダイヤモンド、石英、多くのメタロイド、遷移金属とメタロイドの酸化物などがある。 ネットワーク固体は、硬くてもろく、融点や沸点が非常に高い。 イオンではなく原子で構成されているため、どのような状態でも電気を通さない
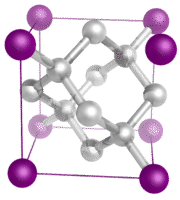
分子性結晶 – 分子性結晶は、通常、結晶の格子点にある分子が比較的弱い分子間力によって保持されています(下図参照)。 分子間力は、非極性結晶の場合は分散力、極性結晶の場合は双極子-双極子力であることがある。 氷のような分子性結晶には、水素結合で分子を結合しているものがある。 希ガスの一つを冷却固化した場合、格子点は分子ではなく個々の原子となる。 いずれの場合も、粒子を結合している分子間力は、イオン結合や共有結合よりもはるかに弱い。 その結果、分子性結晶の融点や沸点は非常に低くなる。 イオンや自由電子を持たない分子性結晶は、電気伝導性が悪い。 Ice crystal structure.
Some general properties of four major classes of solids summarize in Table \(\PageIndex{2}).
| イオン性固体 | 分子性固体 | 共有結合性固体 | 金属固体 |
|---|---|---|---|
| ※多くの例外も存在する。 例えば、グラファイトは炭素の平面内で比較的高い電気伝導度を持ち、ダイヤモンドは既知の物質の中で最も高い熱伝導度を持つ。 | |||
| 熱と電気の伝導性が悪い | 熱と電気の伝導性が悪い* | 熱と電気の伝導性が良い | |
| 比較的高い融点 | 低い融点 | 高い融点 | 融点は電子配置に強く依存 |
| 硬いが壊れやすい。 応力で粉々になる | 柔らかい | 非常に硬くて脆い | 応力で容易に変形する。 延性および可鍛性 |
| 比較的緻密 | 低密度 | 通常高密度 | |
| 鈍重なもの surface | dull surface | lustrous | |
Example \(\PageIndex{1})
Classify \(\ce{Ge}){Getty.com},
与えられたもの:化合物
求められたもの:融点の分類と順序
戦略:
- 周期表で構成元素の位置を確認します。 8807>
- 分類に基づいて融点の高い順に固体を並べ、分子性固体から始めます。
解答:
A. ゲルマニウムはSiのすぐ下のpブロックにあり、半金属元素の対角線上にあることから、元素のGeはSiと同じ構造(ダイヤモンド構造)である可能性が高いことがわかる。 RbIは1族の金属と17族の非金属を含むので、Rb+とI-のイオンを含むイオン性固体です。
化合物であるⒶは炭化水素(ヘキサメチルベンゼン)であり、孤立した分子が重なって分子固体を形成し、分子間に共有結合はない
Zn はdブロック元素なので金属固体
B. これらの物質を融点の高い順に並べるのは簡単ですが、1つの例外があります。 C6(CH3)6の融点が最も低く、Geの融点が最も高く、RbIはその中間にあると予想される。 しかし、金属の融点は、これまでのモデルからでは予測が難しい。 Znは価電子帯が埋まっているので、特に高い融点にはならないはずで、妥当な推測は
C6(CH3)6 < Zn ~ RbI < Geとなる。
実際の融点は C6(CH3)6, 166°C; Zn, 419°C; RbI, 642°C; Ge, 938°Cです。
問題
CO2, BaBr2, GaAs, AgZnをイオン性固体、共有性固体、分子性固体、金属性固体に分類し、融点の高い順に並べよ。
回答
CO2(分子)<AgZn(金属)~BaBr2(イオン)<GaAs(共有結合)
実際の融点は。 CO2:約-15.6℃、AgZn:約700℃、BaBr2:856℃、GaAs:1238℃です。