Klassen kristallijne vaste stoffen
Kristallijne stoffen kunnen worden beschreven aan de hand van de soorten deeltjes die ze bevatten en de soorten chemische bindingen die tussen de deeltjes plaatsvinden. Er zijn vier soorten kristallen: (1) ionisch, (2) metallisch, (3) covalent netwerk, en (4) moleculair. Eigenschappen en enkele voorbeelden van elk type zijn in de volgende tabel opgenomen.
| Type kristallijne vaste stof | Voorbeelden (formules) | Smeltpunt (°C) | Normaal kookpunt (°C) |
|---|---|---|---|
| Ionisch | (NaCl) | 801 | 1413 |
| (\ce{CaF_2}) | 1418 | 1533 | |
| Metallisch | (\ce{Hg}) | -39 | 630 |
| (\ce{Na}) | 371 | 883 | |
| (\ce{Au}) | 1064 | 2856 | |
| (\ce{W}) | 3410 | 5660 | |
| Covalent Netwerk | (\ce{B}) | 2076 | 3927 |
| (\ce{C}) (diamant) | 3500 | 3930 | |
| (SiO_2}) | 1600 | 2230 | |
| Moleculair | (SiO_2}) | -259 | -253 |
| (ççI_2}) | 114 | 184 | |
| (ççNH_3}) | -78 | -33 | |
| (\ce{H_2O}) | 0 | 100 |
Ionische kristallen – De ionische kristalstructuur bestaat uit afwisselend positief geladen kationen en negatief geladen anionen (zie onderstaande figuur). De ionen kunnen zowel mono-atomair als polyatomair zijn. In het algemeen vormen ionische kristallen zich uit een combinatie van metalen van groep 1 of 2 en niet-metalen van groep 16 of 17 of niet-metaalhoudende polyatome ionen. Ionische kristallen zijn hard en bros en hebben een hoog smeltpunt. Ionische verbindingen geleiden geen elektriciteit als vaste stof, maar wel als ze gesmolten of in waterige oplossing zijn.
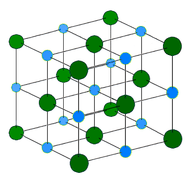
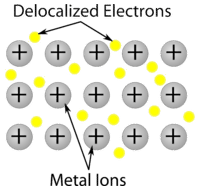
Covalente netwerkkristallen – Een covalent netwerkkristal bestaat uit atomen op de roosterpunten van het kristal, waarbij elk atoom covalent gebonden is aan zijn naaste buuratomen (zie onderstaande figuur). Het covalent gebonden netwerk is driedimensionaal en bevat een zeer groot aantal atomen. Netwerk vaste stoffen omvatten diamant, kwarts, vele metalloïden, en oxiden van overgangsmetalen en metalloïden. Netwerk vaste stoffen zijn hard en bros, met extreem hoge smelt- en kookpunten. Omdat ze zijn opgebouwd uit atomen in plaats van ionen, geleiden ze geen elektriciteit in welke toestand dan ook.
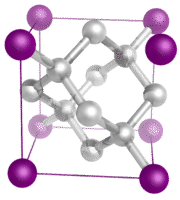
Moleculaire kristallen – Moleculaire kristallen bestaan meestal uit moleculen op de roosterpunten van het kristal, die bij elkaar worden gehouden door relatief zwakke intermoleculaire krachten (zie onderstaande figuur). De intermoleculaire krachten kunnen dispersiekrachten zijn in het geval van apolaire kristallen, of dipool-dipoolkrachten in het geval van polaire kristallen. Sommige moleculaire kristallen, zoals ijs, hebben moleculen die bijeen worden gehouden door waterstofbruggen. Wanneer een van de edelgassen wordt afgekoeld en gestold, bestaan de roosterpunten uit afzonderlijke atomen in plaats van moleculen. In alle gevallen zijn de intermoleculaire krachten die de deeltjes bijeenhouden veel zwakker dan de ionische of covalente bindingen. Als gevolg daarvan zijn het smelt- en kookpunt van moleculaire kristallen veel lager. Omdat ze geen ionen of vrije elektronen hebben, zijn moleculaire kristallen slechte elektrische geleiders.

Enkele algemene eigenschappen van de vier hoofdklassen van vaste stoffen zijn samengevat in Tabel: Eigenschappen van de belangrijkste klassen van vaste stoffen
Voorbeeld \(\PageIndex{1})
Klasseer \(\ce{Ge}\), \ce{RbI}\), \ce{C6(CH3)6}\), en \ce{Zn}\) als ionische, moleculaire, covalente of metallische vaste stof en rangschik ze in volgorde van toenemend smeltpunt.
Gegeven: verbindingen
Vraag: classificatie en volgorde van smeltpunten
Strategie:
- Localiseer het (de) samenstellende element(en) in het periodiek systeem. Voorspel op basis van hun positie of elke vaste stof ionisch, moleculair, covalent of metallisch is.
- Rangschik de vaste stoffen in volgorde van toenemend smeltpunt op basis van je classificatie, te beginnen met moleculaire vaste stoffen.
Oplossing:
A. Germanium ligt in het p-blok net onder Si, langs de diagonale lijn van halfmetalen elementen, wat suggereert dat elementair Ge waarschijnlijk dezelfde structuur heeft als Si (de diamantstructuur). Ge is dus waarschijnlijk een covalent vast lichaam.
RbI bevat een metaal uit groep 1 en een niet-metaal uit groep 17, dus is het een ionisch vast lichaam dat Rb+ en I- ionen bevat.
De verbinding hexamethylbenzeen is een koolwaterstof (hexamethylbenzeen), die bestaat uit geïsoleerde moleculen die zich stapelen tot een moleculaire vaste stof zonder covalente bindingen ertussen.
Zn is een d-blok element, dus het is een metallische vaste stof.
B. Het rangschikken van deze stoffen in volgorde van oplopend smeltpunt is rechttoe rechtaan, met één uitzondering. We verwachten dat C6(CH3)6 het laagste smeltpunt heeft en Ge het hoogste smeltpunt, met RbI daar ergens tussenin. De smeltpunten van metalen zijn echter moeilijk te voorspellen op basis van de tot nu toe gepresenteerde modellen. Omdat Zn een gevulde valentieschil heeft, zou het geen bijzonder hoog smeltpunt moeten hebben, dus een redelijke gok is
C6(CH3)6 < Zn ~ RbI < Ge.
De werkelijke smeltpunten zijn C6(CH3)6, 166°C; Zn, 419°C; RbI, 642°C; en Ge, 938°C. Dit komt overeen met onze voorspelling.
Oefening
Deel CO2, BaBr2, GaAs en AgZn in als ionische, covalente, moleculaire of metallische vaste stoffen en rangschik ze dan in volgorde van oplopend smeltpunt.
Antwoord
CO2 (moleculair) < AgZn (metallisch) ~ BaBr2 (ionisch) < GaAs (covalent).
De werkelijke smeltpunten zijn: CO2, ongeveer -15,6°C; AgZn, ongeveer 700°C; BaBr2, 856°C; en GaAs, 1238°C.