Classes de Sólidos Cristalinos
As substâncias cristalinas podem ser descritas pelos tipos de partículas nelas contidas e pelos tipos de ligação química que ocorrem entre as partículas. Existem quatro tipos de cristais: (1) iónico, (2) metálico, (3) rede covalente, e (4) molecular. As propriedades e vários exemplos de cada tipo estão listados na tabela a seguir e estão descritos na tabela abaixo.
| Tipo de Sólido Cristalino | Exemplos (fórmulas) | Ponto de fusão (°C) | Ponto de ebulição normal (°C) | |
|---|---|---|---|---|
| Iónico | \(\ce{NaCl}\) | 801 | 1413 | |
| (\ce{CaF_2}) | 1418 | 1533 | ||
| Metálico | (\ce{Hg}) | -39 | 630 | |
| \({Na}}) | 371 | 883 | ||
| ({Au}) | 1064 | 2856 | ||
| \(\ce{W}\) | 341063> | 5660 | ||
| Rede Cobalente | \(\ce{B}) | 2076 | 3927 | |
| (\ce{C}) (diamante) | 3500 | 3930 | ||
| (\ce{SiO_2}) | 1600 | 2230 | ||
| Molecular | (\ce{H_2}) | -259 | -253 | |
| \(\ce{I_2}\) | 114 | 184 | ||
| \(\ce{NH_3}) | -78 | -33 | ||
| (\ce{H_2O}\) | >0 | 100 |
Cristais iónicos – A estrutura de cristais iónicos consiste em alternar catiões com carga positiva e aniões com carga negativa (ver figura abaixo). Os íons podem ser monatômicos ou poliatômicos. Geralmente, os cristais iônicos se formam a partir de uma combinação de metais do Grupo 1 ou 2 e de ions poliatômicos não metálicos ou não metálicos do Grupo 16 ou 17. Os cristais iônicos são duros e quebradiços e têm altos pontos de fusão. Os compostos iônicos não conduzem eletricidade como sólidos, mas conduzem eletricidade quando fundidos ou em solução aquosa.
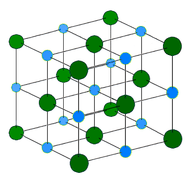
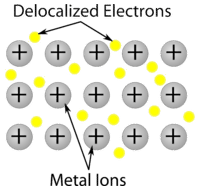
Cristal metálico – Cristais metálicos consistem em cátions metálicos rodeados por um “mar” de electrões de valência móveis (ver figura abaixo). Estes elétrons, também chamados de elétrons deslocalizados, não pertencem a nenhum átomo, mas são capazes de se mover através de todo o cristal. Como resultado, os metais são bons condutores de eletricidade. Como se vê na tabela acima, os pontos de fusão dos cristais metálicos abrangem uma vasta gama.
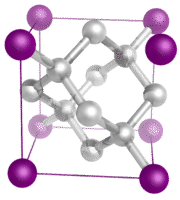
Cristais de rede covalentes – Um cristal de rede covalente consiste em átomos nos pontos de malha do cristal, sendo cada átomo ligado covalentemente aos átomos vizinhos mais próximos (ver figura abaixo). A rede covalentemente ligada é tridimensional e contém um número muito grande de átomos. Os sólidos da rede incluem diamante, quartzo, muitos metalóides e óxidos de metais de transição e metalóides. Os sólidos em rede são duros e quebradiços, com pontos de fusão e ebulição extremamente elevados. Sendo compostos de átomos e não de iões, não conduzem electricidade em qualquer estado.
Cristais moleculares – Os cristais moleculares consistem tipicamente de moléculas nos pontos de malha do cristal, mantidas juntas por forças intermoleculares relativamente fracas (ver figura abaixo). As forças intermoleculares podem ser forças de dispersão, no caso de cristais não polares, ou forças dipolo/dipolo, no caso de cristais polares. Alguns cristais moleculares, como o gelo, têm moléculas mantidas juntas por ligações de hidrogênio. Quando um dos gases nobres é resfriado e solidificado, os pontos da malha são átomos individuais e não moléculas. Em todos os casos, as forças intermoleculares que mantêm as partículas juntas são muito mais fracas do que as ligações iónicas ou covalentes. Como resultado, os pontos de fusão e ebulição dos cristais moleculares são muito mais baixos. Na ausência de íons ou elétrons livres, os cristais moleculares são maus condutores elétricos.

Somas propriedades gerais das quatro principais classes de sólidos estão resumidas na Tabela {2}(PageIndex{2}).
| Sólidos Iônicos | Sólidos Moleculares | Sólidos Covalentes | Sólidos Metálicos |
|---|---|---|---|
| *Existem muitas exceções. Por exemplo, a grafite tem uma condutividade elétrica relativamente alta dentro dos planos de carbono e o diamante tem a maior condutividade térmica de qualquer substância conhecida. | |||
| Pobres condutores de calor e electricidade | Pobres condutores de calor e electricidade | Pobres condutores de calor e electricidade* | Bom condutor de calor e electricidade |
| ponto de fusão relativamente alto | ponto de fusão baixo | ponto de fusão alto | pontos de fusão dependem fortemente da configuração dos electrões |
| difícil mas frágil; quebrar sob tensão | suave | muito duro e quebradiço | suavemente deformado sob tensão; dúctil e maleável |
| relativamente denso | baixa densidade | baixa densidade | usualmente alta densidade |
| baixa densidade superfície | -superfície fosca | -superfície fosca | lustrosa |
Exemplo \(\PageIndex{1}})
Classificar \(\ce{Ge}}), \como sólidos iónicos, moleculares, covalentes ou metálicos e organizá-los de forma a aumentar os pontos de fusão.
Dado: compostos
Passado por: classificação e ordem dos pontos de fusão
Estratégia:
- Localize o(s) elemento(s) componente(s) na tabela periódica. Com base em suas posições, prever se cada sólido é iônico, molecular, covalente ou metálico.
- Arrange os sólidos em ordem crescente de pontos de fusão com base em sua classificação, começando com sólidos moleculares.
Solução:
A. Germanium encontra-se no bloco p logo abaixo de Si, ao longo da linha diagonal de elementos semi-metálicos, o que sugere que Ge elementar é provável que tenha a mesma estrutura que Si (a estrutura diamantada). Assim, Ge é provavelmente um sólido covalente.
RbI contém um metal do grupo 1 e um não-metal do grupo 17, portanto é um sólido iônico contendo Rb+ e íons I-.
O composto \(\ce{C6(CH3)6}}) é um hidrocarboneto (hexametilbenzeno), que consiste em moléculas isoladas que se empilham para formar um sólido molecular sem ligações covalentes entre elas.
Zn é um elemento d-block, portanto é um sólido metálico.
B. A disposição destas substâncias em ordem de pontos de fusão crescentes é simples, com uma exceção. Esperamos que C6(CH3)6 tenha o ponto de fusão mais baixo e que Ge tenha o ponto de fusão mais alto, com RbI algures no meio. Os pontos de fusão dos metais, no entanto, são difíceis de prever com base nos modelos apresentados até agora. Como Zn tem uma casca de valência cheia, ele não deve ter um ponto de fusão particularmente alto, então um palpite razoável é
C6(CH3)6 < Zn ~ RbI < Ge.
Os pontos reais de fusão são C6(CH3)6, 166°C; Zn, 419°C; RbI, 642°C; e Ge, 938°C. Isto concorda com nossa previsão.
Exercício \(\PageIndex{1})
Classificar CO2, BaBr2, GaAs, e AgZn como sólidos iônicos, covalentes, moleculares, ou metálicos e então organizá-los em ordem crescente de pontos de fusão.
Resposta
CO2 (molecular) < AgZn (metálico) ~ BaBr2 (iónico) < GaAs (covalente).
Os verdadeiros pontos de fusão são: CO2, cerca de -15,6°C; AgZn, cerca de 700°C; BaBr2, 856°C; e GaAs, 1238°C.