A kristályos szilárd anyagok osztályai
A kristályos anyagokat a bennük lévő részecskék típusa és a részecskék között létrejövő kémiai kötések típusa alapján lehet leírni. Négyféle kristálytípust különböztetünk meg: (1) ionos, (2) fémes, (3) kovalens hálózatos és (4) molekuláris. Az egyes típusok tulajdonságait és néhány példát az alábbi táblázat tartalmazza.
| Kristályos szilárd anyag típusa | Példák (képletek) | olvadáspont (°C) | normális forráspont (°C) |
|---|---|---|---|
| Ionikus | \(\ce{NaCl}\) | 801 | 1413 |
| \(\ce{CaF_2}\) | 1418 | 1533 | |
| Metál | \(\ce{Hg}\) | -39 | 630 |
| \(\ce{Na}\) | 371 | 883 | |
| \(\ce{Au}\) | 1064 | 2856 | |
| \(\ce{W}\) | 3410 | 5660 | |
| Kovalens hálózat | \(\ce{B}\) | 2076 | 3927 |
| \(\ce{C}\) (gyémánt) | 3500 | 3930 | |
| \(\ce{SiO_2}\) | 1600 | 2230 | |
| Molekuláris | \(\ce{H_2}\) | -259 | -253 |
| \(\ce{I_2}\) | 114 | 184 | |
| \(\ce{NH_3}\) | -78 | -33 | |
| \(\ce{H_2O}\) | 0 | 100 |
Ionikus kristályok – Az ionos kristályszerkezet pozitív töltésű kationok és negatív töltésű anionok váltakozásából áll (lásd az alábbi ábrát). Az ionok lehetnek egyatomosak vagy többatomosak. Általában az ionos kristályok az 1. vagy 2. csoportba tartozó fémek és a 16. vagy 17. csoportba tartozó nemfémek vagy nemfém többatomos ionok kombinációjából alakulnak ki. Az ionos kristályok kemények és törékenyek, és magas olvadáspontjuk van. Az ionos vegyületek szilárd testként nem vezetik az elektromosságot, de olvadt állapotban vagy vizes oldatban igen.
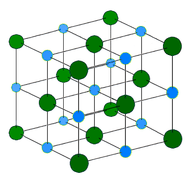
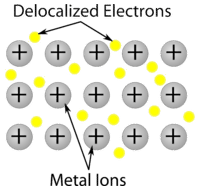
Fémkristály – A fémkristályok fémkationokból állnak, amelyeket mozgó valenciaelektronok “tengere” vesz körül (lásd az alábbi ábrát). Ezek az elektronok, amelyeket delokalizált elektronoknak is neveznek, nem tartoznak egyetlen atomhoz sem, hanem képesek az egész kristályon keresztül mozogni. Ennek eredményeként a fémek jól vezetik az elektromosságot. Amint a fenti táblázatban látható, a fémkristályok olvadáspontjai széles skálán mozognak.
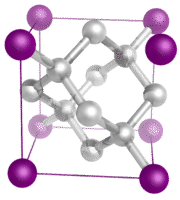
Kovalens hálózati kristályok – A kovalens hálózati kristály a kristály rácspontjain lévő atomokból áll, és minden atom kovalensen kötődik a legközelebbi szomszédos atomjaihoz (lásd az alábbi ábrát). A kovalens kötésű hálózat háromdimenziós, és nagyon sok atomot tartalmaz. A hálózatos szilárd testek közé tartozik a gyémánt, a kvarc, számos metalloid, valamint az átmeneti fémek és metalloidok oxidjai. A hálózati szilárd anyagok kemények és ridegek, rendkívül magas olvadási és forrásponttal rendelkeznek. Mivel nem ionokból, hanem atomokból állnak, semmilyen állapotban nem vezetik az elektromosságot.
Molekuláris kristályok – A molekuláris kristályok jellemzően a kristály rácspontjain elhelyezkedő molekulákból állnak, amelyeket viszonylag gyenge molekulák közötti erők tartanak össze (lásd az alábbi ábrát). A molekulák közötti erők lehetnek diszperziós erők a nem poláris kristályok esetében, vagy dipólus-dipólus erők a poláris kristályok esetében. Egyes molekulakristályokban, például a jégben, a molekulákat hidrogénkötések tartják össze. Ha valamelyik nemesgázt lehűtjük és megszilárdítjuk, a rácspontok nem molekulák, hanem egyes atomok. A részecskéket összetartó molekulák közötti erők minden esetben sokkal gyengébbek, mint az ionos vagy kovalens kötések. Ennek eredményeként a molekuláris kristályok olvadási és forráspontja sokkal alacsonyabb. Ionok és szabad elektronok hiányában a molekulakristályok rossz elektromos vezetők.

A szilárd anyagok négy fő osztályának néhány általános tulajdonságát a \(\PageIndex{2}\) táblázat foglalja össze.
| Ionikus szilárd anyagok | Molekuláris szilárd anyagok | Kovalens szilárd anyagok | Metál szilárd anyagok |
|---|---|---|---|
| *Sok kivétel létezik. Például a grafitnak viszonylag nagy az elektromos vezetőképessége a szénsíkokon belül, és a gyémántnak van a legnagyobb hővezető képessége minden ismert anyag közül. | |||
| rossz hő- és elektromosság-vezetők | rossz hő- és elektromosság-vezetők | rossz hő- és elektromosság-vezetők* | jó hő- és elektromosság-vezetők |
| viszonylag magas olvadáspont | alacsony olvadáspont | magas olvadáspont | az olvadáspontok erősen függnek az elektronkonfigurációtól |
| kemény, de rideg; feszültség hatására törik | lágy | nagyon kemény és rideg | könnyen deformálódik feszültség hatására; képlékeny és képlékeny |
| viszonylag sűrű | alacsony sűrűségű | alacsony sűrűségű | általában nagy sűrűségű |
| tompa. felszín | tompa felszín | tompa felszín | tompa felszín |
Példa \(\PageIndex{1}\)
Classify \(\ce{Ge}\), \(\ce{RbI}\), \(\ce{C6(CH3)6}\) és \(\ce{Zn}\) mint ionos, molekuláris, kovalens vagy fémes szilárd testeket, és rendezze őket az olvadáspontok növekvő sorrendjében.
Adott: vegyületek
Kérdés: osztályozás és az olvadáspontok sorrendje
Stratégia:
- Helyezze meg az alkotóelem(ek)et a periódusos rendszerben. Helyzetük alapján jósolja meg, hogy az egyes szilárd anyagok ionos, molekuláris, kovalens vagy fémesek-e.
- Rendezze a szilárd anyagokat az osztályozása alapján növekvő olvadáspontok sorrendjébe, kezdve a molekuláris szilárd anyagokkal.
Megoldás:
A. A germánium a p blokkban, közvetlenül a Si alatt, a fémes elemek átlós vonala mentén helyezkedik el, ami arra utal, hogy az elemi Ge valószínűleg ugyanolyan szerkezetű, mint a Si (a gyémántszerkezet). Így a Ge valószínűleg kovalens szilárd anyag.
A RbI egy fémet tartalmaz az 1. csoportból és egy nemfémet a 17. csoportból, tehát Rb+ és I- ionokat tartalmazó ionos szilárd anyag.
Az \(\ce{C6(CH3)6}\) vegyület egy szénhidrogén (hexametilbenzol), amely izolált molekulákból áll, amelyek egymásra rakódva molekuláris szilárd anyagot alkotnak, és nincs köztük kovalens kötés.
A Zn egy d-blokk elem, tehát fémes szilárd anyag.
B. Ezeknek az anyagoknak a növekvő olvadáspontok szerinti sorrendbe állítása egy kivétellel egyszerű. Azt várjuk, hogy a C6(CH3)6 olvadáspontja a legalacsonyabb, a Ge olvadáspontja a legmagasabb, az RbI pedig valahol a kettő között van. A fémek olvadáspontját azonban nehéz megjósolni az eddig bemutatott modellek alapján. Mivel a Zn töltött valenciahéjjal rendelkezik, nem lehet különösebben magas az olvadáspontja, így egy ésszerű becslés szerint
C6(CH3)6 < Zn ~ RbI < Ge.
A tényleges olvadáspontok a következők: C6(CH3)6, 166°C; Zn, 419°C; RbI, 642°C; és Ge, 938°C. Ez megegyezik az előrejelzésünkkel.
Feladat \(\PageIndex{1}\)
Rendezze a CO2, BaBr2, GaAs és AgZn szilárd anyagokat ionos, kovalens, molekuláris vagy fémes szilárd testekké, majd rendezze őket az olvadáspontok növekvő sorrendjébe.
Válasz
CO2 (molekuláris) < AgZn (fémes) ~ BaBr2 (ionos) < GaAs (kovalens).
A tényleges olvadáspontok a következők: CO2, kb. -15,6 °C; AgZn, kb. 700 °C; BaBr2, 856 °C; és GaAs, 1238 °C.