Třídy krystalických pevných látek
Krystalické látky lze popsat podle typů částic, které se v nich nacházejí, a typů chemických vazeb, které mezi částicemi probíhají. Existují čtyři typy krystalů: (1) iontové, (2) kovové, (3) kovalentní síťové a (4) molekulární. Vlastnosti a několik příkladů jednotlivých typů jsou uvedeny v následující tabulce a jsou popsány v následující tabulce.
| Typ krystalické pevné látky | Příklady (vzorce) | Teplota tání (°C) | Normální teplota varu (°C) |
|---|---|---|---|
| Iontové | \(\ce{NaCl}\) | 801 | 1413 |
| \(\ce{CaF_2}\) | 1418 | 1533 | |
| Metalický | \(\ce{Hg}\) | -39 | 630 |
| \(\ce{Na}\) | 371 | 883 | |
| \(\ce{Au}\) | 1064 | 2856 | |
| \(\ce{W}\) | 3410 | 5660 | |
| Kovalentní síť | \(\ce{B}\) | 2076 | 3927 |
| \(\ce{C}\) (diamant) | 3500 | 3930 | |
| \(\ce{SiO_2}\) | 1600 | 2230 | |
| Molekulární | \(\ce{H_2}\) | -259 | -253 |
| \(\ce{I_2}\) | 114 | 184 | |
| \(\ce{NH_3}\) | -78 | -33 | |
| \(\ce{H_2O}\) | 0 | 100 |
Iontové krystaly – Iontová krystalová struktura se skládá ze střídajících se kladně nabitých kationtů a záporně nabitých aniontů (viz obrázek níže). Ionty mohou být buď jednoatomové, nebo víceatomové. Obecně jsou iontové krystaly tvořeny kombinací kovů skupiny 1 nebo 2 a nekovů skupiny 16 nebo 17 nebo nekovových polyatomických iontů. Iontové krystaly jsou tvrdé a křehké a mají vysoké teploty tání. Iontové sloučeniny nevedou elektřinu jako pevné látky, ale vedou elektřinu, když jsou roztavené nebo ve vodném roztoku.
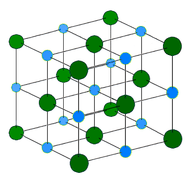
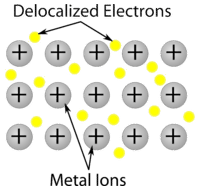
Kovový krystal – Kovové krystaly se skládají z kationtů kovů obklopených „mořem“ pohyblivých valenčních elektronů (viz obrázek níže). Tyto elektrony, označované také jako delokalizované elektrony, nepatří žádnému atomu, ale mohou se pohybovat po celém krystalu. Díky tomu jsou kovy dobrými vodiči elektřiny. Jak je vidět z výše uvedené tabulky, teploty tání kovových krystalů se pohybují v širokém rozmezí.
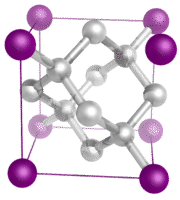
Kovalentní síťové krystaly – Kovalentní síťový krystal se skládá z atomů v bodech mřížky krystalu, přičemž každý atom je kovalentně vázán s nejbližšími sousedními atomy (viz obrázek níže). Kovalentně vázaná síť je trojrozměrná a obsahuje velmi velký počet atomů. Mezi síťové pevné látky patří diamant, křemen, mnoho metaloidů a oxidů přechodných kovů a metaloidů. Síťové pevné látky jsou tvrdé a křehké a mají extrémně vysoké teploty tání a varu. Protože se skládají spíše z atomů než z iontů, nevedou elektřinu v žádném stavu.
Molekulární krystaly – Molekulární krystaly se obvykle skládají z molekul v bodech mřížky krystalu, které drží pohromadě relativně slabé mezimolekulární síly (viz obrázek níže). Mezimolekulární síly mohou být disperzními silami v případě nepolárních krystalů nebo dipólově-dipólovými silami v případě polárních krystalů. Některé molekulární krystaly, například led, mají molekuly držené pohromadě vodíkovými vazbami. Při ochlazení a ztuhnutí některého ze vzácných plynů jsou mřížkovými body spíše jednotlivé atomy než molekuly. Ve všech případech jsou mezimolekulární síly držící částice pohromadě mnohem slabší než iontové nebo kovalentní vazby. V důsledku toho jsou teploty tání a varu molekulárních krystalů mnohem nižší. Protože molekulární krystaly postrádají ionty nebo volné elektrony, jsou špatnými elektrickými vodiči.

Některé obecné vlastnosti čtyř hlavních tříd pevných látek jsou shrnuty v tabulce \(\PageIndex{2}\).
| Iontové pevné látky | Molekulární pevné látky | Kovalentní pevné látky | Kovové pevné látky |
|---|---|---|---|
| *Existuje mnoho výjimek. Například grafit má v rámci uhlíkových rovin poměrně vysokou elektrickou vodivost a diamant má nejvyšší tepelnou vodivost ze všech známých látek. | |||
| špatné vodiče tepla a elektřiny | špatné vodiče tepla a elektřiny | špatné vodiče tepla a elektřiny* | dobré vodiče tepla a elektřiny |
| relativně vysoká teplota tání | nízká teplota tání | vysoká teplota tání | teploty tání silně závisí na elektronové konfiguraci |
| tvrdé, ale křehké; při namáhání se tříští | měkké | velmi tvrdé a křehké | snadno se při namáhání deformují; tvárný a kujný |
| relativně hutný | malá hustota | malá hustota | obvykle velká hustota |
| tupý povrch | tupý povrch | tupý povrch | hustý |
Příklad \(\PageIndex{1}\)
Klasifikace \(\ce{Ge}\), \(\ce{RbI}\), \(\ce{C6(CH3)6}\) a \(\ce{Zn}\) jako iontové, molekulární, kovalentní nebo kovové pevné látky a seřaďte je podle rostoucí teploty tání.
Dáno: sloučeniny
Zadáno: klasifikace a pořadí podle teploty tání
Strategie:
- Najděte v periodické tabulce prvek (prvky). Na základě jejich umístění předpovězte, zda je každá pevná látka iontová, molekulová, kovalentní nebo kovová.
- Uspořádejte pevné látky podle rostoucích teplot tání na základě své klasifikace, počínaje molekulovými pevnými látkami.
Řešení:
A. Germanium leží v bloku p hned pod Si, podél diagonální linie polokovových prvků, což naznačuje, že elementární Ge má pravděpodobně stejnou strukturu jako Si (diamantová struktura). Ge je tedy pravděpodobně kovalentní pevná látka.
RbI obsahuje kov ze skupiny 1 a nekov ze skupiny 17, takže je to iontová pevná látka obsahující ionty Rb+ a I-.
Sloučenina \(\ce{C6(CH3)6}\) je uhlovodík (hexamethylbenzen), který se skládá z izolovaných molekul, které se skládají do molekulární pevné látky bez kovalentních vazeb mezi nimi.
Zn je d-blokový prvek, takže je to kovová pevná látka.
B. Uspořádání těchto látek v pořadí podle rostoucí teploty tání je jednoduché, s jednou výjimkou. Očekáváme, že C6(CH3)6 bude mít nejnižší teplotu tání a Ge nejvyšší teplotu tání, přičemž RbI bude někde mezi nimi. Teploty tání kovů je však na základě dosud představených modelů obtížné předpovědět. Protože Zn má zaplněnou valenční slupku, neměl by mít zvlášť vysoký bod tání, takže rozumný odhad je
C6(CH3)6 < Zn ~ RbI < Ge.
Skutečné teploty tání jsou: C6(CH3)6, 166 °C; Zn, 419 °C; RbI, 642 °C; a Ge, 938 °C. To souhlasí s naší předpovědí.
Cvičení \(\PageIndex{1}\)
Zatřiďte CO2, BaBr2, GaAs a AgZn jako iontové, kovalentní, molekulární nebo kovové pevné látky a pak je seřaďte podle rostoucích teplot tání.
Odpověď
CO2 (molekulární) < AgZn (kovový) ~ BaBr2 (iontový) < GaAs (kovalentní).
Skutečné teploty tání jsou následující: CO2, přibližně -15,6 °C; AgZn, přibližně 700 °C; BaBr2, 856 °C a GaAs, 1238 °C.
.