Kiteisen kiinteän aineen luokat
Kiteiset aineet voidaan kuvata niiden sisältämien hiukkasten tyyppien ja hiukkasten välillä tapahtuvien kemiallisten sidosten tyyppien perusteella. Kiteitä on neljää eri tyyppiä: (1) ionisia, (2) metallisia, (3) kovalenttisia verkostoja ja (4) molekyylisiä. Ominaisuudet ja useita esimerkkejä kustakin tyypistä on lueteltu seuraavassa taulukossa.
| Kiteisen kiinteän aineen tyyppi | Esimerkkejä (kaavat) | Sulamispiste (°C) | Normaali kiehumispiste (°C) |
|---|---|---|---|
| Ioninen | \(\ce{NaCl}\) | 801 | 1413 |
| \(\ce{CaF_2}\) | 1418 | 1533 | |
| metallinen | \(\ce{Hg}\) | -39 | 630 |
| \(\ce{Na}\) | 371 | 883 | |
| \(\ce{Au}\) | 1064 | 2856 | |
| \(\ce{W}\) | 3410 | 5660 | |
| kovalenttinen verkosto | \(\ce{B}\) | 2076 | 3927 |
| \(\ce{C}\) (timantti) | 3500 | 3930 | |
| \(\ce{SiO_2}\) | 1600 | 2230 | |
| Molekulaarinen | \(\ce{H_2}\) | -259 | -253 |
| \(\ce{I_2}\) | 114 | 184 | |
| \(\ce{NH_3}\) | -78 | -33 | |
| \(\ce{H_2O}\) | 0 | 100 |
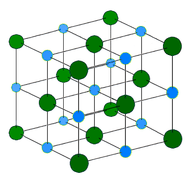
Ioniset kiteet – Ioninen kiderakenne koostuu vuorotellen positiivisesti varautuneista kationeista ja negatiivisesti varautuneista anioneista (ks. alla oleva kuva). Ionit voivat olla joko yksi- tai moniatomisia. Yleensä ionikiteet muodostuvat ryhmän 1 tai 2 metallien ja ryhmän 16 tai 17 epämetallien tai epämetallien polyatomisten ionien yhdistelmästä. Ionikiteet ovat kovia ja hauraita ja niillä on korkea sulamispiste. Ioniyhdisteet eivät johda sähköä kiinteinä aineina, mutta johtavat sähköä sulana tai vesiliuoksessa.
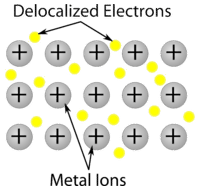
Metallikide – Metallikiteet koostuvat metallikationeista, joita ympäröi liikkuvien valenssielektronien ”meri” (ks. kuva alla). Nämä elektronit, joita kutsutaan myös delokalisoiduiksi elektroneiksi, eivät kuulu mihinkään yksittäiseen atomiin, vaan ne pystyvät liikkumaan koko kiteen läpi. Tämän vuoksi metallit ovat hyviä sähkönjohtimia. Kuten yllä olevasta taulukosta nähdään, metallikiteiden sulamispisteet ulottuvat laajalle.
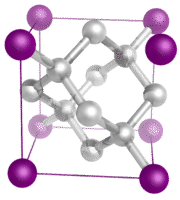
Kovalenttiset verkkokiteet – Kovalenttinen verkkokide koostuu kiteen ristikkopisteissä olevista atomeista, joista kukin atomi on kovalenttisesti sitoutunut lähimpään naapuriatomiinsa (ks. kuva alla). Kovalenttisesti sitoutunut verkosto on kolmiulotteinen ja sisältää hyvin suuren määrän atomeja. Verkostomaisia kiinteitä aineita ovat timantti, kvartsi, monet metalloidit sekä siirtymämetallien ja metalloidien oksidit. Verkostomaiset kiinteät aineet ovat kovia ja hauraita, ja niillä on erittäin korkeat sulamis- ja kiehumispisteet. Koska ne koostuvat pikemminkin atomeista kuin ioneista, ne eivät johda sähköä missään tilassa.
Molekyylikiteet – Molekyylikiteet koostuvat tyypillisesti kiteen ristikkopisteissä olevista molekyyleistä, joita suhteellisen heikot molekyylien väliset voimat pitävät yhdessä (ks. kuva alla). Molekyylien väliset voimat voivat olla dispersiovoimia, kun kyseessä ovat poolittomat kiteet, tai dipoli-dipolivoimia, kun kyseessä ovat pooliset kiteet. Joissakin molekyylikiteissä, kuten jäässä, molekyylejä pitävät yhdessä vetysidokset. Kun jokin jalokaasu jäähdytetään ja jähmettyy, ristikkopisteet ovat pikemminkin yksittäisiä atomeja kuin molekyylejä. Kaikissa tapauksissa hiukkasia yhdessä pitävät molekyylien väliset voimat ovat paljon heikompia kuin ionisidokset tai kovalenttiset sidokset. Tämän seurauksena molekyylikiteiden sulamis- ja kiehumispisteet ovat paljon alhaisemmat. Ilman ioneja tai vapaita elektroneja molekyylikiteet ovat huonoja sähkönjohtimia.

Taulukossa \(\PageIndex{2}\) on esitetty yhteenveto neljän suuren kiinteän aineen luokan yleisistä ominaisuuksista.
| Ioniset kiinteät aineet | Molekyyliset kiinteät aineet | Kovalenttiset kiinteät aineet | Metalliset kiinteät aineet | |
|---|---|---|---|---|
| *Monia poikkeuksia on. Esimerkiksi grafiitilla on suhteellisen korkea sähkönjohtavuus hiilitasojen sisällä, ja timantilla on tunnetuista aineista korkein lämmönjohtavuus. | ||||
| huonoja lämmön- ja sähkönjohtimia | huonoja lämmön- ja sähkönjohtimia | huonoja lämmön- ja sähkönjohtimia* | hyviä lämmön- ja sähkönjohtimia | |
| suhteellisen korkea sulamispiste | matala sulamispiste | korkea sulamispiste | sulamispisteet riippuvat voimakkaasti elektronikonfiguraatiosta | |
| kovia mutta hauraita; särkyvät rasituksessa | pehmeät | erittäin kovat ja hauraat | muodostuvat helposti rasituksessa; sitkeä ja muokattava | |
| suhteellisen tiheä | matala tiheys | matala tiheys | tavallisesti suuri tiheys | |
| tylsä pinta | tyhjä pinta | tyhjä pinta | tyhjä pinta | luja |
Esimerkki \(\PageIndex{1}\)
Luokittele \(\ce{Ge}\), \(\ce{RbI}\), \(\ce{C6(CH3)6}\) ja \(\ce{Zn}\) ionisiksi, molekyylisiksi, kovalenttisiksi tai metallisiksi kiinteiksi aineiksi ja järjestä ne sulamispisteiden mukaisessa järjestyksessä.
Annettu: yhdisteet
Kysytty: luokittelu ja sulamispisteiden järjestys
Strategia:
- Löydä osatekijä(t) jaksollisesta järjestelmästä. Arvioi niiden sijainnin perusteella, onko kukin kiinteä aine ioninen, molekyylinen, kovalenttinen vai metallinen.
- Järjestä kiinteät aineet lisääntyvien sulamispisteiden mukaiseen järjestykseen luokittelusi perusteella, alkaen molekyylisistä kiinteistä aineista.
Ratkaisu:
A. Germanium sijaitsee p-lohkossa heti Si:n alapuolella, puolimetallisten alkuaineiden vinoviivalla, mikä viittaa siihen, että alkuaine Ge:llä on todennäköisesti sama rakenne kuin Si:llä (timanttirakenne). Ge on siis todennäköisesti kovalenttinen kiinteä aine.
RbI sisältää metallin ryhmästä 1 ja epämetallin ryhmästä 17, joten se on ioninen kiinteä aine, joka sisältää Rb+- ja I-ioneja.
Yhdiste \(\ce{C6(CH3)6}\) on hiilivety (heksametyylibentseeni), joka koostuu eristetyistä molekyyleistä, jotka pinoutuvat muodostaen molekyylisen kiinteän aineen ilman kovalenttisia sidoksia keskenään.
Zn on d-lohkon alkuaine, joten se on metallinen kiinteä aine.
B. Näiden aineiden järjestäminen sulamispisteiden nousujärjestykseen on suoraviivaista yhtä poikkeusta lukuun ottamatta. Odotamme, että C6(CH3)6:lla on alhaisin sulamispiste ja Ge:llä korkein sulamispiste, RbI:n ollessa jossain välissä. Metallien sulamispisteitä on kuitenkin vaikea ennustaa tähän mennessä esitettyjen mallien perusteella. Koska Zn:llä on täysi valenssikuori, sillä ei pitäisi olla erityisen korkeaa sulamispistettä, joten kohtuullinen arvaus on
C6(CH3)6 < Zn ~ RbI < Ge.
Todelliset sulamispisteet ovat C6(CH3)6, 166°C; Zn, 419°C; RbI, 642°C; ja Ge, 938°C. Tämä vastaa ennustettamme.
Harjoitus \(\PageIndex{1}\)
Luokittele CO2, BaBr2, GaAs ja AgZn ionisiksi, kovalenttisiksi, molekyylisiksi tai metallisiksi kiinteiksi aineiksi ja järjestä ne sitten sulamispisteiden mukaisessa järjestyksessä.
Vastaus
CO2 (molekyylinen) < AgZn (metallinen) ~ BaBr2 (ioninen) < GaAs (kovalenttinen).
Todelliset sulamispisteet ovat: CO2, noin -15,6°C; AgZn, noin 700°C; BaBr2, 856°C; ja GaAs, 1238°C.