Classes de solides cristallins
Les substances cristallines peuvent être décrites par les types de particules qui les composent et les types de liaisons chimiques qui ont lieu entre les particules. Il existe quatre types de cristaux : (1) ionique, (2) métallique, (3) réseau covalent, et (4) moléculaire. Les propriétés et plusieurs exemples de chaque type sont énumérés dans le tableau suivant et sont décrits dans le tableau ci-dessous.
| Type de solide cristallin | Exemples (formules) | Point de fusion (°C) | Point d’ébullition normal (°C) |
|---|---|---|---|
| Ioniques | \(\ce{NaCl}\) | 801 | 1413 |
| \(\ce{CaF_2}\) | 1418 | 1533 | |
| Métallique | \(\ce{Hg}\) | -39 | 630 |
| \(\ce{Na}\) | 371 | 883 | |
| \(\ce{Au}\) | 1064 | 2856 | |
| \(\ce{W}\) | 3410 | 5660 | |
| Réseau covalent | \(\ce{B}\) | 2076 | 3927 |
| \(\ce{C}\) (diamant) | 3500 | 3930 | |
| \(\ce{SiO_2}\) | 1600 | 2230 | |
| Moléculaire | \(\ce{H_2}\) | -259 | -253 |
| \(\ce{I_2}\) | 114 | 184 | |
| \(\ce{NH_3}\) | -78 | -33 | |
| \(\ce{H_2O}\) | 0 | 100 |
Cristaux ioniques – La structure cristalline ionique consiste en une alternance de cations chargés positivement et d’anions chargés négativement (voir figure ci-dessous). Les ions peuvent être soit monatomiques, soit polyatomiques. En général, les cristaux ioniques se forment à partir d’une combinaison de métaux du groupe 1 ou 2 et de non-métaux du groupe 16 ou 17 ou d’ions polyatomiques non métalliques. Les cristaux ioniques sont durs et cassants et ont un point de fusion élevé. Les composés ioniques ne sont pas conducteurs d’électricité à l’état solide, mais le sont lorsqu’ils sont fondus ou en solution aqueuse.
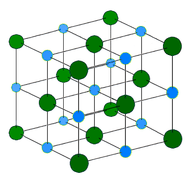
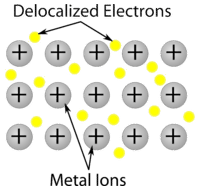
Cristal métallique – Les cristaux métalliques sont constitués de cations métalliques entourés d’une « mer » d’électrons de valence mobiles (voir figure ci-dessous). Ces électrons, également appelés électrons délocalisés, n’appartiennent pas à un seul atome, mais sont capables de se déplacer dans tout le cristal. Par conséquent, les métaux sont de bons conducteurs d’électricité. Comme le montre le tableau ci-dessus, les points de fusion des cristaux métalliques couvrent une large gamme.
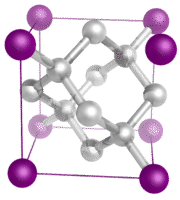
Cristaux à réseau covalent – Un cristal à réseau covalent est constitué d’atomes aux points de réseau du cristal, chaque atome étant lié de manière covalente à ses atomes voisins les plus proches (voir figure ci-dessous). Le réseau de liaisons covalentes est tridimensionnel et contient un très grand nombre d’atomes. Les solides en réseau comprennent le diamant, le quartz, de nombreux métalloïdes et des oxydes de métaux de transition et de métalloïdes. Les solides en réseau sont durs et cassants, avec des points de fusion et d’ébullition extrêmement élevés. Étant composés d’atomes plutôt que d’ions, ils ne conduisent l’électricité dans aucun état.
Cristaux moléculaires – Les cristaux moléculaires sont généralement constitués de molécules aux points du réseau du cristal, maintenues ensemble par des forces intermoléculaires relativement faibles (voir la figure ci-dessous). Les forces intermoléculaires peuvent être des forces de dispersion dans le cas des cristaux non polaires, ou des forces dipôle-dipôle dans le cas des cristaux polaires. Certains cristaux moléculaires, comme la glace, ont des molécules maintenues ensemble par des liaisons hydrogène. Lorsqu’un des gaz rares est refroidi et solidifié, les points du réseau sont des atomes individuels plutôt que des molécules. Dans tous les cas, les forces intermoléculaires qui maintiennent les particules ensemble sont beaucoup plus faibles que les liaisons ioniques ou covalentes. Par conséquent, les points de fusion et d’ébullition des cristaux moléculaires sont beaucoup plus bas. Dépourvus d’ions ou d’électrons libres, les cristaux moléculaires sont de mauvais conducteurs électriques.

Certaines propriétés générales des quatre principales classes de solides sont résumées dans le tableau \(\PageIndex{2}\).
| Solides ioniques | Solides moléculaires | Solides covalents | Solides métalliques |
|---|---|---|---|
| *De nombreuses exceptions existent. Par exemple, le graphite a une conductivité électrique relativement élevée dans les plans de carbone, et le diamant a la plus haute conductivité thermique de toutes les substances connues. | |||
| mauvais conducteurs de chaleur et d’électricité | mauvais conducteurs de chaleur et d’électricité | mauvais conducteurs de chaleur et d’électricité* | bon conducteurs de chaleur et d’électricité |
| point de fusion relativement élevé | point de fusion bas | point de fusion élevé | les points de fusion dépendent fortement de la configuration électronique |
| dur mais cassant ; se brisent sous la contrainte | molles | très dures et cassantes | facilement déformables sous la contrainte ; ductile et malléable |
| relativement dense | faible densité | faible densité | habituellement haute densité |
| mate. surface | surface terne | surface terne | lustrous |
Exemple \(\PageIndex{1}\)
Classification \(\ce{Ge}\), \(\ce{RbI}\), \(\ce{C6(CH3)6}\), et \(\ce{Zn}\) en tant que solides ioniques, moléculaires, covalents, ou métalliques et les classer par ordre croissant de points de fusion.
Donné : composés
Demande : classement et ordre des points de fusion
Stratégie :
- Localiser le ou les éléments constitutifs dans le tableau périodique. En fonction de leurs positions, prédisez si chaque solide est ionique, moléculaire, covalent ou métallique.
- Rangez les solides par ordre croissant de points de fusion en fonction de votre classification, en commençant par les solides moléculaires.
Solution:
A. Le germanium se trouve dans le bloc p juste sous Si, le long de la ligne diagonale des éléments semi-métalliques, ce qui suggère que le Ge élémentaire est susceptible d’avoir la même structure que Si (la structure du diamant). Ainsi, Ge est probablement un solide covalent.
RbI contient un métal du groupe 1 et un non-métal du groupe 17, c’est donc un solide ionique contenant des ions Rb+ et I-.
Le composé \(\ce{C6(CH3)6}\) est un hydrocarbure (hexaméthylbenzène), qui consiste en des molécules isolées qui s’empilent pour former un solide moléculaire sans liaison covalente entre elles.
Zn est un élément du bloc d, c’est donc un solide métallique.
B. Le classement de ces substances dans l’ordre croissant des points de fusion est simple, à une exception près. Nous nous attendons à ce que C6(CH3)6 ait le point de fusion le plus bas et que Ge ait le point de fusion le plus élevé, avec RbI quelque part entre les deux. Les points de fusion des métaux sont toutefois difficiles à prévoir sur la base des modèles présentés jusqu’à présent. Parce que Zn a une coquille de valence remplie, il ne devrait pas avoir un point de fusion particulièrement élevé, donc une estimation raisonnable est
C6(CH3)6 < Zn ~ RbI < Ge.
Les points de fusion réels sont C6(CH3)6, 166°C ; Zn, 419°C ; RbI, 642°C ; et Ge, 938°C. Cela correspond à notre prédiction.
Exercice \(\PageIndex{1}\)
Classez le CO2, le BaBr2, le GaAs et l’AgZn comme des solides ioniques, covalents, moléculaires ou métalliques, puis classez-les par ordre croissant de points de fusion.
Réponse
CO2 (moléculaire) < AgZn (métallique) ~ BaBr2 (ionique) < GaAs (covalent).
Les points de fusion réels sont : CO2, environ -15,6°C ; AgZn, environ 700°C ; BaBr2, 856°C ; et GaAs, 1238°C.
.