Obiective de învățare
- Explicați de ce punctele de fierbere ale alcoolilor sunt mai ridicate decât cele ale eterilor și alcanilor cu mase molare similare.
- Explicați de ce alcoolii și eterii cu patru sau mai puțini atomi de carbon sunt solubili în apă, în timp ce alcanii comparabili nu sunt solubili.
Alcoolii pot fi considerați derivați ai apei (H2O; se mai scrie și HOH).

Ca și legătura H-O-H din apă, legătura R-O-H este curbată, iar moleculele de alcool sunt polare. Această relație este deosebit de evidentă în cazul moleculelor mici și se reflectă în proprietățile fizice și chimice ale alcoolilor cu masă molară mică. Înlocuirea unui atom de hidrogen dintr-un alcan cu o grupare OH permite moleculelor să se asocieze prin intermediul legăturii de hidrogen (Figura \(\PageIndex{1}\)).
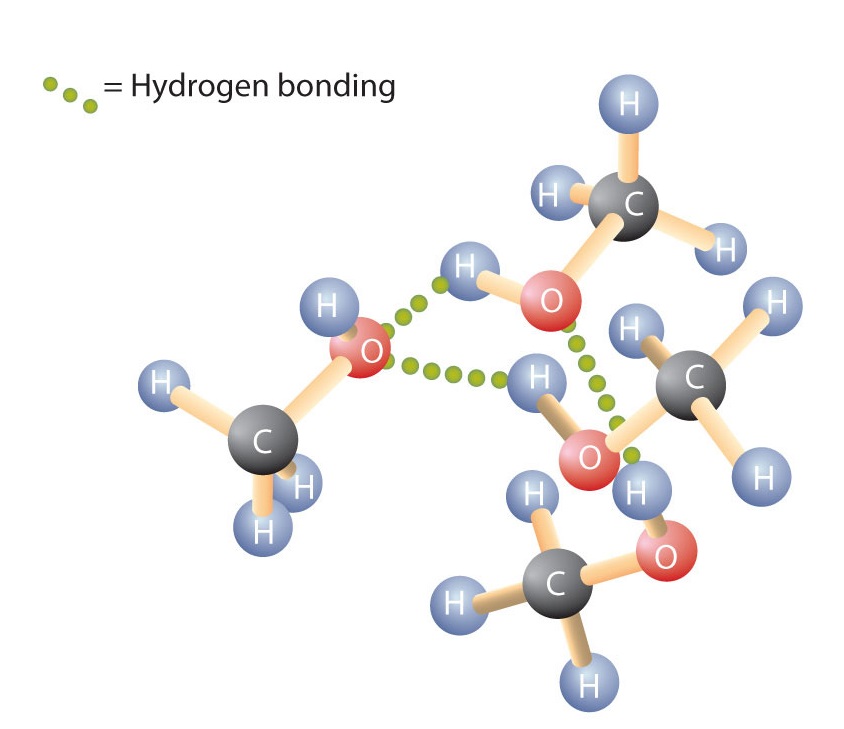
Reamintim că proprietățile fizice sunt determinate în mare măsură de tipul de forțe intermoleculare. Tabelul \(\PageIndex{1}\) enumeră masele molare și punctele de fierbere ale unor compuși obișnuiți. Tabelul arată că substanțe cu mase molare similare pot avea puncte de fierbere destul de diferite.
| Formula | Numele | Masa molară | Punctul de fierbere (°C) |
|---|---|---|---|
| CH4 | metan | 16 | -164 |
| HOH | apă | 18 | 100 |
| C2H6 | etan | 30 | -89 |
| CH3OH | metanol | 32 | 65 |
| C3H8 | propan | 44 | -42 |
| CH3CH2OH | etanol | 46 | 78 |
| C4H10 | butan | 58 | -1 |
| CH3CH2CH2OH | 1-propanol | 60 | 97 |
Alcanii sunt nepolari și, prin urmare, sunt asociați doar prin forțe de dispersie relativ slabe. Alcanii cu unul până la patru atomi de carbon sunt gaze la temperatura camerei. În schimb, chiar și metanolul (cu un atom de carbon) este un lichid la temperatura camerei. Legătura de hidrogen crește foarte mult punctele de fierbere ale alcoolilor în comparație cu cele ale hidrocarburilor de masă molară comparabilă. Punctul de fierbere este o măsură aproximativă a cantității de energie necesară pentru a separa o moleculă lichidă de cele mai apropiate vecine ale sale. Dacă moleculele interacționează prin legături de hidrogen, trebuie furnizată o cantitate relativ mare de energie pentru a rupe aceste atracții intermoleculare. Numai atunci molecula poate scăpa din lichid în stare gazoasă.
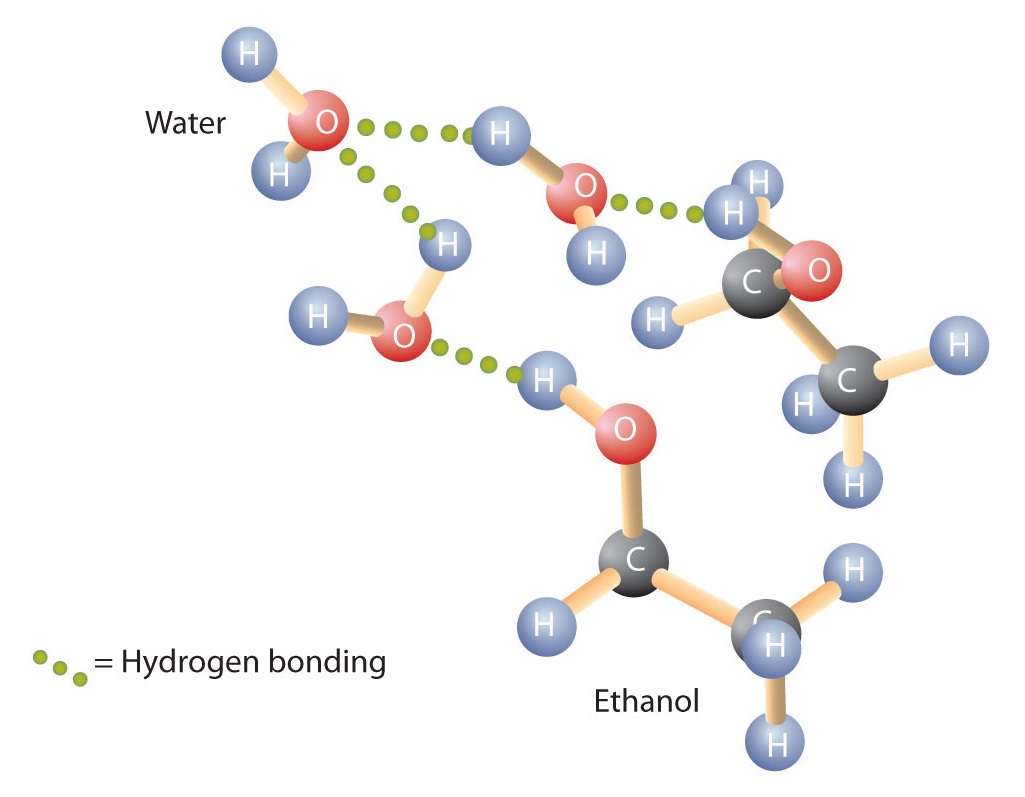
Alcoolii pot, de asemenea, să se angajeze în legături de hidrogen cu moleculele de apă (Figura \(\PageIndex{2}\)). Astfel, în timp ce hidrocarburile sunt insolubile în apă, alcoolii cu unul până la trei atomi de carbon sunt complet solubili. Cu toate acestea, pe măsură ce lungimea lanțului crește, solubilitatea alcoolilor în apă scade; moleculele devin mai asemănătoare cu hidrocarburile și mai puțin cu apa. Alcoolul 1-decanol (CH3CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2CH2OH) este în esență insolubil în apă. Constatăm frecvent că limita de solubilitate într-o familie de compuși organici apare la patru sau cinci atomi de carbon.
Rezumat
Alcoolii au puncte de fierbere mai ridicate decât eterii și alcanii cu mase molare similare deoarece gruparea OH permite moleculelor de alcool să se angajeze în legături de hidrogen. Alcoolii cu patru sau mai puțini atomi de carbon sunt solubili în apă deoarece moleculele de alcool se angajează în legături de hidrogen cu moleculele de apă; moleculele de alcani comparabili nu se pot angaja în legături de hidrogen.
Exerciții de recapitulare a noțiunilor
-
De ce este etanolul mai solubil în apă decât 1-hexanolul?
-
De ce are 1-butanolul un punct de fierbere mai mic decât 1-hexanolul?
Răspunsuri
-
Etanolul are o grupare OH și doar 2 atomi de carbon; 1-hexanolul are o grupare OH pentru 6 atomi de carbon și, prin urmare, seamănă mai mult cu o hidrocarbură (nepolară) decât este etanolul.
-
Masa molară a 1-hexanolului este mai mare decât cea a 1-butanolului.
Exerciții
Răspundeți la următoarele exerciții fără a consulta tabelele din text.
-
Aranjați acești alcooli în ordinea creșterii punctului de fierbere: etanol, metanol și 1-propanol.
-
Care are punctul de fierbere mai mare – butanul sau 1-propanolul?
-
Aranjați acești alcooli în ordinea crescătoare a solubilității în apă: 1-butanol, metanol și 1-octanol.
Aranjați acești compuși în ordinea crescătoare a solubilității în apă: 1-butanol, etanol și pentan.
Răspunsuri
-
metanol < etanol < < 1-propanol
-
1-octanol < 1-butanol < metanol
.