Obiective de învățare
- Să cunoască relația dintre tăria unui acid sau a unei baze și mărimea lui \(K_a\), \(K_b\), \(pK_a\) și \(pK_b\).
- Înțelegerea efectului de nivelare.
Mărimea constantei de echilibru pentru o reacție de ionizare poate fi utilizată pentru a determina tăria relativă a acizilor și bazelor. De exemplu, ecuația generală pentru ionizarea unui acid slab în apă, unde HA este acidul părinte și A- este baza conjugată a acestuia, este următoarea:
\
Constanta de echilibru pentru această disociere este următoarea:
\}{} \label{16.5.2}\]
După cum am observat mai devreme, concentrația de apă este în esență constantă pentru toate reacțiile în soluție apoasă, astfel încât \(\) din ecuația \(\ref{16.5.2}\) poate fi încorporată într-o nouă mărime, constanta de ionizare a acidului (\(K_a\)), numită și constanta de disociere a acidului:
\=\dfrac{}{} \label{16.5.3}}]
Așa, valorile numerice ale lui K și \(K_a\) diferă prin concentrația de apă (55,3 M). Din nou, pentru simplificare, \(H_3O^+\) poate fi scris ca \(H^+\) în ecuația \(\ref{16.5.3}\). Rețineți, totuși, că \(H^+\) liber nu există în soluțiile apoase și că un proton este transferat la \(H_2O\) în toate reacțiile de ionizare a acizilor pentru a forma ioni de hidroniu, \(H_3O^+\). Cu cât \(K_a\) este mai mare, cu atât mai puternic este acidul și cu atât mai mare este concentrația de \(H^+\) la echilibru. Ca toate constantele de echilibru, constantele de ionizare acido-bazice se măsoară, de fapt, în termeni de activități ale \(H^+\) sau \(OH^-\), ceea ce le face să fie lipsite de unități. Valorile lui \(K_a\) pentru o serie de acizi obișnuiți sunt prezentate în tabelul \(\PageIndex{1}\).
Bazele slabe reacționează cu apa pentru a produce ionul hidroxid, așa cum se arată în următoarea ecuație generală, unde B este baza mamă și BH+ este acidul conjugat al acesteia:
\
Constanta de echilibru pentru această reacție este constanta de ionizare a bazei (Kb), numită și constanta de disociere a bazei:
\= \frac{}{} \label{16.5.5}\}]
Încă o dată, concentrația de apă este constantă, deci nu apare în expresia constantei de echilibru; în schimb, este inclusă în \(K_b\). Cu cât \(K_b\) este mai mare, cu atât baza este mai puternică și concentrația \(OH^-\) la echilibru este mai mare. Valorile lui \(K_b\) pentru un număr de baze slabe comune sunt prezentate în tabelul \(\(\PageIndex{2}\).
Există o relație simplă între mărimea lui \(K_a\) pentru un acid și \(K_b\) pentru baza conjugată a acestuia. Să considerăm, de exemplu, ionizarea acidului cianhidric (\(HCN\)) în apă pentru a produce o soluție acidă și reacția \(CN^-\) cu apa pentru a produce o soluție bazică:
\
\
Expresia constantei de echilibru pentru ionizarea HCN este următoarea:
\}{}}. \label{16.5.8}\}]
Expresia corespunzătoare pentru reacția cianurii cu apa este următoarea:
\}{} \label{16.5.9}\]
Dacă adăugăm ecuațiile \(\ref{16.5.6}\) și \(\ref{16.5.6}\) și \(\ref{16.5.7}\\), obținem următoarele:
| Reacția | Constantele de echilibru |
|---|---|
| \(\cancel{HCN_{(aq)}}}. \rightleftharpoons H^+_{(aq)}+\cancel{CN^-_{(aq)}} \) | \(K_a=\cancel{}/\cancel{}\) |
| \(\cancel{CN^-_{(aq)}}+H_2O_{(l)} \rightleftharpoons OH^-_{(aq)}+\cancel{HCN_{(aq)}}\) | \(K_b=\cancel{}/\cancel{}\}) |
| \(H_2O_{(l)} \rightleftharpoons H^+_{(aq)}+OH^-_{(aq)}\) | \(K=K_a \times K_b=\) |
În acest caz, suma reacțiilor descrise de \(K_a\) și \(K_b\) este ecuația de autoionizare a apei, iar produsul celor două constante de echilibru este \(K_w\):
\
Astfel, dacă cunoaștem fie \(K_a\) pentru un acid, fie \(K_b\) pentru baza conjugată a acestuia, putem calcula cealaltă constantă de echilibru pentru orice pereche acid-bază conjugată.
Ca și în cazul \(pH\), \(pOH\) și pKw, putem folosi logaritmi negativi pentru a evita notația exponențială în scrierea constantelor de ionizare a acizilor și bazelor, definind \(pK_a\) după cum urmează:
\
\
și \(pK_b\) ca
\
\
Similar, ecuația \(\ref{16.5.10}}\), care exprimă relația dintre \(K_a\) și \(K_b\), poate fi scrisă în formă logaritmică după cum urmează:
\
La 25 °C, aceasta devine
\
Valorile lui \(pK_a\) și \(pK_b\) sunt date pentru mai mulți acizi și baze comune în tabelele \(\PageIndex{1}\) și \(\PageIndex{2}\), respectiv, iar un set mai extins de date este furnizat în tabelele E1 și E2. Datorită utilizării logaritmilor negativi, valorile mai mici ale \(pK_a\) corespund unor constante de ionizare a acizilor mai mari și, prin urmare, unor acizi mai puternici. De exemplu, acidul azotic [\(HNO_2\)], cu o valoare \(pK_a\) de 3,25, este un acid de aproximativ un milion de ori mai puternic decât acidul cianhidric (HCN), cu o valoare \(pK_a\) de 9,21. În schimb, valorile mai mici ale \(pK_b\) corespund unor constante de ionizare a bazelor mai mari și, prin urmare, unor baze mai puternice.
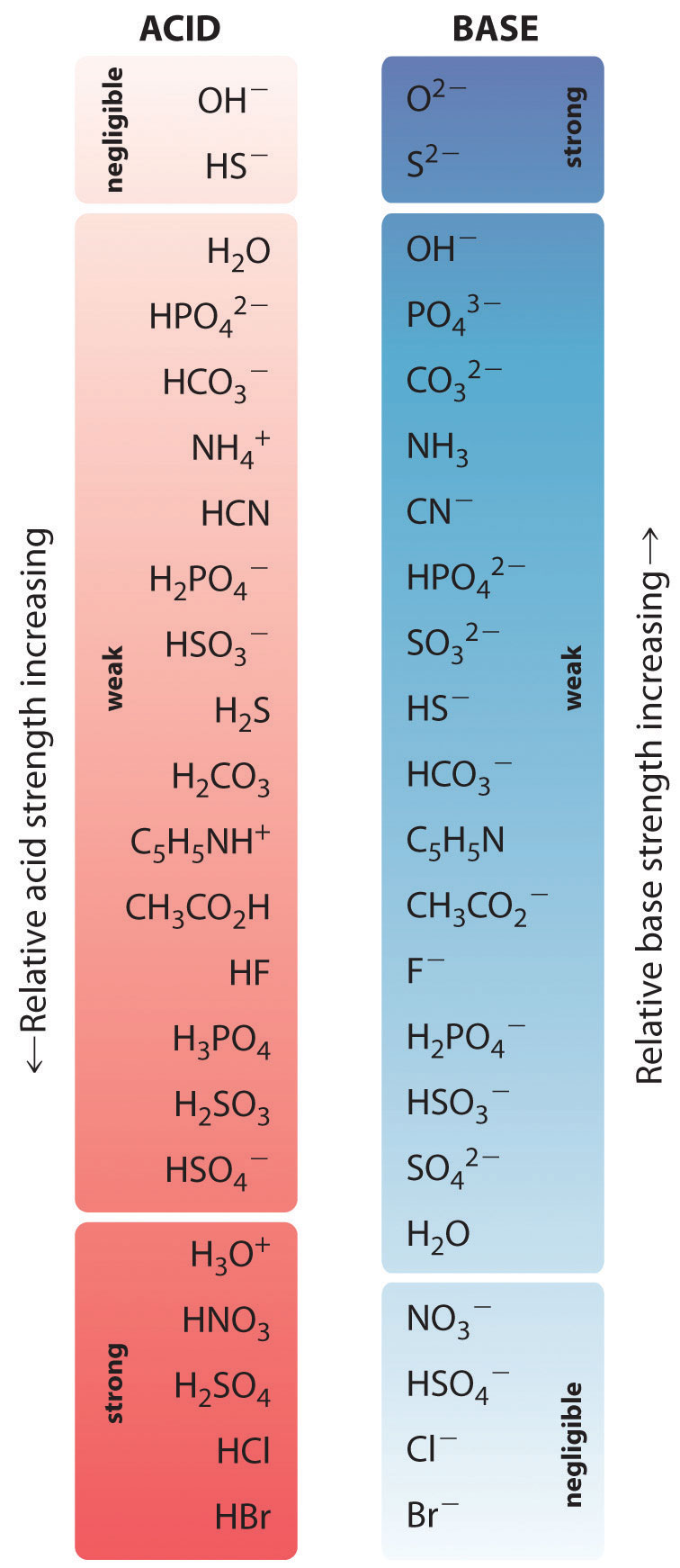
Puterea relativă a unor acizi comuni și a bazelor conjugate ale acestora este prezentată grafic în figura \(\PageIndex{1}\). Perechile de acizi-baze conjugate sunt enumerate în ordinea (de sus în jos) a creșterii tăriei acizilor, care corespunde unor valori descrescătoare ale \(pK_a\). Această ordine corespunde puterii descrescătoare a bazei conjugate sau valorilor crescătoare ale \(pK_b\). În stânga jos a figurii \(\PageIndex{2}\) se află acizii puternici comuni; în dreapta sus se află cele mai comune baze puternice. Observați relația inversă dintre forța acidului părinte și forța bazei conjugate. Astfel, baza conjugată a unui acid puternic este o bază foarte slabă, iar baza conjugată a unui acid foarte slab este o bază puternică.
Baza conjugată a unui acid puternic este o bază slabă și viceversa.
Ne putem folosi de puterile relative ale acizilor și bazelor pentru a prezice direcția unei reacții acido-bazice, urmând o singură regulă: un echilibru acido-bazic favorizează întotdeauna partea cu acidul și baza mai slabe, așa cum indică aceste săgeți:
\
Într-o reacție acido-bazică, protonul reacționează întotdeauna cu baza mai puternică.
De exemplu, acidul clorhidric este un acid puternic care se ionizează în mod esențial complet în soluție apoasă diluată pentru a produce \(H_3O^+\) și \(Cl^-\); doar cantități neglijabile de molecule de \(HCl\) rămân nedisociate. Prin urmare, echilibrul de ionizare se află practic complet spre dreapta, așa cum este reprezentat de o singură săgeată:
\
În schimb, acidul acetic este un acid slab, iar apa este o bază slabă. În consecință, soluțiile apoase de acid acetic conțin în cea mai mare parte molecule de acid acetic în echilibru cu o concentrație mică de ioni de \(H_3O^+\) și de acetat, iar echilibrul de ionizare se află mult spre stânga, așa cum este reprezentat de aceste săgeți:
\
În mod similar, în reacția amoniacului cu apa, ionul hidroxid este o bază puternică, iar amoniacul este o bază slabă, în timp ce ionul de amoniu este un acid mai puternic decât apa. Prin urmare, și acest echilibru se află la stânga:
\
Toate echilibrele acido-bazice favorizează partea cu acidul și baza mai slabe. Astfel, protonul este legat de baza mai puternică.
Exemplu \(\PageIndex{1}\): Ionii de butirat și dimetilamoniu
- Calculați \(K_b\) și \(pK_b\) ale ionului butirat (\(CH_3CH_2CH_2CH_2CO_2^-\)). \(pK_a\) al acidului butiric la 25°C este 4,83. Acidul butiric este responsabil de mirosul neplăcut al untului rânced.
- Calculați \(K_a\) și \(pK_a\) ale ionului dimetilamoniu (\((CH_3)_2NH_2^+\)). Constanta de ionizare a bazei \(K_b\) a dimetilaminei (\((CH_3)_2NH\)) este \(5,4 \ ori 10^{-4}\) la 25°C.
Dat: \(pK_a\) și \(K_b\)
Se cere: \(K_b\) și \(pK_b\) corespunzătoare, \(K_a\) și \(pK_a\)
Strategie:
Constantele \(K_a\) și \(K_b\) sunt legate așa cum se arată în ecuația \(\ref{16.5.10}\). Constantele \(pK_a\) și \(pK_b\) pentru un acid și baza sa conjugată sunt legate între ele așa cum se arată în Ecuațiile \(\ref{16.5.15}\) și \(\ref{16.5.16}\). Folosiți relațiile pK = -log K și K = 10-pK (Ecuațiile \(\ref{16.5.11}\) și \(\ref{16.5.13}\)) pentru a converti între \(K_a\) și \(pK_a\) sau \(K_b\) și \(pK_b\).
Soluție:
Ne este dat \(pK_a\) pentru acidul butiric și ni se cere să calculăm \(K_b\) și \(pK_b\) pentru baza conjugată a acestuia, ionul butirat. Deoarece valoarea \(pK_a\) citată este pentru o temperatură de 25°C, putem folosi ecuația \(\ref{16.5.16}\): \(pK_a\) + \(pK_b\) = pKw = 14,00. Înlocuind \(pK_a\) și rezolvând \(pK_b\),
\
\
Pentru că \(pK_b = -\log K_b\), \(K_b\) este \(10^{-9.17} = 6.8 \ ori 10^{-10}\).
În acest caz, ni se dă \(K_b\) pentru o bază (dimetilamină) și ni se cere să calculăm \(K_a\) și \(pK_a\) pentru acidul conjugat al acesteia, ionul dimetilamoniu. Deoarece cantitatea inițială dată este \(K_b\) și nu \(pK_b\), putem folosi ecuația \(\ref{16.5.10}\): \(K_aK_b = K_w\). Înlocuind valorile lui \(K_b\) și \(K_w\) la 25°C și rezolvând pentru \(K_a\),
\
\
Pentru că \(pK_a\) = -log \(K_a\), avem \(pK_a = -\log(1,9 \ ori 10^{-11}) = 10,72\). De asemenea, am fi putut converti \(K_b\) în \(pK_b\) pentru a obține același răspuns:
\
\
\
\
Dacă ni se dă oricare dintre aceste patru mărimi pentru un acid sau o bază (\(K_a\), \(pK_a\), \(K_b\) sau \(pK_b\)), le putem calcula pe celelalte trei.
Exercițiu \(\PageIndex{1}\): Acidul lactic
Acidul lactic (\(CH_3CH(OH)CO_2H\)) este responsabil pentru gustul și mirosul înțepător al laptelui acru; de asemenea, se crede că produce durere în mușchii obosiți. \(pK_a\) său este de 3,86 la 25°C. Calculați \(K_a\) pentru acidul lactic și \(pK_b\) și \(K_b\) pentru ionul lactat.
Răspuns
- \(K_a = 1,4 \ ori 10^{-4}\) pentru acidul lactic;
- \(pK_b\) = 10.14 și
- \(K_b = 7,2 \ ori 10^{-11}\) pentru ionul lactat
Soluții de acizi și baze puternice: Efectul de nivelare
Vă veți observa în tabelul \(\(\PageIndex{1}\) că acizi precum \(H_2SO_4\) și \(HNO_3\) se află deasupra ionului hidroniu, ceea ce înseamnă că au valori \(pK_a\) mai mici decât zero și sunt acizi mai puternici decât ionul \(H_3O^+\). Reamintim din capitolul 4 că protonul acid din aproape toți oxoacizii este legat de unul dintre atomii de oxigen ai oxoanionului. Astfel, acidul azotic ar trebui să fie scris corect ca \(HONO_2\). Din nefericire, însă, formulele oxoacizilor sunt aproape întotdeauna scrise cu hidrogenul în stânga și oxigenul în dreapta, rezultând în schimb \(HNO_3\). De fapt, toți cei șase acizi puternici comuni pe care i-am întâlnit pentru prima dată în capitolul 4 au valori \(pK_a\) mai mici decât zero, ceea ce înseamnă că au o tendință mai mare de a pierde un proton decât ionul \(H_3O^+\). În schimb, bazele conjugate ale acestor acizi puternici sunt baze mai slabe decât apa. În consecință, echilibrele de transfer de protoni pentru acești acizi puternici se află mult spre dreapta, iar adăugarea oricăruia dintre acizii puternici obișnuiți în apă are ca rezultat o reacție esențial stoichiometrică a acidului cu apa pentru a forma o soluție de ion \(H_3O^+\) și baza conjugată a acidului.
Deși \(K_a\) pentru \(HI\) este cu aproximativ 108 mai mare decât \(K_a\) pentru \(HNO_3\), reacția fie a \(HI\), fie a \(HNO_3\) cu apa dă o soluție esențial stoichiometrică de \(H_3O^+\) și I- sau \(NO_3^-\). De fapt, o soluție apoasă 0,1 M de orice acid puternic conține de fapt 0,1 M \(H_3O^+\), indiferent de identitatea acidului puternic. Acest fenomen se numește efect de nivelare: orice specie care este un acid mai puternic decât acidul conjugat al apei (\(H_3O^+\)) este nivelat la puterea lui \(H_3O^+\) în soluție apoasă, deoarece \(H_3O^+\) este cel mai puternic acid care poate exista în echilibru cu apa. În consecință, este imposibil să se facă distincția între puterile unor acizi precum HI și HNO3 în soluție apoasă și trebuie utilizată o abordare alternativă pentru a determina puterile lor acide relative.
O metodă constă în utilizarea unui solvent precum acidul acetic anhidru. Deoarece acidul acetic este un acid mai puternic decât apa, acesta trebuie să fie, de asemenea, o bază mai slabă, cu o tendință mai mică de a accepta un proton decât \(H_2O\). Măsurătorile conductivității soluțiilor 0,1 M de HI și \(HNO_3\) în acid acetic arată că HI este complet disociat, dar \(HNO_3\) este doar parțial disociat și se comportă ca un acid slab în acest solvent. Acest rezultat ne spune clar că HI este un acid mai puternic decât \(HNO_3\). Ordinea relativă a tăriilor acide și valorile aproximative \(K_a\) și \(pK_a\) pentru acizii puternici din partea de sus a tabelului \(\PageIndex{1}\) au fost determinate folosind măsurători de acest tip și diferiți solvenți neacvatici.
În soluții apoase, \(H_3O^+\) este cel mai puternic acid, iar \(OH^-\) este cea mai puternică bază care poate exista în echilibru cu \(H_2O\).
Efectul de nivelare se aplică și în cazul soluțiilor de baze puternice: În soluție apoasă, orice bază mai puternică decât OH- este nivelată la puterea OH- deoarece OH- este cea mai puternică bază care poate exista în echilibru cu apa. Sărurile cum ar fi \(K_2O\), \(NaOCH_3\) (metoxid de sodiu) și \(NaNH_2\) (sodamidă sau amidă de sodiu), ai căror anioni sunt bazele conjugate ale speciilor care s-ar afla sub apă în tabelul \(\PageIndex{2}\), sunt toate baze puternice care reacționează în mod esențial complet (și adesea violent) cu apa, acceptând un proton pentru a da o soluție de \(OH^-\) și cationul corespunzător:
\
\
\
Alte exemple pe care le puteți întâlni sunt hidrura de potasiu (\(KH\)) și compușii organometalici, cum ar fi metil litiul (\(CH_3Li\)).
Acizi și baze poliprotice
După cum ați învățat, acizii poliprotici cum ar fi \(H_2SO_4\), \(H_3PO_4\) și \(H_2CO_3\) conțin mai mult de un proton ionizabil, iar protonii se pierd în mod progresiv. Specia complet protonată este întotdeauna cel mai puternic acid, deoarece este mai ușor să se elimine un proton dintr-o moleculă neutră decât dintr-un ion cu sarcină negativă. Astfel, puterea acidă scade odată cu pierderea protonilor următori și, în mod corespunzător, crește \(pK_a\). Luați în considerare \(H_2SO_4\), de exemplu:
\
Echilibrul în prima reacție se află mult spre dreapta, în concordanță cu faptul că \(H_2SO_4\) este un acid puternic. În schimb, în cea de-a doua reacție, la echilibru sunt prezente cantități apreciabile atât de \(HSO_4^-\), cât și de \(SO_4^{2-}\).
Pentru un acid poliprotic, tăria acidă scade și \(pK_a\) crește odată cu pierderea secvențială a fiecărui proton.
Ionul hidrogen sulfat (\(HSO_4^-\)) este atât baza conjugată a \(H_2SO_4\), cât și acidul conjugat al \(SO_4^{2-}\). La fel ca apa, HSO4- poate, prin urmare, acționa fie ca un acid, fie ca o bază, în funcție de faptul că celălalt reactant este un acid mai puternic sau o bază mai puternică. În schimb, ionul sulfat [\(SO_4^{2-}\)] este o bază poliprotică care este capabilă să accepte doi protoni în mod etapizat:
\
\
Ca orice altă pereche acid-bază conjugată, puterile acizilor și bazelor conjugate sunt legate prin \(pK_a\) + \(pK_b\) = pKw. Luați în considerare, de exemplu, perechea acid-bază conjugată \(HSO_4^-/ SO_4^{2-}\). Din tabelul \(\(\PageIndex{1}\), vedem că \(pK_a\) al \(HSO_4^-\) este 1,99. Prin urmare, \(pK_b\) al \(SO_4^{2-}\) este 14,00 – 1,99 = 12,01. Astfel, sulfatul este o bază mai degrabă slabă, în timp ce \(OH^-\) este o bază puternică, astfel încât echilibrul prezentat în ecuația \(\ref{16.6}\) se află la stânga. Ionul \(HSO_4^-\) este, de asemenea, o bază foarte slabă (\(pK_a\) al \(H_2SO_4\) = 2,0, \(pK_b\) al \(HSO_4^- = 14 – (-2,0) = 16\)), ceea ce este în concordanță cu ceea ce ne așteptăm pentru baza conjugată a unui acid puternic.
Exemplu \(\PageIndex{2}\)
Precizați dacă echilibrul pentru fiecare reacție se află la stânga sau la dreapta, așa cum este scris.
- \(NH^+_{4(aq)}+PO^{3-}_{4(aq)} \rightleftharpoons NH_{3(aq)}+HPO^{2−}_{4(aq)}\)
- \(CH_3CH_2CO_2H_{(aq)}+CN^−_{(aq)} \rightleftharpoons CH_3CH_2CO^-_{2(aq)}+HCN_{(aq)}\)
Dată: ecuația chimică echilibrată
Se cere: poziția de echilibru
Strategie:
Identificați perechile acid-bază conjugate în fiecare reacție. Apoi, consultați tabelele \(\PageIndex{1}\)și\(\PageIndex{2}\) și figura \(\PageIndex{2}\) pentru a determina care este acidul și baza mai puternică. Echilibrul favorizează întotdeauna formarea perechii acid-bază mai slabă.
Soluție:
Perechile conjugate acid-bază sunt \(NH_4^+/NH_3\) și \(HPO_4^{2-}/PO_4^{3-}\). Conform tabelelor \(\(\PageIndex{1}\) și \(\PageIndex{2}\), \(NH_4^+\) este un acid mai puternic (\(pK_a = 9.25\\)) decât \(HPO_4^{2-}\) (pKa = 12,32), iar \(PO_4^{3-}\) este o bază mai puternică (\(pK_b = 1,68\)) decât \(NH_3\) (\(pK_b = 4,75\)). Prin urmare, echilibrul se va situa spre dreapta, favorizând formarea perechii acid-bază mai slabă:
\
Perechile acid-bază conjugate sunt \(CH_3CH_2CO_2H/CH_3CH_2CO_2CO_2^-\) și \(HCN/CN^-\). Conform tabelului \(\(\PageIndex{1}\), HCN este un acid slab (pKa = 9,21), iar \(CN^-\) este o bază moderat de slabă (pKb = 4,79). Cu toate acestea, acidul propionic (\(CH_3CH_2CO_2H\)) nu este listat în tabelul \(\PageIndex{1}\). Într-o astfel de situație, cea mai bună abordare este să căutați un compus similar ale cărui proprietăți acido-bazice sunt listate. De exemplu, acidul propionic și acidul acetic sunt identice, cu excepția grupărilor atașate la atomul de carbon al acidului carboxilic (\(\ce{-CH_2CH_3}\) față de \(\ce{-CH_3}\)), astfel încât ne putem aștepta ca cei doi compuși să aibă proprietăți acido-bazice similare. În special, ne-am aștepta ca \(pK_a\) al acidului propionic să fie similar în mărime cu \(pK_a\) al acidului acetic. (De fapt, \(pK_a\) al acidului propionic este de 4,87, față de 4,76 pentru acidul acetic, ceea ce face ca acidul propionic să fie un acid ușor mai slab decât acidul acetic). Astfel, acidul propionic ar trebui să fie un acid semnificativ mai puternic decât \(HCN\). Deoarece acidul mai puternic formează baza conjugată mai slabă, prezicem că cianura va fi o bază mai puternică decât propionatul. Prin urmare, echilibrul se va afla la dreapta, favorizând formarea perechii acid-bază mai slabă:
\
Exercițiu \(\PageIndex{1}\)
Precizați dacă echilibrul pentru fiecare reacție se află la stânga sau la dreapta, așa cum este scris.
- \(H_2O_{(l)}+HS^-_{(aq)} \rightleftharpoons OH^−_{(aq)}+H_2S_{(aq)}\)
- \(HCO^−_{2(aq)}+HSO^−_{4(aq)} \rightleftharpoons HCO_2H_{(aq)}+SO^{2-}_{4(aq)}\)
Răspuns a
left
Răspuns b
left
Rezumat
Reacțiile acido-bazice conțin întotdeauna două perechi acid-bază conjugate. Fiecărui acid și fiecărei baze îi este asociată o constantă de ionizare care corespunde puterii sale acide sau bazice. Două specii care diferă doar printr-un proton constituie o pereche acid-bază conjugată. Mărimea constantei de echilibru pentru o reacție de ionizare poate fi utilizată pentru a determina puterea relativă a acizilor și bazelor. Pentru o soluție apoasă a unui acid slab, constanta de disociere se numește constanta de ionizare a acidului (\(K_a\)). În mod similar, constanta de echilibru pentru reacția unei baze slabe cu apa este constanta de ionizare a bazei (\(K_b\)). Pentru orice pereche acid-bază conjugată, \(K_aK_b = K_w\). Valorile mai mici ale \(pK_a\) corespund unor constante de ionizare a acizilor mai mari și, prin urmare, unor acizi mai puternici. Invers, valori mai mici ale \(pK_b\) corespund unor constante de ionizare a bazelor mai mari și, prin urmare, unor baze mai puternice. La 25°C, \(pK_a + pK_b = 14,00\). Reacțiile acido-bazice se desfășoară întotdeauna în direcția care produce perechea acid-bază mai slabă. Nici un acid mai puternic decât \(H_3O^+\) și nici o bază mai puternică decât \(OH^-\) nu pot exista în soluție apoasă, ceea ce duce la fenomenul cunoscut sub numele de efect de nivelare. Acizii (și bazele) poliprotici pierd (și câștigă) protoni într-o manieră etapizată, specia complet protonată fiind cel mai puternic acid, iar specia complet deprotonată fiind cea mai puternică bază.
Ecuații cheie
- Constanta de ionizare a acidului: \=\dfrac{}{}{} \]
- Constanta de ionizare a bazei: \= \dfrac{}{}{} \]
- Relația dintre \(K_a\) și \(K_b\) unei perechi acid-bază conjugate: \
- Definiția lui \(pK_a\): \ \
- Definiția \(pK_b\): \ \
- Relația dintre \(pK_a\) și \(pK_b\) a unei perechi acid-bază conjugate: \ \
Contribuții și atribuții
-
Stephen Lower, Profesor Emerit (Simon Fraser U.) Chem1 Virtual Textbook
.