Entropie
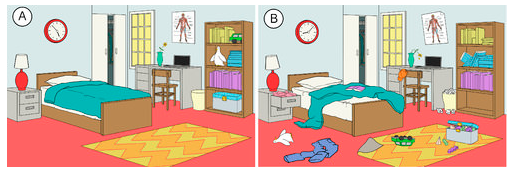
Există o tendință în natură ca sistemele să se îndrepte spre o stare de mai mare dezordine sau aleatorism. Entropia este o măsură a gradului de aleatorism sau de dezordine al unui sistem. Entropia este un concept ușor de înțeles atunci când ne gândim la situațiile de zi cu zi. Entropia unei camere care a fost recent curățată și organizată este scăzută. Pe măsură ce trece timpul, aceasta va deveni probabil mai dezordonată și, prin urmare, entropia sa va crește (a se vedea figura de mai jos). Tendința naturală a unui sistem este ca entropia sa să crească.
Reacțiile chimice tind, de asemenea, să se desfășoare în așa fel încât să crească entropia totală a sistemului. Cum vă puteți da seama dacă o anumită reacție prezintă o creștere sau o scădere a entropiei? Starea moleculară a reactanților și a produselor oferă anumite indicii. Cazurile generale de mai jos ilustrează entropia la nivel molecular.
- Pentru o anumită substanță, entropia stării lichide este mai mare decât entropia stării solide. De asemenea, entropia gazului este mai mare decât entropia lichidului. Prin urmare, entropia crește în procesele în care reactanții solizi sau lichizi formează produși gazoși. Entropia crește, de asemenea, atunci când reactanți solizi formează produși lichizi.
- Entropia crește atunci când o substanță este descompusă în mai multe părți. Procesul de dizolvare crește entropia deoarece particulele de solut se separă unele de altele atunci când se formează o soluție.
- Entropia crește odată cu creșterea temperaturii. O creștere a temperaturii înseamnă că particulele substanței au o energie cinetică mai mare. Particulele care se mișcă mai repede au mai multă dezordine decât particulele care se mișcă mai încet la o temperatură mai scăzută.
- Entropia crește în general în reacțiile în care numărul total de molecule de produs este mai mare decât numărul total de molecule de reactant. O excepție de la această regulă este atunci când se produce un gaz din reactanți negazoși.
Exemplele de mai jos vor servi la ilustrarea modului în care poate fi prezisă schimbarea entropiei într-o reacție.
\(\ce{Cl_2} \left( g \right) \rightarrow \ce{Cl_2} \left( l \right)\)
Entropia scade pentru că un gaz devine lichid.
\(\ce{CaCO_3} \left( s \right) \rightarrow \ce{CaO} \left( s \right) + \ce{CO_2} \left( g \right)\)
Entropia crește pentru că se produce un gaz și crește numărul de molecule.
\(\ce{N_2} \left( g \right) + 3 \ce{H_2} \left( g \right) \rightarrow 2 \ce{NH_3} \left( g \right)\)
Entropia este în scădere deoarece patru molecule totale de reactanți formează două molecule totale de produs. Toate sunt gaze.
\(\ce{AgNO_3} \left( aq \right) + \ce{NaCl} \left( aq \right) \rightarrow \ce{NaNO_3} \ stânga( aq \ dreapta) + \ce{AgCl} \left( s \right)\)
Entropia este în scădere deoarece se formează un solid din reactanți apoși.
\(\ce{H_2} \left( g \right) + \ce{Cl_2} \left( g \right) \rightarrow 2 \ce{HCl} \left( g \right)\)
Schimbarea entropiei este necunoscută (dar probabil nu este zero), deoarece există un număr egal de molecule de ambele părți ale ecuației și toate sunt gaze.
.