Modelul atomic
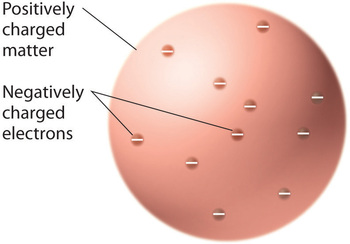
După ce oamenii de știință au ajuns la concluzia că toată materia conține electroni încărcați negativ, a devenit clar că atomii, care sunt neutrii din punct de vedere electric, trebuie să conțină și sarcini pozitive pentru a le echilibra pe cele negative. Thomson a propus ca electronii să fie încorporați într-o sferă uniformă care conținea atât sarcina pozitivă, cât și cea mai mare parte a masei atomului, la fel ca stafidele în budinca de prune sau chipsurile de ciocolată într-o prăjitură (Figura \(\PageIndex{9}\))
2.4.6
Figura \(\PageIndex{9}\): Modelul lui Thomson al atomului cu budincă de prune sau prăjitură cu fulgi de ciocolată. În acest model, electronii sunt încorporați într-o sferă uniformă de sarcină pozitivă. Imagine utilizată cu permisiune (CC BY-SA-NC).
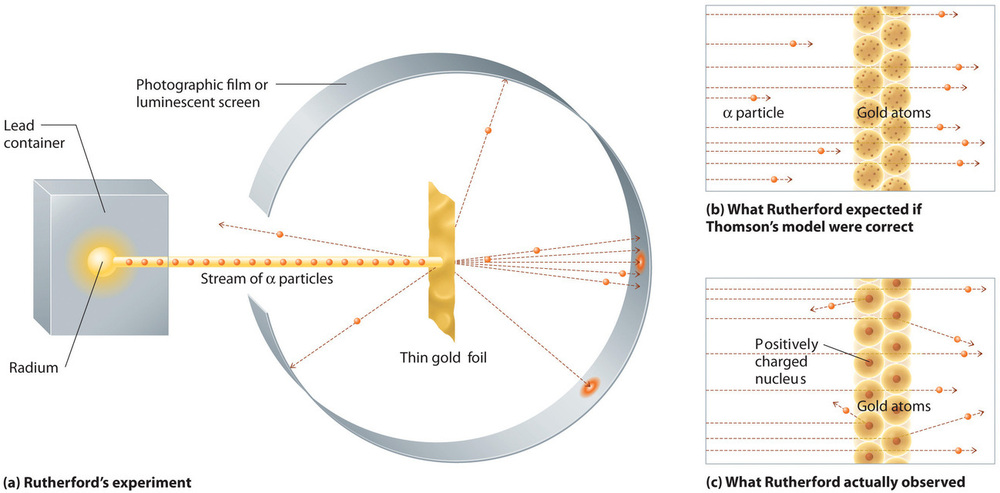
Într-un singur experiment celebru, Rutherford a demonstrat însă fără echivoc că modelul atomului lui Thomson era incorect. Rutherford a îndreptat un flux de particule α spre o țintă foarte subțire din folie de aur (Figura \(\PageIndex{10a}\)) și a examinat modul în care particulele α au fost împrăștiate de folie. Aurul a fost ales pentru că putea fi ciocănit cu ușurință în foi extrem de subțiri, minimizând numărul de atomi din țintă. Dacă modelul lui Thomson al atomului ar fi fost corect, particulele α încărcate pozitiv ar fi trebuit să se prăbușească prin masa uniform distribuită a țintei de aur precum ghiulelele de tun prin peretele unei case de lemn. S-ar putea să se deplaseze puțin mai încet când au ieșit la suprafață, dar ar trebui să treacă, în esență, direct prin țintă (Figura \(\PageIndex{10b}\))Spre uimirea lui Rutherford, o mică parte din particulele α au fost deviate în unghiuri mari, iar unele au fost reflectate direct înapoi la sursă (Figura \(\PageIndex{10c}\)). Potrivit lui Rutherford, „A fost aproape la fel de incredibil ca și cum ai trage cu un obuz de 15 inch spre o bucată de hârtie de țesut și aceasta s-ar întoarce și te-ar lovi.”
2.4.7
Figura \(\PageIndex{10}\): Un rezumat al experimentelor lui Rutherford. (a) O reprezentare a aparatului folosit de Rutherford pentru a detecta devierile unui flux de particule α îndreptate spre o țintă subțire din folie de aur. Particulele au fost produse de un eșantion de radiu. (b) Dacă modelul lui Thomson al atomului ar fi fost corect, particulele α ar fi trebuit să treacă direct prin folia de aur. (c) Cu toate acestea, un număr mic de particule α au fost deviate în diferite direcții, inclusiv direct înapoi la sursă. Acest lucru ar putea fi adevărat numai dacă sarcina pozitivă ar fi fost mult mai masivă decât particula α. A sugerat că masa atomului de aur este concentrată într-o regiune foarte mică din spațiu, pe care a numit-o nucleu. Imagine folosită cu permisiune (CC BY-SA-NC).
Rezultatele lui Rutherford nu erau în concordanță cu un model în care masa și sarcina pozitivă sunt distribuite uniform în tot volumul unui atom. În schimb, ele sugerau cu tărie că atât masa cât și sarcina pozitivă sunt concentrate într-o fracțiune minusculă din volumul unui atom, pe care Rutherford a numit-o nucleu. Era logic ca o mică fracțiune din particulele α să se ciocnească cu nucleele dense, încărcate pozitiv, fie din priviri, ceea ce duce la deviații mari, fie aproape frontal, ceea ce face ca acestea să fie reflectate direct la sursă.
Deși Rutherford nu a putut explica de ce respingerile dintre sarcinile pozitive din nucleele care conțineau mai mult de o sarcină pozitivă nu au cauzat dezintegrarea nucleului, el a motivat că respingerile dintre electronii încărcați negativ ar face ca electronii să fie distribuiți uniform în tot volumul atomului.Astăzi se știe că forțele nucleare puternice, care sunt mult mai puternice decât interacțiunile electrostatice, țin protonii și neutronii împreună în nucleu. Pentru acest lucru și pentru alte descoperiri, Rutherford a primit Premiul Nobel pentru Chimie în 1908. Din păcate, Rutherford ar fi preferat să primească Premiul Nobel pentru Fizică, deoarece considera că fizica este superioară chimiei. În opinia sa, „Toată știința este fie fizică, fie colecționare de timbre.”
 2.4.8
2.4.8
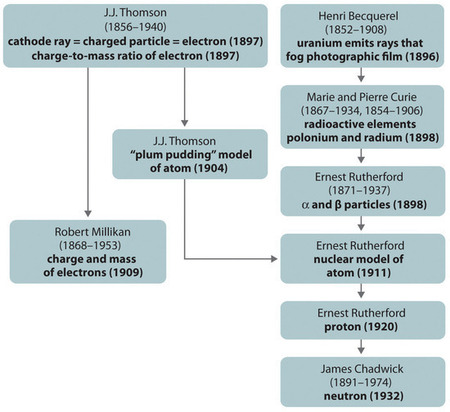
Figura \(\PageIndex{11}\): Un rezumat al dezvoltării istorice a modelelor privind componentele și structura atomului. Datele din paranteze reprezintă anii în care au fost efectuate experimentele cheie. Imagine utilizată cu permisiunea (CC BY-SA-NC).
Dezvoltarea istorică a diferitelor modele ale structurii atomului este rezumată în (Figura \(\(\PageIndex{11}\})) Rutherford a stabilit că nucleul atomului de hidrogen este o particulă încărcată pozitiv, pentru care a inventat numele de proton în 1920. El a sugerat, de asemenea, că nucleele altor elemente decât hidrogenul trebuie să conțină particule neutre din punct de vedere electric cu aproximativ aceeași masă ca și protonul. Cu toate acestea, neutronul a fost descoperit abia în 1932, când James Chadwick (1891-1974, student al lui Rutherford; Premiul Nobel pentru Fizică, 1935) l-a descoperit. Ca urmare a lucrărilor lui Rutherford, a devenit clar că o particulă α conține doi protoni și neutroni și, prin urmare, este nucleul unui atom de heliu.
2.4.9
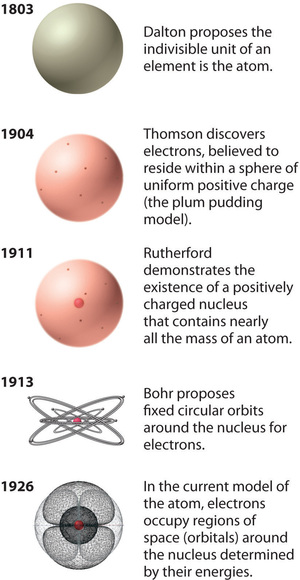
Figura \(\PageIndex{12}\): Evoluția teoriei atomice, ilustrată prin modele ale atomului de oxigen. Modelul lui Bohr și modelul actual sunt descrise în capitolul 6, „Structura atomilor”. Imagine utilizată cu permisiune (CC BY-SA-NC).
Modelul atomic al lui Rutherford este, în esență, același cu modelul modern, cu excepția faptului că acum se știe că electronii nu sunt distribuiți uniform în tot volumul unui atom. În schimb, ei sunt distribuiți în conformitate cu un set de principii descrise de mecanica cuantică. Figura \(\PageIndex{12}\) arată cum a evoluat în timp modelul atomului, de la unitatea indivizibilă a lui Dalton până la viziunea modernă predată astăzi.
.