Anemia hemolitică autoimună (AIHA) este mediată de anticorpi, iar în majoritatea cazurilor imunoglobulina (Ig) G este anticorpul mediator. Acest tip de AIHA este denumit AIHA „caldă” deoarece anticorpii IgG se leagă cel mai bine la temperatura corpului. AIHA „rece” este mediată de anticorpii IgM, care se leagă la maximum la temperaturi sub 37°C. AIHA cauzată de o reacție medicamentoasă este rară, cu o incidență anuală estimată la 1:1.000.000 pentru AIHA severă legată de medicamente.1 Acest articol trece în revistă managementul celor mai frecvente tipuri de AIHA, cu accent pe AIHA caldă, rece și indusă de medicamente; evaluarea și diagnosticarea AIHA este trecută în revistă într-un articol separat.
Anemia hemolitică autoimună caldă
În AIHA, hemoliza este mediată de anticorpi care se leagă de suprafața globulelor roșii. AIHA în care anticorpii IgG sunt anticorpii incriminați se numește AIHA caldă. „Caldă” se referă la faptul că anticorpul se leagă cel mai bine la temperatura corpului (37°C). În AIHA caldă, testele vor arăta moleculele IgG atașate la suprafața globulelor roșii, 50% dintre pacienți prezentând și C3. Între 50% și 90% din cazurile de AIHA se datorează anticorpilor calzi.2,3 Incidența AIHA caldă variază în funcție de serie, dar este de aproximativ 1 caz la 100.000 de pacienți pe an; această formă de hemoliză afectează mai frecvent femeile decât bărbații.4,5
Opțiuni terapeutice
Prima linie
Steroizi. Scopul terapiei în AIHA caldă poate fi greu de definit. Cu toate acestea, majoritatea ar fi de acord că un hematocrit de peste 30% (sau mai mare pentru a preveni simptomele) cu o creștere minimă a numărului de reticulocite – reflectând un proces hemolitic semnificativ încetinit – este un obiectiv rezonabil. Managementul inițial al AIHA cald este prednisonul în doză standard de 1 mg/kg pe zi (tabelul 1).6,7 Pacienții ar trebui să înceapă, de asemenea, tratamentul cu inhibitori ai pompei de protoni pentru a preveni apariția ulcerelor. Poate dura până la 3 săptămâni pentru ca pacienții să răspundă la terapia cu prednison. Odată ce hematocritul pacientului este peste 30%, prednisonul se reduce lent. Deși aproximativ 80% dintre pacienți vor răspunde la steroizi, doar 30% pot fi renunțate complet la steroizi. Pentru pacienții care pot fi menținuți cu o doză zilnică de steroizi de 10 mg sau mai puțin, steroizii pot fi cea mai rezonabilă terapie pe termen lung. În plus, deoarece hemoliza activă duce la o cerere crescută de acid folic, pacienților cu AIHA caldă li se prescrie adesea acid folic 1 mg zilnic pentru a preveni anemia megaloblastică datorată deficitului de acid folic.
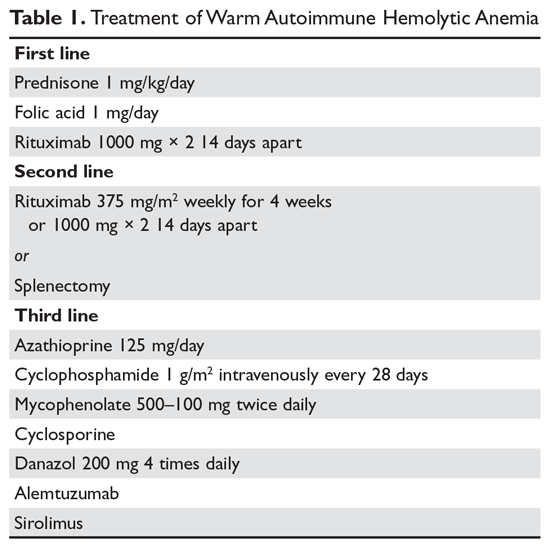
Rituximab. Din ce în ce mai mult, terapia cu rituximab (anti-CD20) se adaugă la steroizii inițiali. Două studii clinice au arătat atât o creștere a răspunsurilor pe termen lung, cât și pe termen scurt, odată cu utilizarea rituximabului.8,9 Un aspect important de luat în considerare este faptul că majoritatea pacienților răspund treptat la rituximab pe parcursul săptămânilor, astfel încât nu trebuie așteptat un răspuns rapid. Majoritatea studiilor au utilizat doza tradițională de 375 mg/m2 săptămânal timp de 4 săptămâni. Aceste răspunsuri par a fi durabile, dar, ca și în trombocitopenia imună (ITP), tratamentul repetat cu rituximab este eficient.
Reacțiile secundare majore ale rituximabului sunt reacțiile la perfuzie, care sunt adesea mai grave cu prima doză. Aceste reacții pot fi controlate cu antihistaminice, steroizi și, pentru rigori severe, meperidină. Rareori, pacienții pot dezvolta neutropenie (aproximativ 1:500) care pare a fi de natură autoimună. Infecțiile par să fie doar foarte puțin crescute odată cu utilizarea rituximabului.10 Un grup de risc este reprezentat de purtătorii cronici ai virusului hepatitei B, care pot prezenta o reactivare a virusului care poate fi fatală. Astfel, pacienții la care se are în vedere administrarea de rituximab trebuie să fie supuși unui screening pentru depistarea stării de purtător al virusului hepatitei B.11 Pacienții care primesc rituximab prezintă un risc foarte mic de leucoencefalopatie multifocală progresivă, care este mai frecventă la pacienții cu cancer și la pacienții puternic imunodeprimați. Riscul global este necunoscut, dar este mai mic de 1:50.000.
.