Termenii: luminescență, fotoluminescență, fluorescență și fosforescență sunt utilizați în mod obișnuit în lucrările de cercetare pentru a descrie emisia de lumină de la o probă. Această denumire multiplă poate crea confuzie, mai mulți dintre termeni fiind folosiți în mod interschimbabil, iar cercetători din medii științifice diferite preferând să folosească o denumire în locul alteia. În acest articol răspundem la întrebarea „Care este diferența dintre luminescență, fotoluminescență, fluorescență și fosforescență”.
Ce este luminescența?
Luminescența este orice emisie de lumină (unde electromagnetice) de la o substanță care nu provine din încălzire. Această definiție face ca luminescența să se deosebească de incandescență, care este emisia de lumină datorată temperaturii ridicate a unei substanțe, cum ar fi o scânteie incandescentă. Cuvântul luminescență este derivat din cuvântul latin pentru lumină, lumen, și din latinescul escentia, care înseamnă „procesul de” și, prin urmare, este procesul de emitere a luminii.

Există multe tipuri de luminescență care pot fi clasificate în funcție de sursa de energie care inițiază procesul de luminescență. O prezentare generală a diferitelor tipuri de luminescență și a surselor lor de energie este prezentată în figura 2. Multe dintre aceste procese de luminescență au aplicații științifice și industriale importante, cum ar fi electroluminescența, în care lumina este emisă în urma recombinării electronilor și a găurilor după aplicarea unui câmp electric pe un material și care reprezintă principiul de funcționare din spatele diodelor emițătoare de lumină; și chemiluminescența, în care emisia de lumină este inițiată de o reacție chimică și este utilizată în testele biologice, fiind responsabilă de strălucirea bețișoarelor luminoase. Cu toate acestea, prezentul articol se axează pe fotoluminescență, care stă la baza unei tehnici spectroscopice nedistructive puternice, spectroscopia de fotoluminescență, care este utilizată pe scară largă atât în mediul academic, cât și în industrie.
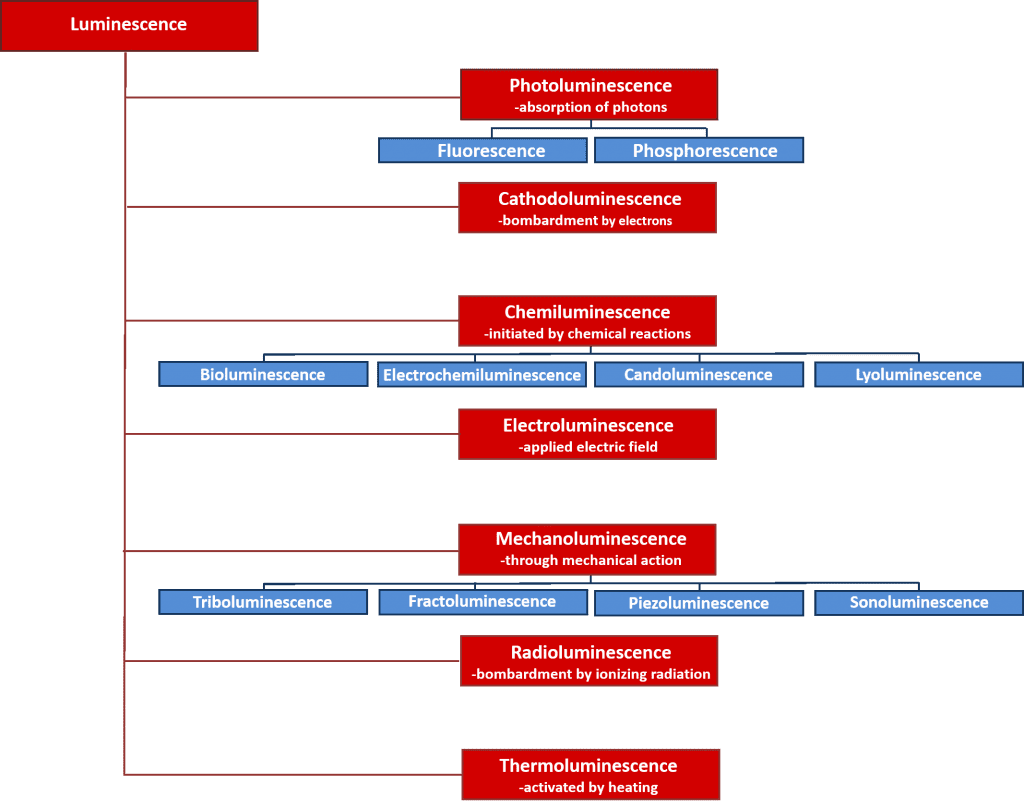
Ce este fotoluminescența?
Fotoluminescența este emisia de lumină de către un material în urma absorbției luminii. Cuvântul în sine este interesant prin faptul că este combinația dintre cuvântul derivat din latină luminescență și prefixul grecesc, foto-, pentru lumină. Orice luminescență care este indusă de absorbția de fotoni se numește fotoluminescență. Aceasta ar putea fi, în egală măsură, emisia de lumină de la o moleculă de colorant organic în soluție (figura 3a) sau recombinarea bandă la bandă a electronilor și găurilor în urma fotoexcitării unui semiconductor (figura 3b).

Descrierea oricărei emisii de lumină induse de absorbția fotonică drept fotoluminescență este exactă; cu toate acestea, este o practică obișnuită, în special de către chimiști, să subdivizeze în continuare fotoluminescența în fluorescență și fosforescență.
Care este diferența dintre fluorescență și fosforescență?
Există diverse definiții ale fluorescenței și fosforescenței, cea mai simplă fiind aceea că fluorescența este fotoluminescența promptă care apare la foarte scurt timp după fotoexcitarea unei substanțe, în timp ce fosforescența este fotoluminescența de lungă durată care continuă mult timp după ce fotoexcitarea a încetat. Deși aceasta este o definiție simplă, ea nu explică de ce apare o astfel de diferență în ceea ce privește intervalele de timp ale fotoluminescenței, iar unele materiale se pot încadra într-o zonă gri între intervalele de timp clasice ale fluorescenței și fosforescenței. O definiție mai amănunțită trebuie să se bazeze pe mecanica cuantică a stărilor excitate și fundamentale implicate în procesul de emisie. Folosind această abordare, fluorescența și fosforescența pot fi definite ca fotoluminescență în cazul în care tranziția radiativă nu necesită o schimbare a multiplicității spinului și, respectiv, fotoluminescență în cazul în care tranziția radiativă implică o schimbare a multiplicității spinului.
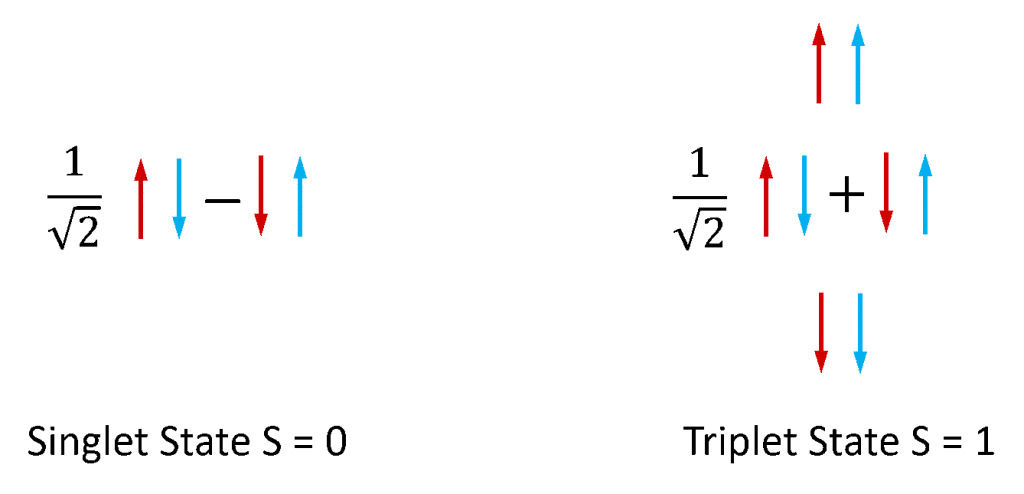
Fluorescența și fosforescența sunt utilizate cel mai frecvent pentru a se referi la fotoluminescența din sistemele moleculare. Electronii din moleculele stabile există întotdeauna în perechi, deoarece moleculele cu electroni nepereche sunt extrem de reactive și instabile. Electronii posedă un moment unghiular intrinsec cunoscut sub numele de „spin”, iar o pereche de electroni poate exista în una dintre cele două stări de spin total, în funcție de simetria relativă a spinilor celor doi electroni. Dacă cei doi spini se află într-o configurație antisimetrică, perechea de electroni are un spin total de zero (S = 0), în timp ce dacă se află într-o configurație simetrică, atunci perechea are un spin total de unu (S = 1). Așa cum este ilustrat în figura 4, există o combinație de stări ale perechii de spini electronici care este antisimetrică și trei combinații de stări ale perechii de spini care sunt simetrice, iar stările S = 0 și S = 1 se numesc, prin urmare, singlet și, respectiv, triplet.
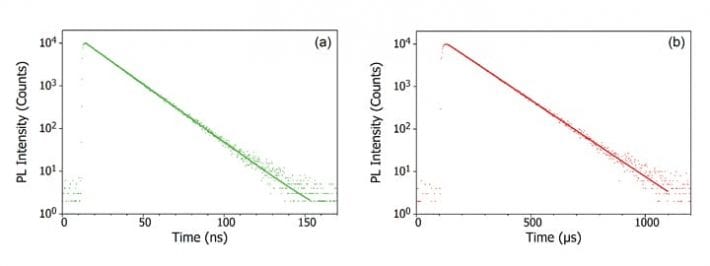
Când un foton este absorbit de moleculă, unul dintre electroni este promovat la un nivel energetic superior, iar molecula se află acum într-o stare excitată. Starea fundamentală a unei molecule este (aproape) întotdeauna o stare singlet (S0) și, datorită conservării momentului unghiular, starea fotoexcitată trebuie să fie, de asemenea, o stare singlet (S1), așa cum se arată în diagrama Jablonski de mai jos. Dezintegrarea stării S1 înapoi în S0 este o tranziție permisă (deoarece ambele stări au aceeași multiplicitate de spin), rezultând o fotoluminescență promptă care are loc pe o scară de timp de la picosecunde la nanosecunde și se numește fluorescență.
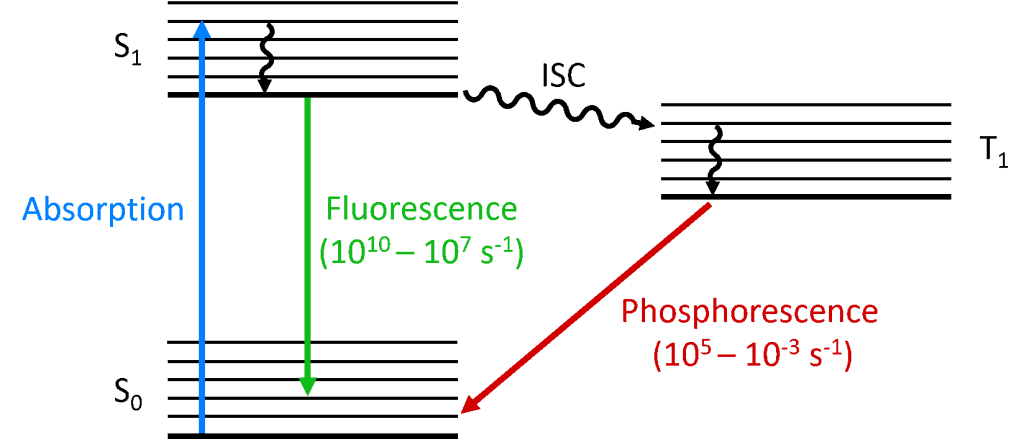
Alternativ, molecula poate suferi o trecere intersistemică (ISC) la starea excitată triplet (T1). ISC apare de obicei în moleculele cu un grad ridicat de cuplaj spin-orbită, cuplarea momentului unghiular orbital și a momentului unghiular de spin al electronului, care permite conversia între stările singlet și triplet. Puterea de cuplare spin-orbită crește odată cu masa atomului și, prin urmare, moleculele fosforescente trebuie să conțină metale grele, cum ar fi europiul și iridiul. Dezintegrarea stării T1 înapoi în S0 este o tranziție interzisă, deoarece stările au multiplicități de spin diferite, din cauza conservării momentului unghiular. Cu toate acestea, cuplajul spin-orbită relaxează această restricție și o tranziție radiativă de la T1 la S1 devine posibilă. Deoarece este „interzisă”, fotoluminescența care rezultă din tranziția de la T1 la S0 se produce pe o scară de timp mult mai lentă, de la microsecunde la mii de secunde, și se numește fosforescență.
De asemenea, trebuie remarcat faptul că emisia de la unele materiale nu se încadrează întotdeauna în mod clar într-o categorie sau alta. Un exemplu în acest sens este fluorescența întârziată activată termic (TADF). În TADF, nivelurile S1 și T1 sunt apropiate ca energie și puternic cuplate și, prin urmare, este posibilă o ISC inversă de la T1 la S1. Aceasta dă naștere unei tranziții întârziate de la S1 la S0, care are ca rezultat fotoluminescența la o scară de timp între fluorescență și fosforescență, cunoscută sub numele de fluorescență întârziată. Pentru mai multe informații despre TADF și utilizarea sa în OLED-urile de înaltă eficiență, citiți postarea „Ce este TADF?”.
Când să descriem emisia ca fotoluminescență față de fluorescență/fosforescență ține, în cele din urmă, de preferințele personale. Chimiștii și biologii, care studiază în principal sistemele moleculare, favorizează utilizarea fluorescenței și a fosforescenței, deoarece în aceste sisteme moleculare puternic localizate există stări distincte de singlet și triplet. În schimb, fizicienii studiază cu precădere materiale semiconductoare în care electronii sunt puternic delocalizați, iar conceptul de singlet și triplet încetează în mod frecvent să mai fie relevant. Acesta este unul dintre motivele pentru care fizicienii tind să folosească termenul mai larg de fotoluminescență pentru a descrie emisia de lumină.
Indiferent cum decideți să o numiți; fotoluminescența, fluorescența și fosforescența pot furniza o multitudine de informații despre proprietățile moleculelor și materialelor; de la determinarea duratei de viață a purtătorilor de sarcină în celulele solare până la măsurarea dinamicii de solvatare în jurul micelilor din celulele vii.
Produse pentru luminescență, fotoluminescență, fluorescență și fosforescență
Pentru a măsura fotoluminescența este necesar un spectrometru de fotoluminescență, iar Edinburgh Instruments oferă o gamă de spectrometre de fotoluminescență cu numărare de fotoni unici pentru a măsura spectrele de fotoluminescență, duratele de viață, anizotropia și randamentele cuantice ale probelor dumneavoastră.
Rămâneți în contact
Dacă v-a plăcut să citiți acest articol și doriți să fiți primii care văd cele mai recente știri, aplicații și informații despre produse de la Edinburgh Instruments, înscrieți-vă la buletinul nostru informativ ocazional prin intermediul butonului roșu de înscriere de mai jos și urmăriți-ne pe rețelele sociale.