
Brønsted în laboratorul său
Potrivit conceptului Brønsted-Lowry, procesul care a fost scris anterior ca o simplă disociere a unui acid generic HA (HA → H+ + A-) este considerat mai corect ca un proces de transfer de protoni:
HA + H2O → A-+ H3O+(3-1)
Ideea, din nou, este că protonul, odată ce părăsește acidul, trebuie să sfârșească atașat la ceva (pe care noi îl numim bază;) nu poate pur și simplu să plutească ca un ion de hidrogen liber.
- P perechi acid-bază conjugate
- Acizi puternici și acizi slabi
- Definiția unui acid „puternic”
- Efectul de nivelare
- Acizi slabi
- Acizii puternici au baze conjugate slabe
- Sălile de acizi slabi se dizolvă pentru a da soluții alcaline
- Unele baze puternice obișnuite sunt hidroxizii din grupa 1
- Sărurile de baze slabe dau soluții acide
- Autoprotoliza
- Amfioliți
- Sistemul acido-bazic al carbonatului
P perechi acid-bază conjugate
O reacție a unui acid cu o bază este astfel o reacție de schimb de protoni; dacă acidul este notat cu AH și baza cu B, atunci putem scrie o reacție acido-bazică generalizată sub forma
AH + B → A- + BH+(3-2)
Rețineți că reacția inversă a acestei reacții,
BH+ + A- → B + AH(3-3)
este, de asemenea, o reacție acido-bazică. Deoarece reacțiile de transfer de protoni sunt reversibile, rezultă că transferul unui proton de la un acid la o bază trebuie să creeze în mod necesar o nouă pereche de specii care pot, cel puțin în principiu, să constituie o pereche acid-bază proprie, pe care o numim pereche acid-bază conjugată:
Termenul conjugat înseamnă „conectat cu”, implicația fiind că membrii oricărei perechi conjugate sunt „conectați” prin prezența sau absența unui proton.
Ce specii sunt considerate „conjugate” depinde de direcția în care este scrisă reacția, așa cum se arată mai jos pentru transferul de protoni din (3-1):


În mod similar, pentru transferurile de protoni generalizate (3-2) și (3-3), avem


Tabelul de mai jos prezintă perechile conjugate ale unui număr de sisteme acido-bazice tipice.
| acid | bază | ||
| acid clorhidric | HCl | ionul clorură | Cl- |
| acidul acetic | CH3CH2COOH | ionul acetat | CH3CH2COO- |
| acidul nitric | HNO3 | ion nitrat | NO3- |
| ion fosfat de dihidrogen | H2PO4- | ion fosfat de monohidrogen | HPO42- |
| Ion sulfat de hidrogen | HSO4- | Ion sulfat | SO42- |
| Ion sulfat de hidrogen ion carbonat („bicarbonat”) | HCO3- | ion carbonat | CO32- |
| ion amoniu | NH4+ | amoniac | NH3 |
| ion de fier(III) („feric”) | Fe(H2O)63+ | pentaaquoironIII | Fe(H2O)5OH2+ |
| apă | H2O | Ion hidroxid | OH- |
| Ion hidroniu | H3O+ | apă | H2O |
Acizi puternici și acizi slabi
Potem să privim generalizarea acid-bază
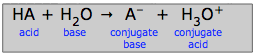
ca o competiție a două baze pentru un proton:

Definiția unui acid „puternic”
Dacă baza H2O câștigă în mod covârșitor această luptă corp la corp, atunci se spune că acidul HA este un acid puternic. Aceasta este ceea ce se întâmplă cu acidul clorhidric și cu ceilalți „acizi minerali” puternici comuni H2SO4, HNO3 și HClO4:
Soluțiile acestor acizi în apă sunt de fapt soluții ale speciilor ionice arătate cu caractere îngroșate în dreapta. Așa stând lucrurile, rezultă că ceea ce numim o soluție 1 M de „acid clorhidric” în apă, de exemplu, nu conține în realitate o concentrație semnificativă de HCl; singurul acid real prezent într-o astfel de soluție este H3O+!
Aceste considerații dau naștere la două reguli importante pe care trebuie nu numai să le cunoașteți, dar și să le înțelegeți:
H3O+ este cel mai puternic acid care poate exista în apă;
Toți acizii puternici par să fie la fel de puternici în apă.
Efectul de nivelare
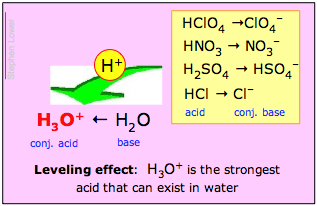
A doua dintre aceste afirmații se numește efect de nivelare. Aceasta înseamnă că, deși puterile proton-donator inerente ale acizilor puternici diferă, toți sunt complet disociați în apă. Chimiștii spun că puterile lor sunt „nivelate” de solventul apă.
Un efect comparabil ar fi observat dacă cineva ar încerca să judece puterile mai multor adulți prin desfășurarea unei serii de concursuri de tras de păr cu un copil mic. Ne-am aștepta ca adulții să câștige în mod covârșitor la fiecare încercare; forțele lor ar fi fost „nivelate” de cea a copilului.
Acizi slabi
Cei mai mulți acizi, totuși, sunt capabili să își rețină protonii mai strâns, astfel încât doar o mică parte din acid este disociată. Astfel, acidul cianhidric, HCN, este un acid slab în apă, deoarece protonul este capabil să împartă electronii perechii singuratice ai ionului cianură CN- mai eficient decât o poate face cu cei ai H2O, astfel încât reacția
HCN + H2O → H3O+ + CN-
se desfășoară doar într-o măsură foarte mică.
Din moment ce un acid puternic își leagă protonul doar slab, în timp ce un acid slab îl leagă strâns, putem spune că
Acizii puternici sunt „slabi”; Acizii slabi sunt „puternici”
Dacă sunteți capabili să explicați acest aparent paradox, ați înțeles una dintre cele mai importante idei din chimia acido-bazică!
|
reacția
|
acid
|
bază
|
acid conjugat
|
bază conjugată
|
bază conjugată
|
| 1) autoionizarea apei H2O | H2O | H2O | H3O+ | OH- | |
| 2) ionizarea acidului cianhidric HCN | HCN | H2O | H3O+ | CN- | |
| 3) ionizarea amoniacului NH3 în apă | NH3 | H2O | NH4+ | OH-. | |
| 4) hidroliza clorurii de amoniu NH4Cl | NH4+ | H2O | H3O+ | NH3 | |
| 5) hidroliza acetatului de sodiu CH3COO- Na+ | H2O | CH3COO- | CH3COOH | OH- | |
| 6) neutralizarea a HCl cu NaOH | HCl | OH- | H2O | Cl- | |
| 7) neutralizarea a NH3 de către acidul acetic | CH3COOH | NH3 | NH4+ | CH3COO- | |
| 8) dizolvarea BiOCl (oxiclorură de bismut) de către HCl | 2 H3O+ | BiOCl | Bi(H2O)3+ | H2O, Cl- | |
| 9) descompunerea Ag(NH3)2+ de către HNO3 | 2 H3O+ | Ag(NH3)2+ | NH4+ | H2O | |
| 10) deplasarea de HCN de către CH3COOH | CH3COOH | CN- | HCN | CH3COO- |
Acizii puternici au baze conjugate slabe
Acesta este doar un re-enunțare a ceea ce este implicit în ceea ce s-a spus mai sus despre distincția dintre acizii puternici și acizii slabi. Faptul că HCl este un acid puternic implică faptul că baza sa conjugată Cl- este o bază prea slabă pentru a reține protonul în competiție fie cu H2O, fie cu H3O+. În mod similar, ionul CN- se leagă puternic de un proton, ceea ce face din HCN un acid slab.
Sălile de acizi slabi se dizolvă pentru a da soluții alcaline
Faptul că HCN este un acid slab implică faptul că ionul de cianură CN- reacționează ușor cu protonii, fiind astfel o bază relativ bună. Ca dovadă a acestui fapt, o sare precum KCN, atunci când este dizolvată în apă, produce o soluție ușor alcalină:
CN- + H2O → HCN + OH-
Această reacție este încă menționată uneori sub vechea sa denumire de hidroliză („scindare a apei”), care este corectă din punct de vedere literar, dar care tinde să ascundă identitatea sa ca fiind doar o altă reacție acido-bazică. Reacțiile de acest tip au loc doar într-o mică măsură; o soluție 0,1M de KCN este încă, în toate scopurile practice, 0,1M în ion cianură.
Unele baze puternice obișnuite sunt hidroxizii din grupa 1
Unele baze cu adevărat puternice pe care este probabil să le întâlniți în chimia de zi cu zi sunt hidroxizii metalelor alcaline, cum ar fi NaOH și KOH, care sunt în esență soluții ale ionului hidroxid (și, desigur, ale cationului.)
Majoritatea celorlalți compuși care conțin ioni de hidroxid, cum ar fi Fe(OH)3 și Ca(OH)2, nu sunt suficient de solubili în apă pentru a da soluții foarte alcaline, așa că nu sunt considerați de obicei ca fiind baze puternice.
Există, de fapt, un număr de baze care sunt mai puternice decât ionul hidroxid – cele mai cunoscute sunt ionul oxid O2- și ionul amidă NH2-, dar acestea sunt atât de puternice încât pot fura chiar și un proton din apă:
O2- + H2O → 2 OH-
NH2- + H2O → NH3 + OH-
Acest lucru dă naștere la același tip de efect de nivelare pe care l-am descris pentru acizi, cu consecința că
Sărurile de baze slabe dau soluții acide
Cel mai comun exemplu este clorura de amoniu, NH4Cl, ale cărei soluții apoase sunt net acide:
NH4+ + H2O → NH3 + H3O+
Pentru că această reacție (și altele similare) au loc doar într-o mică măsură, o soluție de clorură de amoniu va fi doar ușor acidă.
Autoprotoliza
Din unele dintre exemplele date mai sus, vedem că apa poate acționa ca un acid
CN- + H2O → HCN + OH-
și ca o bază
NH4+ + H2O → NH3 + H3O+
Dacă așa stau lucrurile, atunci nu există nici un motiv pentru care „apa-acidă” să nu poată dona un proton către „apa-bază”:

Această reacție este cunoscută sub numele de autoprotoliza apei.
Chimiștii încă se referă adesea la această reacție ca la „disocierea” apei și folosesc ecuația de tip Arrhenius H2O → H+ + OH- ca un fel de prescurtare.
După cum s-a discutat în lecția anterioară, acest proces are loc doar într-o măsură infimă. Cu toate acestea, înseamnă că în orice soluție apoasă sunt prezenți atât ioni de hidroniu, cât și ioni de hidroxid.
Pot prezenta și alte lichide autoprotoliză? Răspunsul este da. Cel mai cunoscut exemplu este amoniacul lichid:
2 NH3 → NH4+ + NH2-
Chiar și acidul sulfuric lichid pur poate juca acest joc:
2 H2SO4→ H3SO4+ + HSO4-
Care dintre acești solvenți poate sta la baza propriului „sistem” acido-bazic, paralel cu cunoscutul „sistem al apei”.
Amfioliți
Apa, care poate acționa fie ca acid, fie ca bază, se spune că este amfiprotică: ea poate „oscila în ambele sensuri”. O substanță precum apa care este amfiriptică se numește ampolit.
După cum se arată aici, ionul hidroxid poate fi, de asemenea, un ampolit, dar nu în soluție apoasă în care nu poate exista ionul oxid.
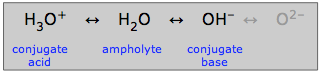
Desigur natura amfirotică a apei este cea care îi permite să joace rolul său special în chimia acido-bazică acvatică obișnuită. Dar multe alte substanțe amfiprotice pot exista, de asemenea, în soluțiile apoase. Orice astfel de substanță va avea întotdeauna un acid conjugat și o bază conjugată, astfel încât, dacă puteți recunoaște aceste două conjugate ale unei substanțe, veți ști că aceasta este amfiprotică.
Sistemul acido-bazic al carbonatului
De exemplu, setul de tripleți {acidul carbonic, ionul bicarbonat, ionul carbonat} constituie o serie amfiprotică în care ionul bicarbonat este ampolit, diferind de oricare dintre vecinii săi prin adăugarea sau îndepărtarea unui proton:
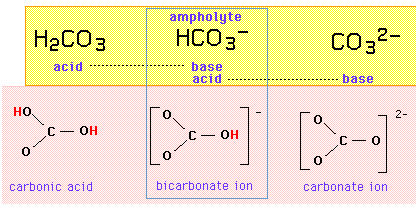
Dacă ionul bicarbonat este atât un acid, cât și o bază, ar trebui să fie capabil să schimbe un proton cu el însuși într-o reacție de autoprotoliză:
HCO3- + HCO3- → H2CO3 + CO32-
Însăși viața ta depinde de reacția de mai sus! CO2, un produs metabolic secundar al fiecărei celule din corpul dumneavoastră, reacționează cu apa pentru a forma acidul carbonic
H2CO3 care, dacă ar fi lăsat să se acumuleze, ar face ca sângele dumneavoastră să devină fatal de acid. Cu toate acestea, sângele conține, de asemenea, ion carbonat, care reacționează în conformitate cu reversul ecuației de mai sus pentru a produce bicarbonat, care poate fi transportat în siguranță de sânge către plămâni. În plămâni, reacția de autoprotoliză se desfășoară în sens invers, producând H2CO3, care pierde apă pentru a forma CO2, care este expulzat în respirație. Ionul carbonat este reciclat înapoi în sânge pentru a prelua în cele din urmă o altă moleculă de CO2.