În chimie, geometria moleculară în formă de T descrie structurile unor molecule în care un atom central are trei liganzi. În mod obișnuit, compușii cu trei coordonate adoptă geometrii planare trigonale sau piramidale. Exemple de molecule în formă de T sunt trifluorurile de halogen, cum ar fi ClF3.
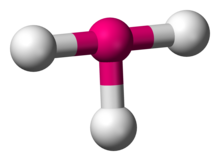
ClF3
C2v
90°, 180°
>0

Potrivit teoriei VSEPR, geometria în formă de T rezultă atunci când trei liganzi și două perechi de electroni solitari sunt legați de atomul central, scris în notația AXE ca AX3E2. Geometria în formă de T este legată de geometria moleculară bipiramidală trigonală pentru moleculele AX5 cu trei liganzi ecuatoriali și doi liganzi axiali. Într-o moleculă AX3E2, cele două perechi lone ocupă două poziții ecuatoriale, iar cei trei atomi de ligand ocupă cele două poziții axiale, precum și o poziție ecuatorială. Cei trei atomi se leagă în unghiuri de 90° de o parte și de alta a atomului central, producând forma T.
Anionul trifluoroxenat(II), XeF-
3, a fost investigat ca un posibil prim exemplu de moleculă AX3E3, care s-ar putea aștepta, prin raționamentul VSEPR, să aibă șase perechi de electroni într-un aranjament octaedric, cu cele trei perechi lone și cei trei liganzi în orientări în formă de mer sau T. Deși acest anion a fost detectat în faza gazoasă, încercările de sinteză în soluție și de determinare experimentală a structurii au fost nereușite. Un studiu de chimie computațională a arătat o geometrie plană distorsionată în formă de Y cu cel mai mic unghi al legăturii F-Xe-F egal cu 69°, în loc de 90° ca în cazul unei geometrii în formă de T.
.