Elementul chimic heliu este clasificat ca fiind un gaz nobil și un nemetal. A fost descoperit în 1895 de către William Ramsay.

Zona de date
| Clasificare: | Heliul este un gaz nobil și un nemetal |
| Culoare: | incolor |
| Greutate atomică: | 4.00260 |
| Stare: | gaz |
| Punct de topire: | -272,2 oC, 0,95 K |
| Nota: La presiunea atmosferică normală, heliul nu se solidifică și deci nu are punct de topire. Punctul de topire citat mai sus este la o presiune de 25 de atmosfere. | |
| Punctul de fierbere: | -268,9 oC, 4.2 K |
| Electroni: | 2 |
| Protoni: | 2 |
| Neutroni în izotopul cel mai abundent: | 2 |
| Învelișuri de electroni: | 2 |
| Configurația electronilor: | 1s2 |
| Densitate la 20oC: | 0.0001787 g/cm3 |
Afișați mai multe, inclusiv: Călduri, Energii, Oxidare,
Reacții, Compuși, Radii, Conductivități
| Volumetrie atomică: | 27,2 cm3/mol | |
| Structură: | de obicei hexagonală în pachete apropiate | |
| (v.presiunea mare necesară pentru solidificarea heliului) | ||
| Capacitatea termică specifică | 5,193 J g-1 K-1 | |
| Căldura de fuziune | 0.0138 kJ mol-1 | |
| Căldura de atomizare | 0 | |
| Căldura de vaporizare | 0.0845 kJ mol-1 | |
| 1-a energie de ionizare | 2372.3 kJ mol-1 | |
| 2-a energie de ionizare | – | |
| 3-a energie de ionizare | – | |
| Afinitatea electronică | 0 kJ mol-.1 | |
| Numărul minim de oxidare | 0 | |
| Numărul minim de oxidare | ||
| Min. număr de oxidare comună | 0 | |
| Număr maxim de oxidare | 0 | |
| Număr maxim de oxidare comună | ||
| Număr maxim de oxidare comună | 0 | |
| Electronegativitate (scara Pauling) | – | |
| Volum de polarizabilitate | 0.198 Å3 | |
| Reacție cu aerul | niciuna | |
| Reacție cu 15 M HNO3 | niciuna | |
| Reacție cu 6 M HCl | nici una | |
| Reacția cu 6 M NaOH | nici una | |
| Oxizi | nici una | |
| Hidruri | Hidruri | niciunul |
| Clorură(s) | niciunul | |
| Rază atomică | 31 pm | |
| Rază ionică (ion 1+) | – | |
| Rază ionică (ion 2+) | – | |
| Rază ionică (ion 3+) | – | |
| Raza ionică (1- ion) | – | |
| Raza ionică (2- ion) | – | |
| Raza ionică (3- ion) | – | |
| Conductivitatea termică | 0.15 W m-1 K-1 | |
| Conductivitate electrică | – | |
| Punctul de congelare/fundare: | -272,2 oC, 0.95 K |

Nasa: Atomii de heliu ionizat la aproximativ 60.000 °C din cromosfera Soarelui emit lumina ultravioletă care se vede în această imagine.
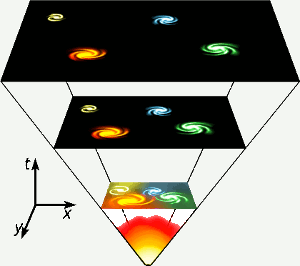
Heliul a fost creat în primele trei minute de existență a universului, când temperaturile de pretutindeni erau suficient de ridicate pentru ca fuziunea nucleară să aibă loc. Această fază scurtă, de mare energie, este reprezentată chiar în partea de jos a diagramei. De asemenea, heliul este produs prin fuziunea nucleară a hidrogenului în stele precum cea a noastră. Imagine: Gnixon
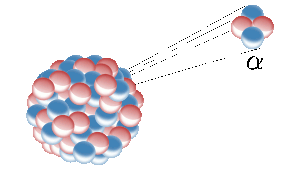
Heliul de pe Pământ provine din fisiunea nucleară a unor elemente radioactive precum uraniul. Aici, un nucleu radioactiv emite un nucleu de heliu (cunoscut și sub numele de particulă alfa). Imagine: Inductiveload

Spectrul heliului cu o linie galbenă proeminentă. Imagine: Nasa

William Ramsay arătând coloana finală a tabelului periodic care conține gazele nobile (sau inerte). Ramsay a fost distins cu Premiul Nobel pentru Chimie în 1904 pentru activitatea sa în descoperirea gazelor inerte. Imagine: Vanity Fair
Descoperirea heliului
Povestea descoperirii heliului este împletită cu cea a descoperirii naturii stelelor.
La un moment dat, oamenii credeau că nu vom ști niciodată din ce sunt făcute stelele. În 1835, filozoful francez Auguste Comte a declarat: „nu vom putea niciodată, prin niciun mijloc, să le studiem compoziția chimică”. (1)
Comte credea că vom putea afla ce este compoziția stelelor doar dacă o vom putea aduce în laborator.
În ciuda pesimismului lui Comte, metoda de descoperire a heliului și a compoziției stelelor fusese deja găsită. În 1814, fizicianul german Joseph Fraunhofer preluase metoda lui Isaac Newton de divizare a luminii solare cu ajutorul unei prisme și făcuse un progres crucial. Fraunhofer a observat linii întunecate în curcubeul de culori provenind din lumina solară divizată de o prismă; liniile pe care le-a văzut au reprezentat prima observație a spectrului unei stele. (2), (3)
În 1859/60 savanții germani Gustav Kirchhoff și Robert Bunsen au făcut salturi enorme în știința spectroscopiei, inclusiv descoperirea că liniile întunecate pe care le văzuse Fraunhofer erau ca o amprentă digitală a unei substanțe.
Scena era pregătită pentru ca Kirchhoff și Bunsen să descopere noi elemente studiind lumina provenită de la substanțe atunci când acestea ardeau.
În 1860 au descoperit cesiu prin liniile sale spectrale albastre și în 1861 rubidiu prin două linii spectrale roșii. Apoi, William Crookes a descoperit taliul în 1861 după ce a observat o linie spectrală verde strălucitoare.
Kirchhoff și Bunsen au analizat spectrul soarelui și au putut concluziona că fierul era prezent în atmosfera sa incandescentă. (4)
Pentru descoperirea heliului au mai fost necesari câțiva ani. În august 1868 urma să aibă loc prima eclipsă totală de la publicarea lucrărilor lui Kirchhoff și Bunsen.
Astronomul francez Pierre Janssen aștepta o eclipsă pentru a observa proeminențele din coroana solară cu ajutorul unui spectroscop. În cele două săptămâni care au urmat eclipsei, Janssen a dezvoltat o metodă de înregistrare a spectrelor prominențelor fără a fi nevoie de o eclipsă. În aceste spectre, el a observat o linie galbenă. (5)
Linia se afla într-o poziție similară, dar nu identică cu liniile din spectrul sodiului. Acestea au fost numite liniile D1 și D2. Omul de știință englez Norman Lockyer a studiat noua linie galbenă; mai târziu avea să se numească linia D3. el a publicat studiul său asupra liniei, conștient că aceasta ar putea fi cauzată de un nou element:
„…așa că atunci am știut că nu aveam de-a face cu hidrogenul; prin urmare, trebuia să avem de-a face cu un element pe care nu-l puteam obține în laboratoarele noastre și, prin urmare, mi-am asumat responsabilitatea de a inventa cuvântul heliu, în primul rând pentru uzul de laborator”. (6)
Numele heliu provine de la cuvântul grecesc pentru soare, helios.
Lockyer și Edward Frankland, colegul său, au avut o serie de alte idei cu privire la posibilele cauze ale liniei galbene și, prin urmare, nu au anunțat un nou element.
Până în 1871, alți oameni de știință au fost conștienți de situație. Lordul Kelvin a discutat despre „reflectarea luminii hidrogenului incandescent și a „heliului” în jurul soarelui”. Folosirea cuvântului „heliu” este urmată de o notă de subsol pentru a-l explica:
„Frankland și Lockyer constată că proeminențele galbene dau o linie luminoasă foarte hotărâtă nu departe de D, dar care până acum nu a fost identificată cu nici o flacără terestră. Aceasta pare să indice o nouă substanță, pe care ei propun să o numească Heliu.” (7)
Existența Heliului nu a fost, totuși, acceptată de toată lumea. (5)
Toate îndoielile au fost risipite atunci când chimistul scoțian William Ramsay a izolat heliul în 1895 la Londra. Ramsay co-dezvăluise argonul în 1894; argonul a fost primul dintre gazele nobile care a fost descoperit. În 1895, el a citit o lucrare a lui William Hillebrand care descria un gaz nereactiv care era eliberat atunci când se adăuga acid la mineralul de uraniu, uranitul. Hillebrand credea că acest gaz era azot.
Ramsay, care credea că gazul ar putea conține argon, a repetat experimentul lui Hillebrand folosind un alt mineral de uraniu, cleveitul, și a colectat gazul.
Spectroscopul său a indicat prezența azotului, a argonului și a unui alt gaz. Ramsay a suspectat că ar putea fi heliu, deoarece părea să existe o linie D3. (8) Conștient că Lockyer și William Crookes aveau un spectroscop mai bun decât al său, el le-a trimis o mostră de gaz. Din nefericire, proba nu era potrivită, așa că Lockyer a obținut o mostră de uranit, a extras gazul și l-a studiat la spectroscop. El scrie: (8)
„Una câte una, liniile necunoscute pe care le observasem în soare în 1868 s-au dovedit a aparține gazului.”
Spectrul gazului era identic cu cel al „heliului” din soare. Un nou element și-a câștigat locul în tabelul periodic.
Vizitați pagina Chemicool’s Cool Helium Facts Page.

Aparență și caracteristici
Efecte nocive:
Nu se știe dacă heliul este toxic.
Caracteristici:
Heliul este un gaz ușor, inodor, incolor, inert, monatomic. Poate forma molecule diatomice, dar numai slab și la temperaturi apropiate de zero absolut.
Heliul are cel mai mic punct de topire dintre toate elementele, iar punctul său de fierbere este apropiat de zero absolut.
Spre deosebire de orice alt element, heliul nu se solidifică, ci rămâne un lichid până la zero absolut (0 K) la presiuni obișnuite.
Vocea cuiva care a inhalat temporar heliu sună ascuțit.
Utilizări ale heliului
Imagistica prin rezonanță magnetică (IRM) este cel mai mare utilizator de heliu. Heliul este folosit pentru a răci magneții supraconductori ai scanerelor RMN.
Heliul este folosit pentru umplerea baloanelor (dirijabile) și pentru presurizarea rachetelor cu combustibil lichid.
Amestecuri de heliu și oxigen sunt folosite ca „aer” artificial pentru scafandri și alte persoane care lucrează sub presiune. Heliul este folosit în locul azotului din aerul normal deoarece, după o scufundare îndelungată, heliul părăsește corpul mai repede decât azotul, permițând o decompresie mai rapidă.
Heliul este folosit ca scut gazos în apropierea sudării cu arc electric, prevenind, de exemplu, orice reacție a sudurilor metalice fierbinți cu oxigenul. Gazul este utilizat în industria semiconductorilor pentru a asigura o atmosferă inertă pentru creșterea cristalelor de siliciu și germaniu. Este, de asemenea, utilizat ca gaz de înaltă temperatură în producția de titan și zirconiu și ca gaz purtător în cromatografia în fază gazoasă.
Abundanță și izotopi
Abundanță scoarța terestră: 8 părți pe miliard în greutate, 43 părți pe miliard în moli
Abundență sistem solar: 23 % în greutate, 7,4 % în moli
Cost, pur: 5,2 $ pe 100g
Cost, vrac: $ pe 100g
Sursa: Aproape tot heliul de pe Pământ este rezultatul dezintegrării radioactive. Principalele surse de heliu provin din depozitele de gaze naturale din puțuri din Texas, Oklahoma și Kansas. Heliul este extras prin distilarea fracționată a gazului natural, care conține până la 7% heliu.
Izotopi: Heliul are 8 izotopi ale căror perioade de înjumătățire sunt cunoscute, cu numere de masă de la 3 la 10. Heliul natural este un amestec al celor doi izotopi stabili ai săi, 3He și 4He, cu abundențe naturale de 0,0001% și, respectiv, 99,999%.

- Auguste Comte, Cours de Philosophie Positive at Project Gutenberg
- Keith J. Laidler, The World of Physical Chemistry, 1993, p179.
- The Era of Classical Spectroscopy, din MIT Spectroscopy.
- Gerard G. Emch, Mathematical and Conceptual Foundations of 20th-Century Physics, 1984, Elsevier Science Publishers, p211
- Helge Kragh, The Solar Element: A Reconsideration of Helium’s Early History., 2009, Annals of Science, 66:2, p157-182.
- J. Norman Lockyer, The Growth of our Knowledge of Helium., Science Progress, 1896, Vol 5., p249
- W. Thomson, Discurs prezidențial, British Association for the Advancement of Science, 1871, (Discurs. XCIX).
- Sir Norman Lockyer, The Sun’s Place in Nature…, 1897, p47-48
Citează această pagină
Pentru o legătură online, vă rugăm să copiați și să lipiți una dintre următoarele:
<a href="https://www.chemicool.com/elements/helium.html">Helium</a>
sau
<a href="https://www.chemicool.com/elements/helium.html">Helium Element Facts</a>
Pentru a cita această pagină într-un document academic, vă rugăm să folosiți următoarea citare conform MLA:
"Helium." Chemicool Periodic Table. Chemicool.com. 17 Oct. 2012. Web. <https://www.chemicool.com/elements/helium.html>.
.