Klasser av kristallina fasta ämnen
Kristallina ämnen kan beskrivas med hjälp av de olika typerna av partiklar som ingår i dem och de olika typerna av kemiska bindningar som sker mellan partiklarna. Det finns fyra typer av kristaller: Det finns fyra typer av kristaller: (1) joniska, (2) metalliska, (3) kovalenta nätverk och (4) molekylära. Egenskaper och flera exempel på varje typ anges i följande tabell och beskrivs i tabellen nedan.
| Typ av kristallint fast ämne | Exempel (formler) | Smältpunkt (°C) | Normal kokpunkt (°C) |
|---|---|---|---|
| Ioniska | \(\ce{NaCl}\) | 801 | 1413 |
| \(\ce{CaF_2}\) | 1418 | 1533 | |
| Metallic | \(\ce{Hg}\) | -39 | 630 |
| \(\ce{Na}\) | 371 | 883 | |
| \(\ce{Au}\) | 1064 | 2856 | |
| \(\ce{W}\) | 3410 | 5660 | |
| Kovalent nätverk | \(\ce{B}\) | 2076 | 3927 |
| \(\ce{C}\) (diamant) | 3500 | 3930 | |
| \(\ce{SiO_2}\) | 1600 | 2230 | |
| Molekylär | \(\ce{H_2}\) | -259 | -253 |
| \(\ce{I_2}\) | 114 | 184 | |
| \(\ce{NH_3}\) | -78 | -33 | |
| \(\ce{H_2O}\) | 0 | 100 |
Ioniska kristaller – Den joniska kristallstrukturen består av omväxlande positivt laddade katjoner och negativt laddade anjoner (se figur nedan). Jonerna kan antingen vara monatomära eller polyatomära. I allmänhet bildas joniska kristaller av en kombination av metaller i grupp 1 eller 2 och icke-metaller i grupp 16 eller 17 eller icke-metalliska polyatomära joner. Joniska kristaller är hårda och spröda och har höga smältpunkter. Joniska föreningar leder inte elektricitet som fasta ämnen, men leder elektricitet när de är smälta eller i vattenlösning.
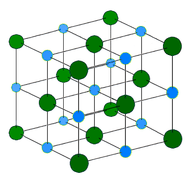
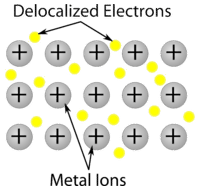
Metallkristall – Metalliska kristaller består av metallkatjoner som är omgivna av ett ”hav” av rörliga valenselektroner (se figuren nedan). Dessa elektroner, även kallade delokaliserade elektroner, tillhör inte någon enskild atom utan kan röra sig genom hela kristallen. Därför är metaller goda ledare för elektricitet. Som framgår av tabellen ovan spänner smältpunkterna för metalliska kristaller över ett stort område.
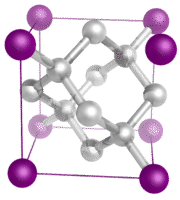
Kovalenta nätverkskristaller – En kovalent nätverkskristall består av atomer vid kristallens gitterpunkter, där varje atom är kovalent bunden till sina närmaste grannatomer (se figuren nedan). Det kovalent bundna nätverket är tredimensionellt och innehåller ett mycket stort antal atomer. Bland nätverksförekomsterna finns diamant, kvarts, många metalloider och oxider av övergångsmetaller och metalloider. Nätverksfasta ämnen är hårda och spröda och har extremt höga smält- och kokpunkter. Eftersom de består av atomer snarare än joner leder de inte elektricitet i något tillstånd.
Molekylära kristaller – Molekylära kristaller består vanligtvis av molekyler vid kristallens gitterpunkter, som hålls samman av relativt svaga intermolekylära krafter (se figuren nedan). De intermolekylära krafterna kan vara dispersionskrafter när det gäller opolära kristaller, eller dipol-dipolkrafter när det gäller polära kristaller. Vissa molekylära kristaller, t.ex. is, har molekyler som hålls samman av vätebindningar. När en av ädelgaserna kyls ned och stelnar är gitterpunkterna enskilda atomer snarare än molekyler. I alla fall är de intermolekylära krafter som håller ihop partiklarna mycket svagare än antingen joniska eller kovalenta bindningar. Som ett resultat av detta är smält- och kokpunkterna för molekylära kristaller mycket lägre. Eftersom molekylära kristaller saknar joner eller fria elektroner är de dåliga elektriska ledare.

Några allmänna egenskaper hos de fyra huvudklasserna av fasta ämnen sammanfattas i tabell \(\PageIndex{2}\).
| Ioniska fasta ämnen | Molekylära fasta ämnen | Kovalenta fasta ämnen | Metalliska fasta ämnen | |
|---|---|---|---|---|
| *Många undantag finns. Grafit har till exempel en relativt hög elektrisk ledningsförmåga inom kolplanen, och diamant har den högsta värmeledningsförmågan av alla kända ämnen. | ||||
| dåliga ledare för värme och elektricitet | dåliga ledare för värme och elektricitet | dåliga ledare för värme och elektricitet* | goda ledare för värme och elektricitet | |
| relativt hög smältpunkt | låg smältpunkt | hög smältpunkt | Smältpunkterna beror starkt på elektronkonfigurationen | |
| hård men spröd; splittras under påfrestningar | mjuk | mycket hård och spröd | lätt deformeras under påfrestningar; Duktil och formbar | |
| relativt tät | låg densitet | låg densitet | låg densitet | vanligtvis hög densitet |
| tråkig yta | dålig yta | dålig yta | ljusaktig | |
Exempel \(\PageIndex{1}\)
Klassificera \(\ce{Ge}\), \(\ce{RbI}\), \(\ce{C6(CH3)6}\) och \(\ce{Zn}}\) som joniska, molekylära, kovalenta eller metalliska fasta ämnen och ordna dem i ordning efter stigande smältpunkt.
Givet: föreningar
Sökt: klassificering och ordning av smältpunkter
Strategi:
- Lokalisera det eller de ingående grundämnena i det periodiska systemet. Utifrån deras positioner kan du förutsäga om varje fast ämne är joniskt, molekylärt, kovalent eller metalliskt.
- Sätt fastämnena i en ordning med stigande smältpunkter utifrån din klassificering, med början med molekylära fastämnen.
Lösning:
A. Germanium ligger i p-blocket strax under Si, längs den diagonala linjen av halvmetalliska grundämnen, vilket tyder på att elementärt Ge sannolikt har samma struktur som Si (diamantstrukturen). Ge är således troligen ett kovalent fast ämne.
RbI innehåller en metall från grupp 1 och en ickemetall från grupp 17, så det är ett joniskt fast ämne som innehåller Rb+- och I-joner.
Föreningen \(\ce{C6(CH3)6}\) är ett kolväte (hexametylbensen), som består av isolerade molekyler som staplas på varandra för att bilda ett molekylärt fast ämne utan några kovalenta bindningar mellan dem.
Zn är ett grundämne i d-blocket, så det är ett metalliskt fast ämne.
B. Att ordna dessa ämnen i ordning efter stigande smältpunkt är okomplicerat, med ett undantag. Vi förväntar oss att C6(CH3)6 ska ha den lägsta smältpunkten och Ge den högsta smältpunkten, med RbI någonstans däremellan. Metallernas smältpunkter är dock svåra att förutsäga utifrån de modeller som hittills presenterats. Eftersom Zn har ett fyllt valensskal bör det inte ha en särskilt hög smältpunkt, så en rimlig gissning är
C6(CH3)6 < Zn ~ RbI < Ge.
De faktiska smältpunkterna är C6(CH3)6, 166°C; Zn, 419°C; RbI, 642°C; och Ge, 938°C. Detta stämmer överens med vår förutsägelse.
Övningsuppgift \(\PageIndex{1}\)
Klassificera CO2, BaBr2, GaAs och AgZn som joniska, kovalenta, molekylära eller metalliska fasta ämnen och ordna dem sedan i ordning efter stigande smältpunkter.
Svar
CO2 (molekylär) < AgZn (metallisk) ~ BaBr2 (jonisk) < GaAs (kovalent).
De faktiska smältpunkterna är: CO2, ca -15,6°C; AgZn, ca 700°C; BaBr2, 856°C; och GaAs, 1238°C.