L’obiettivo principale del trapianto di pancreas è quello di migliorare il diabete mellito insulino-dipendente (tipo 1 o tipo 2) e produrre una completa indipendenza dall’insulina iniettata. Il trapianto simultaneo pancreas-rene (SPK) (vedi l’immagine qui sotto) è l’opzione primaria se il paziente ha anche una nefropatia diabetica e si qualifica per un trapianto di rene. Il primo trapianto di pancreas umano di successo insieme a un trapianto di rene è stato eseguito all’Università del Minnesota dal Dr. William Kelly e dal Dr. Richard Lilleheiat dell’Università del Minnesota. Nel 2015, 947 trapianti di pancreas sono stati eseguiti negli Stati Uniti.
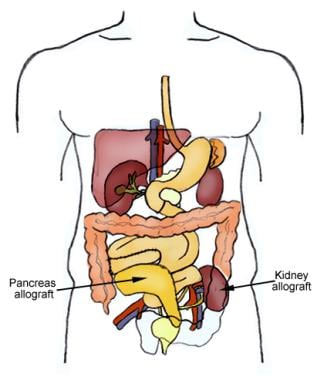 Posizionamento dell’allotrapianto rene-pancreas
Posizionamento dell’allotrapianto rene-pancreas Si stima che 30,3 milioni di persone-9,4% della popolazione totale degli Stati Uniti abbia il diabete mellito. Tuttavia, 1 adulto colpito su 4 non sa di avere il diabete, e degli 84,1 milioni di adulti americani con prediabete, solo l’11,6% è consapevole della propria condizione. La nefropatia diabetica è la principale causa di malattia renale cronica negli Stati Uniti, e ogni anno, oltre 50.000 persone sviluppano la malattia renale allo stadio finale (ESRD) con il diabete come causa primaria.
Questo articolo si concentra principalmente sul trapianto di pancreas. Per una discussione completa sul trapianto di rene, vedere Trapianto di rene pediatrico e Trapianto di rene.
Forme di trapianto di pancreas
Un pancreas del donatore può essere usato per la terapia endocrina sostitutiva in uno dei seguenti modi:
1. Trapianto di pancreas da solo (PTA): Indicato per i pazienti con diabete di tipo 1 che hanno frequenti episodi di ipoglicemia con o senza inconsapevolezza, compromissione della qualità della vita o altri problemi di tolleranza alla terapia insulinica. Questi pazienti hanno una funzione renale adeguata e il trapianto di rene non è indicato.
2. Trapianto SPK: Gli organi provengono dallo stesso donatore. L’uso primario è stato in pazienti con diabete di tipo 1 che hanno un tasso di filtrazione glomerulare stimato (eGFR) di 2</sup> o sono in terapia sostitutiva renale.
3. Pancreas dopo trapianto di rene (PAK): Trapianto di pancreas da donatore deceduto dopo un precedente trapianto di rene; le indicazioni sono simili a quelle del PTA
4. Trapianto di cellule pancreatiche: Offre una minore morbilità ma risultati a lungo termine inferiori rispetto al trapianto di organi solidi (pancreas).
Circa l’80% dei trapianti di pancreas viene eseguito come trapianto SPK. Circa il 10% dei trapianti di pancreas sono eseguiti come un trapianto PAK dopo un trapianto di rene precedentemente riuscito da un donatore vivente o deceduto. I casi rimanenti sono eseguiti come PTA. Nel 2015, 80 PTA sono stati eseguiti negli Stati Uniti.
Il trapianto di pancreas e di isole può essere considerato un’opzione di trapianto complementare e sottoporsi all’uno o all’altro non si esclude a vicenda. In un’analisi di 40 trapianti di pancreas (50% PTA, 27,5% SPK, 22,5% PAK) dopo un fallimento del trapianto di cellule delle isole, i tassi di sopravvivenza globale (97% a 1 anno e 83% a 5 anni) non erano influenzati negativamente.
Test di valutazione del trapianto
Nella valutazione di un paziente per il trapianto di SPK, la quantificazione del fabbisogno giornaliero di insulina e i livelli sierici di C-peptide a digiuno sono utilizzati per determinare il tipo di diabete presente, la gravità dell’insulino-resistenza e il possibile beneficio del trapianto di pancreas. Un paziente altamente resistente all’insulina avrà un elevato fabbisogno di insulina (>1-1,5 unità/kg) e un elevato livello di C-peptide a digiuno (>4 ng/mL). Questi pazienti potrebbero rimanere insulino-dipendenti nonostante un trapianto di pancreas.
Tuttavia, questi valori devono essere considerati nel quadro clinico complessivo. Per esempio, un paziente in dialisi peritoneale con un dialisato contenente destrosio avrà un maggiore fabbisogno di insulina che diminuirà quando il trapianto di rene eliminerà la necessità della dialisi. Il C-peptide non è un marcatore esatto nei pazienti con malattia renale cronica perché ha una clearance variabile in questi pazienti. Inoltre, in un paziente che sta assumendo insulina, il livello di C-peptide sarà falsamente basso se il campione viene prelevato quando il paziente è ipoglicemico; quindi, il risultato del C-peptide deve essere interpretato alla luce di una misurazione concomitante del glucosio.
L’emoglobina A1C dovrebbe essere misurata, per valutare la gravità del diabete del paziente.
Se il paziente ha un diabete di tipo 1, considerare la valutazione basale dei marcatori autoimmuni, compresi gli anticorpi contro la decarbossilasi dell’acido glutammico. Un aumento del livello di anticorpi dopo il trapianto di pancreas suggerirebbe una possibile disfunzione dell’innesto del pancreas e un’iperglicemia dovuta a una reazione autoimmune in opposizione al rigetto.
Indicazioni e controindicazioni
Il numero di trapianti di pancreas è diminuito ogni anno dal 2004, quando ne sono stati eseguiti circa 1500; nel 2016 sono stati eseguiti 181 trapianti di pancreas. Il trapianto multiorgano più comune è quello rene-pancreas, con quasi 23.000 eseguiti tra il 1988 e il 2017. Nel 2016, sono stati eseguiti 795 trapianti di SPK. I pazienti con diabete di tipo 2 hanno costituito il 12,5% dei trapianti SPK.
United Network of Organ Sharing (UNOS) elencherà un potenziale candidato al trapianto di pancreas se il paziente soddisfa uno dei seguenti criteri di ammissibilità :
-
Insulino-dipendente con un C-peptide di 2 ng/mL o meno (pazienti con diabete di tipo 1)
-
Insulino-dipendente con un C-peptide maggiore di 2 ng/mL e un indice di massa corporea 2</sup> (presumibilmente pazienti con diabete di tipo 2)
Il medico deve essere consapevole del quadro clinico quando interpreta questi valori, come notato sopra.L’uso del C-peptide è controverso.
Questi sono i criteri per il tipo specifico di trapianto di pancreas:
-
PTA – Complicazioni metaboliche acute frequenti, tra cui ipoglicemia o chetoacidosi, incapacità di tollerare la terapia insulinica esogena, e persistenza di complicazioni acute nonostante la gestione basata sull’insulina
-
SPK – ESRD e idoneità al trapianto di pancreas
-
PAK – Idoneità al trapianto di pancreas e un precedente trapianto di rene riuscito
Il paziente idoneo dovrà anche essere sottoposto a una valutazione medica appropriata in particolare per la stratificazione del rischio cardiovascolare e la malattia vascolare periferica. Dovranno anche mostrare una storia di conformità medica. Il limite di età storico per il trapianto di pancreas, che alcuni centri hanno continuato ad impiegare, è di 55 anni. Tuttavia, il numero di destinatari di trapianti di pancreas di età superiore ai 55 anni è aumentato costantemente. Nel 2016, il 24,5% di tutti i destinatari di trapianto di pancreas avevano più di 50 anni (PTA: 38,3%, SPK: 22,7%, PAK: 25,7%). La sopravvivenza dei pazienti è paragonabile per i riceventi di trapianto di pancreas più giovani e più anziani, ma i riceventi più anziani hanno avuto eventi cardiovascolari più frequenti.
Le controindicazioni assolute, come segue, sono simili a quelle per altri trapianti di organi solidi:
-
Eccessivo rischio cardiovascolare
-
Malignità attive o infezioni che dovrebbero essere trattate e chiarite prima del trapianto
-
Alti fattori di rischio sociale come la non aderenza ai farmaci, mancanza di assicurazione e uso di droghe illecite
Le controindicazioni relative includono quanto segue:
-
Indice di massa corporea superiore a 30 kg/m 2
-
Fabbisogno di insulina di >1.5 U/kg al giorno
-
Malattia cerebrovascolare, aortica/iliaca, cardiovascolare o vascolare periferica
Benefici del trapianto di pancreas
Le complicazioni microvascolari del diabete sono direttamente correlate alla concentrazione di glucosio. Pertanto, la normalizzazione del glucosio attraverso un trapianto di pancreas di successo potrebbe essere previsto per stabilizzare o invertire le complicazioni microvascolari. I benefici risultanti dal trapianto di pancreas e reni sono discussi di seguito.
Retinopatia diabetica
La maggior parte dei candidati al trapianto di pancreas hanno avuto il diabete per 20-25 anni in media prima di essere presi in considerazione per il trapianto e, di conseguenza, molti di loro hanno avuto un intervento laser per la retinopatia. Questo è stato un risultato comune peritrapianto nella maggior parte degli studi. La gravità di questi cambiamenti oftalmologici può ovviare a un chiaro effetto salutare del trapianto di PTA o SPK sulla retinopatia.
Gli studi suggeriscono, tuttavia, che la retinopatia può migliorare 3 anni dopo la SPK e che la necessità di ulteriori interventi laser è minore dopo la SPK rispetto al solo trapianto di rene (KTA). Si pensa che il trapianto di pancreas e il mantenimento di uno stato euglicemico al minimo stabilizzi la retinopatia diabetica. Sono necessari studi prospettici per confrontare i due gruppi, perché la maggior parte degli studi non ha avuto gruppi di controllo sufficienti.
Nefropatia diabetica
Un numero significativo di candidati al trapianto di pancreas ha una malattia renale avanzata. Lo scenario più comune per il trapianto di pancreas è in combinazione con un trapianto di rene per trattare pazienti con uremia diabetica. SPK aiuterebbe a prevenire gli effetti deleteri del diabete sul nuovo trapianto di rene.
Gli studi che hanno confrontato la funzione renale nei destinatari del trapianto SPK rispetto ai destinatari diabetici KTA non hanno dimostrato differenze significative durante il primo periodo post-trapianto. Tuttavia, la nefropatia diabetica ricorrente si osserva già 2 anni dopo il KTA in un ricevente diabetico o al fallimento dell’innesto del pancreas dopo l’SPK, ma non è mai stata riportata con un trapianto SPK funzionante. I pazienti con un trapianto di pancreas hanno dimostrato di avere una progressione o inversione ritardata della nefropatia diabetica.
Neuropatia diabetica
La neuropatia migliora dopo il trapianto di rene e pancreas, suggerendo che l’insufficienza renale e il diabete contribuiscono alla neuropatia sensoriale comunemente osservata al momento del trapianto. Le neuropatie autonome come la gastroparesi richiedono anni per svilupparsi e possono essere difficili da quantificare. Tuttavia, un miglioramento oggettivo dei risultati neuropatici autonomici è stato riportato 4 anni dopo la SPK e si è notato che è maggiore dopo la SPK che dopo la KTA.
Retinopatia diabetica
La retinopatia diabetica è una scoperta pervasiva nei pazienti con diabete e ESRD. Si può osservare una significativa perdita della vista/cecità. La cecità non è una controindicazione assoluta al trapianto, perché molti pazienti ciechi conducono una vita molto indipendente.
Malattia cardiovascolare
La malattia cardiovascolare è la causa più comune di morte nei pazienti con diabete con insufficienza renale. Pochi studi prospettici hanno esaminato la relazione tra l’instaurazione della normoglicemia nei pazienti con diabete a lungo termine e una riduzione della morbilità e mortalità cardiovascolare. In uno studio trasversale, la frazione di eiezione ventricolare sinistra era più alta, il rapporto tra velocità di riempimento e velocità di eiezione di picco era maggiore e la dilatazione endotelio-dipendente dell’arteria brachiale era migliore nei destinatari di SPK rispetto ai pazienti con diabete di tipo 1 che avevano ricevuto KTA. Altre prove mostrano che il trapianto di SPK riduce i tassi di morte cardiovascolare con una concomitante riduzione della pressione sanguigna.
Un altro studio ha osservato una maggiore diminuzione della massa ventricolare sinistra e una maggiore normalizzazione della disfunzione diastolica nei destinatari di SPK rispetto a quelli sottoposti a KTA. In questo rapporto, l’ecocardiografia bidimensionale (2-D) e M-mode è stata eseguita prima e 1 anno dopo il trapianto nei riceventi SPK e KTA. Un ampio studio retrospettivo ha suggerito un’associazione con riduzioni dell’incidenza di infarto miocardico, edema polmonare acuto e ipertensione nei riceventi SPK rispetto a quelli KTA.
La malattia coronarica (CAD) è la comorbidità più importante da considerare nei pazienti con diabete di tipo 1 e nefropatia diabetica. Si stima che i pazienti con diabete e ESRD abbiano un rischio di eventi cardiovascolari 50 volte maggiore rispetto alla popolazione generale. La prevalenza di una CAD significativa (>50% di stenosi) nei pazienti con diabete che iniziano il trattamento per ESRD è stimata al 45-55%. A causa della neuropatia diabetica, i pazienti possono non avvertire l’angina durante gli episodi di ischemia miocardica.
Il tasso di ictus e di attacchi ischemici transitori è aumentato nei pazienti con ESRD e diabete. I decessi legati alla malattia vascolare cerebrale nei pazienti con ESRD sono circa due volte più comuni in quelli con diabete che in quelli senza diabete. Gli ictus si verificano più frequentemente e ad un’età più giovane nei pazienti con diabete che nei pazienti non diabetici, abbinati per età e sesso.
La malattia vascolare periferica
La malattia vascolare periferica dell’estremità inferiore è significativa nei pazienti con diabete. I pazienti con ESRD sono a rischio di amputazione di un’estremità inferiore. Questi problemi iniziano tipicamente con un’ulcera del piede associata a una neuropatia somatosensoriale avanzata.
La neuropatia autonomica
La neuropatia autonomica è prevalente e può manifestarsi come gastropatia, cistopatia e ipotensione ortostatica. L’estensione della neuropatia autonoma diabetica è spesso sottovalutata.
L’alterazione dello svuotamento gastrico (gastroparesi) è una considerazione importante a causa delle sue significative implicazioni per il decorso post-trapianto. I pazienti con gastroparesi grave possono avere difficoltà a tollerare i farmaci immunosoppressivi orali che sono essenziali per prevenire il rigetto degli organi trapiantati. Episodi di deplezione di volume con azotemia associata si verificano frequentemente in pazienti con trapianti di SPK. La morbilità gastrointestinale è un’indicazione comune per la riammissione dopo il trapianto di pancreas.
La disfunzione neurogenica della vescica è una considerazione importante nei pazienti sottoposti a trapianto di pancreas da solo o di SPK. L’incapacità di percepire la pienezza della vescica e di svuotarla predispone ad alti residui postvoidali e alla possibilità di reflusso vescico-ureterale. Questo può influenzare negativamente la funzione dell’allotrapianto renale, aumentare l’incidenza delle infezioni della vescica e della pielonefrite e predisporre alla pancreatite da innesto.
La combinazione di ipotensione ortostatica e ipertensione supina deriva dalla disregolazione del tono vascolare. Questo ha implicazioni per il controllo della pressione sanguigna dopo il trapianto, specialmente nei pazienti con trapianti di pancreas drenati dalla vescica che sono predisposti alla deplezione di volume. Pertanto, è importante un’attenta rivalutazione del fabbisogno di farmaci antipertensivi post-trapianto.
Neuropatie sensoriali e motorie
Queste condizioni sono comuni nei pazienti con diabete di lunga data. Questo può avere implicazioni per la riabilitazione dopo il trapianto. La neuropatia periferica è anche un indicatore dell’aumento del rischio di lesioni ai piedi e delle conseguenti ulcere del piede diabetico.
Malattie mentali o emotive
Le malattie mentali, comprese le nevrosi e la depressione, sono comuni nella popolazione diabetica insulino-dipendente. La diagnosi e il trattamento appropriato di queste malattie prima di ottenere un trapianto di pancreas possono migliorare significativamente la compliance medica.
Risultati
La valutazione dei tassi di risultato del trapianto di pancreas è stata ostacolata dalla mancanza di uniformità nei criteri di fallimento dell’innesto. Alcuni programmi non riportano un fallimento dell’innesto se la produzione di C-peptide continua, mentre altri riportano un fallimento dell’innesto se il ricevente non è più indipendente dall’insulina. Il comitato OPTN/UNOS Pancreas Transplantation ha proposto le seguenti definizioni più precise per il fallimento dell’innesto del pancreas, che sono attualmente in attesa di attuazione:
-
Rimozione del pancreas trapiantato
-
Nuova registrazione per un trapianto di pancreas
-
Registrazione per un trapianto di isole dopo aver ricevuto un trapianto di pancreas
-
Uso di insulina di ≥0.5 unità/kg/die per 90 giorni consecutivi
-
Morte del ricevente
Il numero di riceventi vivi con un allotrapianto di pancreas funzionante ha continuato ad aumentare negli ultimi dieci anni e ha superato i 18.000 nel 2016. La mortalità è diminuita costantemente tra tutti i gruppi di trapianto di pancreas come risultato di regimi immunosoppressivi più sicuri ed efficaci. La mortalità a un anno per il PTA è diminuita dal 4,6% nel 2012-2013 allo 0,8% per i trapianti eseguiti nel 2014-2015. Per la SPK, i tassi di sopravvivenza a 5 anni dei pazienti erano simili nei pazienti con diabete di tipo 1 e di tipo 2 (90,5% e 91,5% rispettivamente), nonostante l’età più avanzata e la comorbidità associata al diabete di tipo 2. Ciò è probabilmente dovuto alla selezione di candidati con diabete di tipo 2 il cui stato cardiovascolare può tollerare gli alti rischi operativi.
Il maggior rischio di perdita dell’innesto è entro il primo anno post-trapianto e in particolare nei primi 3 mesi, indipendentemente dal tipo di trapianto di pancreas. Le analisi dei dati dell’International Pancreas Transplant Registry hanno utilizzato l’indipendenza dall’insulina come criterio principale per la sopravvivenza degli innesti. I migliori tassi di sopravvivenza del pancreas trapiantato con SPK sono stati dell’86% a un anno e del 73% a 5 anni. I risultati dell’SPK sono superiori a quelli del trapianto PAK e PTA. Un vantaggio del trapianto SPK è che il rigetto acuto può essere rilevato più facilmente, perché la creatinina sierica può essere usata come marcatore.
Nel trapianto PAK, i tassi di sopravvivenza del pancreas a 1 anno e a 5 anni sono rispettivamente dell’80% e del 58%. Per il PTA, i tassi comparabili sono 77% e 56%.
I tassi di rigetto acuto sono simili per SPK e PAK a circa il 4% per ciascuno. L’emivita stimata degli innesti è migliorata nel corso degli anni, con SPK che dura circa 14 anni, PAK 7 anni e PTA 7 anni.