L’objectif principal de la greffe de pancréas est d’améliorer le diabète sucré insulinodépendant (type 1 ou type 2) et de produire une indépendance complète vis-à-vis de l’insuline injectée. La transplantation simultanée pancréas-rein (SPK) (voir l’image ci-dessous) est la première option si le patient souffre également d’une néphropathie diabétique et s’il remplit les conditions requises pour une transplantation rénale. La première transplantation réussie de pancréas humain en même temps qu’une transplantation rénale a été réalisée à l’Université du Minnesota par les docteurs William Kelly et Richard Lilleheiat l’Université du Minnesota. En 2015, 947 greffes de pancréas ont été réalisées aux États-Unis.
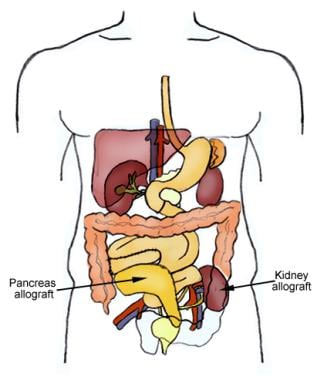 Placement d’allogreffe rein-pancréas
Placement d’allogreffe rein-pancréas On estime que 30,3 millions de personnes – 9,4% de la population totale des États-Unis – souffrent de diabète sucré. Cependant, 1 adulte touché sur 4 ignore qu’il est diabétique, et sur les 84,1 millions d’adultes américains atteints de prédiabète, seuls 11,6% sont conscients de leur état. La néphropathie diabétique est la principale cause de maladie rénale chronique aux États-Unis, et chaque année, plus de 50 000 personnes développent une insuffisance rénale terminale (IRT) dont le diabète est la cause principale.
Cet article se concentre principalement sur la transplantation du pancréas. Pour une discussion complète sur la transplantation rénale, voir Transplantation rénale pédiatrique et Transplantation rénale.
Formes de transplantation du pancréas
Un pancréas de donneur peut être utilisé pour la thérapie de remplacement endocrinien de l’une des façons suivantes :
1. Transplantation du pancréas seul (PTA) : Indiquée pour les patients atteints de diabète de type 1 qui présentent des épisodes fréquents d’hypoglycémie avec ou sans inconscience, une qualité de vie altérée ou d’autres problèmes de tolérance à l’insulinothérapie. Ces patients ont une fonction rénale adéquate et la transplantation rénale n’est pas indiquée.
2. Greffe SPK : Les organes proviennent du même donneur. L’utilisation principale a été chez les patients atteints de diabète de type 1 qui ont un débit de filtration glomérulaire estimé (DFGe) de 2</sup> ou qui sont sous traitement de substitution rénale.
3. Pancréas après transplantation rénale (PAK) : Transplantation de pancréas de donneur décédé après une transplantation rénale antérieure ; les indications sont similaires à celles de la PTA
4. Transplantation de cellules d’îlots pancréatiques : Offre une morbidité plus faible mais des résultats inférieurs à long terme par rapport à la transplantation d’organe solide (pancréas).
Environ 80 % des transplantations de pancréas sont réalisées en tant que transplantation SPK. Environ 10 % des greffes de pancréas sont réalisées en tant que greffe PAK après une transplantation rénale réussie d’un donneur vivant ou décédé. Les cas restants sont réalisés en tant que PTA. En 2015, 80 PTA ont été réalisées aux États-Unis.
La transplantation de pancréas et d’îlots de Langerhans peut être considérée comme des options de transplantation complémentaires et subir l’une ou l’autre n’est pas mutuellement exclusif. Dans une analyse de 40 transplantations de pancréas (50% PTA, 27,5% SPK, 22,5% PAK) après échec de la greffe d’îlots, les taux de survie globale (97% à 1 an et 83% à 5 ans) n’ont pas été affectés négativement.
Tests d’évaluation de la transplantation
Dans l’évaluation d’un patient en vue d’une transplantation de SPK, la quantification des besoins quotidiens en insuline et les taux sériques de C-peptide à jeun sont utilisés pour déterminer le type de diabète présent, la sévérité de l’insulino-résistance et le bénéfice éventuel de la transplantation de pancréas. Un patient très résistant à l’insuline aura un besoin élevé en insuline (>1-1,5 unités/kg) et un niveau élevé de peptide C à jeun (>4 ng/mL). Ces patients peuvent rester insulinodépendants malgré une greffe de pancréas.
Cependant, ces valeurs doivent être considérées dans le cadre du tableau clinique global. Par exemple, un patient sous dialyse péritonéale avec un dialysat contenant du dextrose aura des besoins en insuline plus importants qui diminueront lorsque la transplantation rénale éliminera le besoin de dialyse. Le peptide C n’est pas un marqueur exact chez les patients atteints d’une maladie rénale chronique car sa clairance varie chez ces patients. De plus, chez un patient qui prend de l’insuline, le taux de C-peptide sera faussement bas si l’échantillon est prélevé lorsque le patient est hypoglycémique ; ainsi, le résultat du C-peptide doit être interprété à la lumière d’une mesure concomitante du glucose.
L’hémoglobine A1C doit être mesurée, pour évaluer la gravité du diabète du patient.
Si le patient a un diabète de type 1, il faut envisager une évaluation de base des marqueurs auto-immuns, notamment des anticorps contre l’acide glutamique décarboxylase. Une augmentation du taux d’anticorps après une transplantation de pancréas suggérerait un possible dysfonctionnement du greffon pancréatique et une hyperglycémie due à une réaction auto-immune par opposition à un rejet.
Indications et contre-indications
Le nombre de greffes de pancréas a diminué chaque année depuis 2004, où environ 1500 ont été réalisées ; 181 greffes de pancréas ont été réalisées en 2016. La transplantation multi-organe la plus fréquente est la transplantation rein-pancréas, avec près de 23 000 réalisées entre 1988 et 2017. En 2016, 795 transplantations de SPK ont été réalisées. Les patients atteints de diabète de type 2 représentaient 12,5 % des transplantations de SPK.
Le Réseau uni de partage d’organes (UNOS) inscrit un candidat potentiel à une greffe de pancréas si le patient répond à l’un des critères d’admissibilité suivants :
-
Insulinodépendant avec un peptide C inférieur ou égal à 2 ng/mL (patients atteints de diabète de type 1)
-
Insulinodépendant avec un peptide C-.peptide supérieur à 2 ng/mL et un indice de masse corporelle 2</sup> (patients présumés diabétiques de type 2)
Le clinicien doit être conscient du tableau clinique lorsqu’il interprète ces valeurs, comme indiqué ci-dessus.L’utilisation du peptide C est controversée.
Voici les critères pour le type spécifique de transplantation du pancréas :
-
PTA – Complications métaboliques fréquentes et aiguës, notamment hypoglycémie ou acidocétose, incapacité à tolérer une insulinothérapie exogène, et persistance de complications aiguës malgré une prise en charge à base d’insuline
-
SPK – IRT et éligibilité à une greffe de pancréas
-
PAK -. Admissibilité à une greffe de pancréas et antécédent de transplantation rénale réussie
Le patient admissible devra également subir une évaluation médicale appropriée en particulier pour la stratification du risque cardiovasculaire et la maladie vasculaire périphérique. Ils devront également présenter des antécédents d’observance médicale. La limite d’âge historique pour la transplantation de pancréas, que certains centres ont continué à employer, est de 55 ans. Cependant, le nombre de transplantés du pancréas âgés de plus de 55 ans n’a cessé d’augmenter. En 2016, 24,5 % de tous les transplantés du pancréas avaient plus de 50 ans (PTA : 38,3 %, SPK : 22,7 %, PAK : 25,7 %). La survie des patients est comparable pour les greffés du pancréas plus jeunes et plus âgés, mais les receveurs plus âgés présentaient des événements cardiovasculaires plus fréquents.
Les contre-indications absolues, comme suit, sont similaires à celles des autres transplantations d’organes solides :
-
Risque cardiovasculaire excessif
-
Malignité active ou infection qui devrait être traitée et éliminée avant la transplantation
-
Facteurs de risque sociaux élevés tels que la non-observance des médicaments, absence d’assurance et consommation de drogues illicites
Les contre-indications relatives sont les suivantes :
-
Indice de masse corporelle supérieur à 30 kg/m 2
-
Besoin en insuline de >1.5 U/kg par jour
-
Maladie cérébrovasculaire, aortique/iliaque, cardiovasculaire ou vasculaire périphérique
Bénéfices de la transplantation du pancréas
Les complications microvasculaires du diabète sont directement liées à la concentration en glucose. Ainsi, on pourrait s’attendre à ce que la normalisation du glucose par une transplantation de pancréas réussie stabilise ou inverse les complications microvasculaires. Les avantages résultants de la transplantation de pancréas et de rein sont discutés ci-dessous.
Rétinopathie diabétique
La plupart des candidats à la transplantation de pancréas ont souffert de diabète pendant 20-25 ans en moyenne avant d’être considérés pour la transplantation et par conséquent, beaucoup d’entre eux ont eu une chirurgie au laser pour la rétinopathie. Il s’agit d’une constatation péritransplantation courante dans la plupart des études. La sévérité de ces changements ophtalmologiques peut empêcher un effet salutaire clair de la transplantation de PTA ou de SPK sur la rétinopathie.
Les études suggèrent cependant que la rétinopathie peut s’améliorer 3 ans après la SPK et que le besoin de chirurgie laser supplémentaire est moindre après la SPK que la transplantation rénale seule (KTA). On pense que la transplantation du pancréas et le maintien d’un état euglycémique au minimum stabilisent la rétinopathie diabétique. Des essais prospectifs sont nécessaires pour comparer les deux groupes, car la plupart des études ne comportent pas suffisamment de groupes témoins.
Néphropathie diabétique
Un nombre significatif de candidats à la transplantation de pancréas ont une maladie rénale avancée. Le scénario le plus courant pour la transplantation de pancréas est en combinaison avec une transplantation rénale pour traiter les patients atteints d’urémie diabétique. La SPK permettrait de prévenir les effets délétères du diabète sur la nouvelle transplantation rénale.
Les études comparant la fonction rénale des receveurs de greffe de SPK par rapport aux receveurs de KTA diabétique n’ont pas démontré de différences significatives au cours de la période post-transplantation précoce. Cependant, une néphropathie diabétique récurrente est observée dès 2 ans après une KTA chez un receveur diabétique ou lors de l’échec de la greffe de pancréas après une SPK mais n’a jamais été rapportée avec une greffe de SPK fonctionnelle. Il a été démontré que les patients ayant reçu une greffe de pancréas ont une progression retardée ou une inversion de la néphropathie diabétique.
Neuropathie diabétique
La neuropathie s’améliore après une transplantation rénale et pancréatique, ce qui suggère que l’insuffisance rénale et le diabète contribuent à la neuropathie sensorielle couramment observée au moment de la transplantation. Les neuropathies autonomes telles que la gastroparésie mettent des années à se développer et peuvent être difficiles à quantifier. Cependant, une amélioration objective des résultats neuropathiques autonomes a été rapportée 4 ans après la SPK et on note qu’elle est plus importante après la SPK qu’après la KTA.
Rétinopathie diabétique
La rétinopathie diabétique est une découverte omniprésente chez les patients atteints de diabète et d’IRT. Une perte de vision significative/la cécité peuvent être observées. La cécité n’est pas une contre-indication absolue à la transplantation, car de nombreux patients aveugles mènent une vie très indépendante.
Maladie cardiovasculaire
La maladie cardiovasculaire est la cause la plus fréquente de décès chez les patients atteints de diabète avec insuffisance rénale. Peu d’études prospectives ont examiné la relation entre l’établissement d’une normoglycémie chez les patients atteints de diabète à long terme et une réduction de la morbidité et de la mortalité cardiovasculaires. Dans une étude transversale, la fraction d’éjection du ventricule gauche était plus élevée, le rapport entre le taux de remplissage maximal et le taux d’éjection maximal était plus important et la dilatation de l’artère brachiale dépendante de l’endothélium était améliorée chez les receveurs de SPK par rapport aux patients atteints de diabète de type 1 ayant reçu une KTA. D’autres données montrent que la transplantation de SPK réduit les taux de décès cardiovasculaires avec une réduction concomitante de la pression artérielle.
Une autre étude a observé une plus grande diminution de la masse ventriculaire gauche et une plus grande normalisation de la dysfonction diastolique chez les receveurs de SPK que chez ceux qui ont subi une KTA. Dans ce rapport, des échocardiographies en 2 dimensions (2-D) et en mode M ont été réalisées avant et 1 an après la transplantation chez des receveurs de SPK et de KTA. Une vaste étude rétrospective a suggéré une association avec des réductions de l’incidence d’infarctus du myocarde, d’œdème pulmonaire aigu et d’hypertension chez les receveurs de SPK par rapport à ceux de KTA.
La maladie coronarienne (CAD) est la comorbidité la plus importante à considérer chez les patients atteints de diabète de type 1 et de néphropathie diabétique. On estime que les patients diabétiques et atteints d’IRT présentent un risque d’événements cardiovasculaires 50 fois supérieur à celui de la population générale. La prévalence de la coronaropathie significative (sténose >50 %) chez les patients diabétiques qui commencent un traitement pour l’IRT est estimée à 45-55 %. En raison de la neuropathie diabétique, les patients peuvent ne pas ressentir d’angine de poitrine pendant les épisodes d’ischémie myocardique.
Accident vasculaire cérébral et accident ischémique transitoire
Les patients atteints d’IRT et de diabète ont un taux accru d’accidents vasculaires cérébraux et d’accidents ischémiques transitoires. Les décès liés à une maladie vasculaire cérébrale chez les patients atteints d’IRT sont environ deux fois plus fréquents chez les diabétiques que chez les non-diabétiques. Les accidents vasculaires cérébraux surviennent plus fréquemment et à un âge plus jeune chez les patients diabétiques que chez les patients non diabétiques appariés par l’âge et le sexe.
Maladie vasculaire périphérique
La maladie vasculaire périphérique des extrémités inférieures est importante chez les patients diabétiques. Les patients atteints d’IRT sont à risque d’amputation d’un membre inférieur. Ces problèmes commencent généralement par un ulcère du pied associé à une neuropathie somatosensorielle avancée.
Neuropathie autonome
La neuropathie autonome est prévalente et peut se manifester par une gastropathie, une cystopathie et une hypotension orthostatique. L’étendue de la neuropathie autonome diabétique est souvent sous-estimée.
L’altération de la vidange gastrique (gastroparésie) est un élément important à prendre en compte en raison de ses implications significatives sur l’évolution post-transplantation. Les patients atteints de gastroparésie sévère peuvent avoir des difficultés à tolérer les médicaments immunosuppresseurs oraux qui sont essentiels pour prévenir le rejet des organes transplantés. Des épisodes de déplétion volumique accompagnés d’une azotémie surviennent fréquemment chez les patients ayant subi une greffe de SPK. La morbidité gastro-intestinale est une indication fréquente de réadmission après une transplantation de pancréas.
Le dysfonctionnement vésical neurogène est un élément important à prendre en compte chez les patients subissant une transplantation de pancréas seul ou de SPK drainé par la vessie. L’incapacité à ressentir la plénitude de la vessie et à la vider prédispose à des résidus post-mictionnels élevés et à la possibilité d’un reflux vésico-urétéral. Cela peut affecter négativement la fonction de l’allogreffe rénale, augmenter l’incidence des infections vésicales et de la pyélonéphrite, et prédisposer à la pancréatite du greffon.
La combinaison de l’hypotension orthostatique et de l’hypertension en position couchée résulte d’une dysrégulation du tonus vasculaire. Cela a des implications pour le contrôle de la pression artérielle après la transplantation, en particulier chez les patients ayant subi une transplantation de pancréas drainé par la vessie et qui sont prédisposés à la déplétion volumique. Par conséquent, il est important de réévaluer soigneusement les besoins en médicaments antihypertenseurs après la transplantation.
Névropathies sensorielles et motrices
Ces affections sont fréquentes chez les patients atteints de diabète de longue date. Cela peut avoir des implications pour la réadaptation après la transplantation. La neuropathie périphérique est également un indicateur de risque accru de blessures aux pieds et d’ulcères du pied diabétique ultérieurs.
Maladies mentales ou émotionnelles
Les maladies mentales, y compris la névrose et la dépression, sont fréquentes dans la population diabétique insulinodépendante. Le diagnostic et le traitement approprié de ces maladies avant l’obtention d’une greffe de pancréas peuvent considérablement améliorer l’observance médicale.
Résultats
L’évaluation des taux de résultats des greffes de pancréas a été entravée par le manque d’uniformité des critères d’échec de la greffe. Certains programmes ne signalent pas un échec de la greffe si la production de peptide C continue, alors que d’autres signalent un échec de la greffe si le receveur n’est plus indépendant de l’insuline. Le comité de transplantation de pancréas OPTN/UNOS a proposé les définitions plus précises suivantes pour l’échec de la greffe de pancréas, qui sont actuellement en attente de mise en œuvre :
-
Retrait du pancréas transplanté
-
Réinscription pour une greffe de pancréas
-
Inscription pour une greffe d’îlots après avoir reçu une greffe de pancréas
-
Utilisation d’insuline de ≥0.5 unités/kg/jour pendant une période consécutive de 90 jours
-
Décès du receveur
Le nombre de receveurs vivants avec une allogreffe de pancréas fonctionnelle a continué d’augmenter au cours de la dernière décennie et a dépassé 18 000 en 2016. La mortalité a diminué de manière constante dans tous les groupes de transplantation du pancréas, grâce à des régimes immunosuppresseurs plus sûrs et plus efficaces. La mortalité à un an pour l’APT est passée de 4,6 % en 2012-2013 à 0,8 % pour les greffes réalisées en 2014-2015. Pour la SPK, les taux de survie à 5 ans des patients étaient similiaires chez les patients atteints de diabète de type 1 et de type 2 (90,5 % et 91,5 % respectivement), malgré l’âge plus avancé et la comorbidité associée au diabète de type 2. Cela est probablement dû à la sélection de candidats atteints de diabète de type 2 dont l’état cardiovasculaire peut tolérer les risques opératoires élevés.
Le plus grand risque de perte de greffon se situe dans la première année post-transplantation et en particulier dans les 3 premiers mois, quel que soit le type de greffe de pancréas. Les analyses des données de l’International Pancreas Transplant Registry ont utilisé l’indépendance vis-à-vis de l’insuline comme principal critère de survie du greffon. Les meilleurs taux de survie des greffons de pancréas SPK ont été de 86 % à un an et de 73 % à 5 ans. Les résultats de la transplantation SPK sont supérieurs à ceux de la transplantation PAK et PTA. Un avantage de la transplantation SPK est que le rejet aigu peut être détecté plus facilement, car la créatinine sérique peut être utilisée comme marqueur.
Dans la transplantation PAK, les taux de survie du greffon pancréatique à 1 an et à 5 ans sont respectivement de 80% et 58%. Pour la PTA, les taux comparables sont de 77 % et 56 %.
Les taux de rejet aigu sont similaires pour la SPK et la PAK, à environ 4% pour chacune. La demi-vie estimée des greffons s’est améliorée au fil des années, la SPK durant environ 14 ans, la PAK 7 ans et la PTA 7 ans.