US Pharm. 2017;42(6)(Generic Drugs suppl):38-42.
ABSTRACT: Protonpumpehæmmere (PPI’er) er en klasse af antisekretoriske midler, der anvendes til behandling af forskellige gastrointestinale tilstande, såsom gastroøsofageal reflukssygdom, Helicobacter pylori-relaterede lidelser og mave- og duodenalsår. Selv om disse midler er effektive syrehæmmende midler, er brugen af PPI’er ofte omdiskuteret på grund af rapporter om nye potentielle bivirkninger. Overforbrug og interaktioner mellem lægemidler er problemer i forbindelse med PPI’er. Da flere PPI’er desuden fås i håndkøb, er uhensigtsmæssig brug af disse midler et stort problem. Farmaceuter i alle miljøer kan have en dybtgående indflydelse på uhensigtsmæssig brug af PPI’er ved at sikre passende iværksættelse og fortsættelse af behandlingen, dosering og behandlingsvarighed.
Protonpumpehæmmere (PPI’er) er en lægemiddelklasse, der almindeligvis anvendes til behandling af forskellige gastrointestinale (GI) lidelser, herunder gastroøsofageal reflukssygdom (GERD), Helicobacter pylori-relaterede lidelser samt mave- og duodenalsår. Selv om disse antisekretoriske midler er den foretrukne behandling af mange tilstande, er klassen plaget af overforbrug og rapporter om potentielt alvorlige bivirkninger og interaktioner mellem lægemidler.1 Endvidere er patientstyring af tilstande, der behandles med PPI’er, kompliceret af, at flere af disse midler er tilgængelige i håndkøb. Denne artikel har til formål at fremhæve hensigtsmæssig brug og give en evidensbaseret beskrivelse af flere nye eller stærkt omdiskuterede ulemper ved disse midler.
Tilgængelighed af PPI’er
Seks unikke PPI’er, hvoraf fem er tilgængelige generisk, kan fås på recept (TABEL 1).2-7 Lave doser af omeprazol, lansoprazol og en mærkevareversion af esomeprazolmagnesium er tilgængelige i håndkøb. Omeprazol anvendes også i et coformuleret produkt med natriumbicarbonat. Denne artikel vil primært fokusere på generisk tilgængelige, oralt doserede PPI’er.
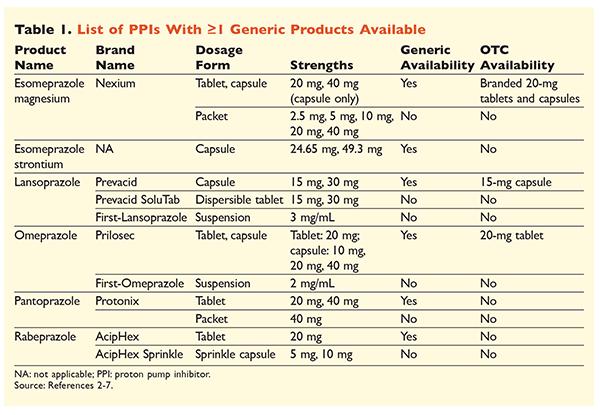
Esomeprazol strontium blev godkendt af FDA på baggrund af dets bioækvivalens med esomeprazol magnesium.3 Selv om produktmærkningen for disse to midler er meget ens, er der tre bemærkelsesværdige forskelle. For det første fås esomeprazol strontium i kapsler på 24,65 mg og 49,3 mg, som svarer til esomeprazol magnesium på henholdsvis 20 mg og 40 mg. For det andet er esomeprazol strontium ikke FDA-godkendt til brug hos pædiatriske patienter, hvorimod esomeprazol magnesium er godkendt til brug hos personer på 1 måned og derover. Endelig bør brugen af esomeprazol strontium undgås ved svært nedsat nyrefunktion, da det ikke er blevet undersøgt i denne population. Der anbefales ingen dosisjustering for esomeprazol magnesium.3 I denne artikel vil udtrykket esomeprazol blive anvendt til at beskrive esomeprazol magnesium.
Administration
Alle generisk tilgængelige PPI’er, herunder kapsler og tabletter, skal sluges hele uden at blive delt, knust eller tygget.2-7 Omeprazol-, lansoprazol- og esomeprazolkapsler kan åbnes, og indholdet kan drysses på æblemos til patienter, der ikke er i stand til at sluge orale doseringsformer. Desuden kan lansoprazolkapsler drysses i 2 oz. æble-, tomat- eller appelsinsaft. Alle blandinger, der indeholder indholdet af åbnede kapsler, skal synkes straks og må ikke opbevares til fremtidig brug.2,4,5
Lansoprazol, omeprazol og esomeprazol bør administreres før måltider, men de specifikke anbefalinger om indgivelsestidspunkter varierer. Omeprazol bør administreres 30 til 60 minutter før et måltid og esomeprazol mindst 60 minutter før; der er ikke angivet en tidsramme for lansoprazol.2,4,5 Pantoprazol kan administreres med eller uden mad.6 Rabeprazol bør tages efter et måltid ved duodenale ulcera og sammen med et måltid ved H pylori eradikation; ved alle andre indikationer kan rabeprazol tages med eller uden mad.7
Dosering og behandlingslængde
I betragtning af PPI’ernes ry for at være meget effektive og generelt sikre, er en betydelig overanvendelse af PPI’er et stort problem.1 Ikke alene administreres PPI’er ofte til indikationer uden dokumentation for deres anvendelse, men disse lægemidler ordineres også ofte i højere doser end nødvendigt for behandlingsvarigheder, der strækker sig ud over de anbefalede tidsrammer.8,9 Hver PPI’s godkendte dosering og anbefalede behandlingsvarighed er angivet i TABEL 2 og 3. Behandlingsanbefalinger, der adskiller sig fra dem, der er godkendt af FDA, samt bemærkelsesværdige kliniske perler i forbindelse med PPI-initiering, dosering og behandlingsvarighed er skitseret nedenfor.
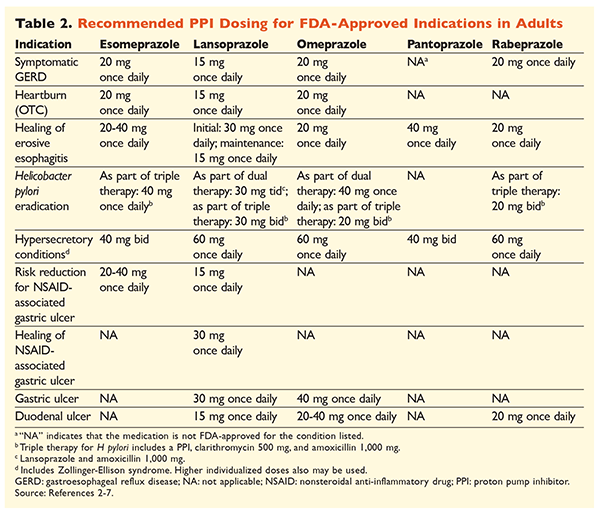
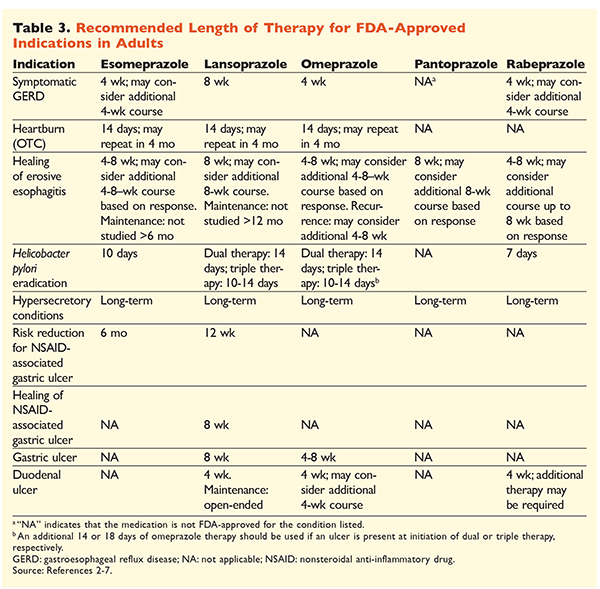
GERD: Hos patienter med GERD anses alle PPI’er for lige effektive, og et 8 ugers behandlingsforløb med ethvert tilgængeligt middel anbefales.10 Patienter med symptomer, der er refraktære over for behandling efter 2 til 3 måneder, kan kræve langvarig vedligeholdelsesbehandling med to gange daglige doser. Der bør dog anvendes den laveste effektive dosis, og en anden PPI bør overvejes, hvis patienten ikke reagerer på behandlingen.10 Alternativt kan man overveje PPI-behandling efter behov eller en nedtrapning til en histamin2-receptorantagonist (H2RA).10 Behandling med en OTC-PPI bør begrænses til 14 dage, og genbehandling bør ikke finde sted oftere end hver 4. måned.11
H pyloriassocierede ulcera: Afhængigt af den PPI, der anvendes, omfatter de FDA-godkendte regimer til udryddelse af H pylori dobbeltbehandling med enten amoxicillin eller clarithromycin og trippelbehandling med begge midler i 7 til 14 dage.2-5,7 Specifikke vejledningsstøttede behandlingsregimer varierer i forhold til dem, der er godkendt af FDA, men den anbefalede varighed af behandlingen er ens, idet alle regimer har en doseringstid på 10 til 14 dage.12 Efter udryddelse af H pylori er vedligeholdelsesbehandling med PPI ikke nødvendig.13 En mere detaljeret diskussion af specifikke regimer ligger uden for rammerne af denne artikel.
Profylakse og behandling af NSAID-inducerede mavesår: Efter at der er opstået et ikke-steroide antiinflammatoriske lægemidler (NSAID)-associeret ulcus, bør behovet for NSAID-behandling revurderes. Hvis fortsat NSAID-behandling anses for hensigtsmæssig, bør patienterne fastholdes i selektiv cyclooxygenase-2-terapi i den laveste effektive dosis i den kortest mulige varighed i kombination med en PPI.13
Til profylakse anbefales indledning af en PPI kun hos patienter med moderat eller høj risiko for NSAID-relateret GI-toksicitet. Risikofaktorer omfatter alder >65 år, højdosis NSAID-behandling, en tidligere historie med ukompliceret ulcus og samtidig brug af aspirin (herunder lavdosis), kortikosteroider eller antikoagulanter. Patienter, der anses for at have moderat risiko for NSAID-induceret GI-toksicitet, omfatter dem med en eller to af disse risikofaktorer, mens patienter med høj risiko har mere end to risikofaktorer eller en historie med et tidligere kompliceret mavesår, især hvis det var nyligt.14 Det er rimeligt at fortsætte PPI-behandling, så længe den patient med moderat eller høj risiko fortsat er i NSAID-behandling.13
Idiopatisk ulcus: Ulcera uden klart identificerbar årsag er tilbøjelige til at gentage sig hos patienter, der ikke behandles med syreundertrykkende behandling. Retningslinjerne anbefaler ikke klart, hvor længe patienterne skal behandles med vedligeholdelsesbehandling, men de antyder, at løbende PPI-behandling reducerer risikoen for tilbagevendende ulcusdannelse.13
Sikkerhed
PPI’er betragtes generelt som en veltolereret klasse af lægemidler.1
Sikkerhed
PPI’er anses generelt for at være en veltolereret klasse af lægemidler.1 Flere sikkerhedsproblemer har dog længe plaget deres ry, herunder en øget risiko for Clostridium difficile-associeret diarré, samfundserhvervet lungebetændelse og knoglebrud.15,16 For nylig er der blevet rejst bekymringer om demens og kronisk nyresygdom, og debatten om hypomagnesiæmi og en teoretisk lægemiddelinteraktion med clopidogrel er fortsat.
Demens: To nyere undersøgelser har antydet potentialet for en øget risiko for demens ved langvarig brug af PPI hos ældre.17,18 En foreslået mekanisme bag dette fund er, at PPI’er fremmer udviklingen af beta-amyloid plaques, en foreslået patofysiologi for Alzheimers sygdom.15 Undersøgelsens begrænsninger understøtter dog ikke en afgørende årsagssammenhæng mellem PPI-brug og en øget forekomst af demens.19
Renekomplikationer: Selv om PPI’er er blevet bredt anerkendt som en almindelig årsag til akut interstitiel nefrit, implicerer nyere data også disse midler i udviklingen af andre nyrekomplikationer.15,20 Tre nyere forsøg har antydet, at PPI’er kan være ansvarlige for en øget risiko for kronisk nyresygdom og progression til nyresygdom i slutstadiet.20-22 Disse observationsundersøgelser skal dog fortolkes med forsigtighed, da kausalitet ikke kan bekræftes.23
Hypomagnesiæmi: I 2011 udstedte FDA en advarsel om, at langvarig brug af PPI’er i perioder på over 1 år kan resultere i hypomagnesiæmi.24 Siden da har flere omfattende undersøgelser støttet dette resultat.25-29 Forholdet mellem PPI’er og hypomagnesiæmi er dog ikke entydigt, og det kompliceres af eksterne risikofaktorer.30-32 På nuværende tidspunkt anses klinisk signifikant PPI-induceret hypomagnesiæmi for at være sjælden og forekommer hyppigere ved samtidig brug af diuretika.31,32 Overvågning anbefales kun hos patienter med yderligere risikofaktorer.32
Medicinsk interaktion med clopidogrel: Clopidogrel spiller en vigtig rolle i forbindelse med reduktion af kardiovaskulær risiko, men det er forbundet med GI-blødninger, især hos patienter med øget risiko. GI-beskyttelse med PPI’er implementeres ofte hos patienter, der er mere tilbøjelige til at opleve en GI-blødning, herunder patienter med en tidligere øvre GI-blødning; høj alder; samtidig brug af antikoagulantia, kortikosteroider eller NSAID’er (herunder aspirin); og/eller H pylori-infektion.33
PPI’er menes at hæmme CYP2C19-enzymet, den primære vej, hvorigennem clopidogrel aktiveres.33
Denne interaktion kan teoretisk set mindske de trombocythæmmende virkninger af clopidogrel og øge risikoen for negative kardiovaskulære udfald.33 Baseret på inkonsistente resultater fra både farmakokinetiske undersøgelser og udfaldsforsøg er den kliniske betydning af denne interaktion dog usikker.34
Der er endvidere mangel på konsistens i evidensen vedrørende de enkelte PPI’ers reelle indvirkning på virkningerne af clopidogrel.33 De seneste FDA-anbefalinger tyder på, at pantoprazol er et mere sikkert valg end andre PPI’er, mens omeprazol menes at være det mest risikable.35 De nuværende data støtter fortsat denne konklusion, men der er behov for yderligere undersøgelser for at bekræfte, om der er en forskel mellem PPI’er.36
Det er vigtigt at afveje fordele og risici ved trombocythæmmende behandling alene eller i kombination med en PPI, når der skal træffes en beslutning om at tilføje GI-beskyttende behandling. Hos patienter med høj risiko for GI-komplikationer kan de gavnlige virkninger af PPI-behandling være større end den nedsatte effektivitet af trombocythæmmende behandling, hvilket blev påvist inkonsistent. For patienter med lavere risiko for GI-komplikationer kan en H2RA være en fornuftig behandlingsmulighed, selv om denne klasse har vist sig at være mindre effektiv end PPI’er til denne indikation.33
Konklusion
Apotekere i alle miljøer kan have en dybtgående indflydelse på uhensigtsmæssig PPI-anvendelse ved at sikre korrekt iværksættelse og fortsættelse af behandlingen, dosering og behandlingsvarighed. I takt med at der fortsat fremkommer modstridende data om disse lægemidlers sikkerhedsprofiler, bliver langtidsbrug af PPI’er mere kompliceret. Ved at sikre, at den laveste passende dosis anvendes i den kortest mulige periode, kan farmaceuterne bidrage til at forhindre, at patienterne udsættes for unødvendige potentielle skader.
1. Heidelbaugh JJ, Kim AH, Chang R, Walker PC. Overanvendelse af protonpumpehæmmere: hvad klinikeren skal vide. Therap Adv Gastroenterol. 2012;5;5:219-232.
2. Nexium (esomeprazol magnesium) indlægsseddel. Wilmington, DE: AstraZeneca Pharmaceuticals LP; december 2016.
3. Esomeprazol strontium indlægsseddel. Glasgow, KY: Amneal Pharmaceuticals; december 2014.
4. Prevacid (lansoprazol) indlægsseddel. Deerfield, IL: Takeda Pharmaceuticals America, Inc; oktober 2016.
5. Prilosec (omeprazol) indlægsseddel. Wilmington, DE: AstraZeneca Pharmaceuticals LP; december 2016.
6. Protonix (pantoprazol) indlægsseddel. Philadelphia, PA: Wyeth Pharmaceuticals Inc. oktober 2016.
7. AcipHex (rabeprazol) indlægsseddel. Woodcliff Lake, NJ: Eisai Inc; april 2016.
8. Chia CT, Lim WP, Lim WP, Vu CK. Uhensigtsmæssig brug af protonpumpehæmmere i et lokalt miljø. Singapore Med J. 2014;55;55:363-366.
9. Kelly OB, Dillane C, Patchett SE, et al. Den uhensigtsmæssige ordination af orale protonpumpehæmmere i hospitalsmiljøet: en prospektiv tværsnitsundersøgelse. Dig Dis Sci. 2015;60;60:2280-2286.
10. Katz PO, Gerson LB, Gerson LB, Vela MF. Retningslinjer for diagnosticering og behandling af gastroøsofageal reflukssygdom. Am J Gastroenterol. 2013;108:308-328.
11. FDA Drug Safety Communication: mulig øget risiko for brud i hofte, håndled og rygsøjle ved brug af protonpumpehæmmere. www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/ucm213206.htm. Tilgået den 17. februar 2017.
12. Chey WD, Leontiadis GI, Howden CW, Moss SF. ACG’s kliniske retningslinje: behandling af Helicobacter pylori-infektion. Am J Gastroenterol. 2017;112:212-239.
13. Laine L, Jensen DM. Håndtering af patienter med blødning fra mavesår. Am J Gastroenterol. 2012;107:345-360.
14. Lanza FL, Chan FK, Chan FK, Quigley EM. Retningslinjer for forebyggelse af NSAID-relaterede ulcuskomplikationer. Am J Gastroenterol. 2009;104:728-738.
15. Eusebi LH, Rabitti S, Artesiani ML, et al. Protonpumpehæmmere: risici ved langtidsbrug. J Gastroenterol Hepatol. 2017; Jan 16 .
16. Abramowitz J, Thakkar P, Isa A, et al. Rapportering af utilsigtede hændelser i forbindelse med behandling med protonpumpehæmmere: en oversigt over systematiske gennemgange. Otolaryngol Head Neck Surg. 2016;155;155:547-554.
17. Haenisch B, von Holt K, Wiese B, et al. Risiko for demens hos ældre patienter ved brug af protonpumpehæmmere. Eur Arch Psychiatry Clin Neurosci. 2015;265:419-428.
18. Gomm W, von Holt K, Thomé F, et al. Association of proton pump inhibitors with risk of dementia: a pharmacoepidemiological claims data analysis. JAMA Neurol. 2016;73:410-416.
19. Kuller LH. Øger protonpumpehæmmere risikoen for demens? JAMA Neurol. 2016;73:379-381.
20. Arora P, Gupta A, Golzy M, et al. Protonpumpehæmmere er forbundet med øget risiko for udvikling af kronisk nyresygdom. BMC Nephrol. 2016;17:112.
21. Xie Y, Bowe B, Li T, et al. Protonpumpehæmmere og risiko for incidente CKD og progression til ESRD. J Am Soc Nephrol. 2016;27:3153-3163.
22. Lazarus B, Chen Y, Wilson FP, et al. Brug af protonpumpehæmmere og risiko for kronisk nyresygdom. JAMA Intern Med. 2016;176:238-246.
23. Kia L, Kahrilas PJ. Terapi: risici forbundet med kronisk PPI-brug – signal eller støj? Nat Rev Gastroenterol Hepatol. 2016;13(5):253-254.
24. FDA Drug Safety Communication: Low magnesium levels can be associated with long-term use of proton pump inhibitor drugs (PPI). www.fda.gov/Drugs/DrugSafety/ucm245011.htm. Tilgået den 17. februar 2017.
25. Kieboom BC, Kiefte-de Jong JC, Eijgelsheim M, et al. Protonpumpehæmmere og hypomagnesiæmi i den almindelige befolkning: en befolkningsbaseret kohortestudie. Am J Kidney Dis. 2015;66:775-782.
26. Park CH, Kim EH, Roh YH, et al. Forbindelsen mellem brugen af protonpumpehæmmere og risikoen for hypomagnesiæmi: en systematisk gennemgang og metaanalyse. PLoS One. 2014;9:e112558.
27. Luk CP, Parsons R, Lee YP, Lee YP, Hughes JD. Protonpumpehæmmere-associeret hypomagnesiæmi: Hvad fortæller FDA-data os? Ann Pharmacother. 2013;47:773-780.
28. Cheungpasitporn W, Thongprayoon C, Kittanamongkolchai W, et al. Protonpumpehæmmere forbundet med hypomagnesiæmi: en systematisk gennemgang og metaanalyse af observationsundersøgelser. Ren Fail. 2015;37:1237-1241.
29. Markovits N, Loebstein R, Halkin H, et al. Forbindelsen mellem protonpumpehæmmere og hypomagnesiæmi i samfundsmiljøet. J Clin Pharmacol. 2014;54:889-895.
30. Park SH, Lee SH, Lee JS, et al. Ændringer i serummagnesiumkoncentrationen efter brug af en protonpumpehæmmer hos patienter, der gennemgår en perkutan koronar intervention. Kidney Res Clin Pract. 2015;34:98-102.
31. Danziger J, William JH, Scott DJ, et al. Brug af protonpumpehæmmere er forbundet med lave serummagnesiumkoncentrationer. Kidney Int. 2013;83;83:692-699.
32. Begley J, Smith T, Barnett K, et al. Protonpumpehæmmer-associeret hypomagnesiæmi – en grund til bekymring? Br J Clin Pharmacol. 2016;81:753-758.
33. Abraham NS, Hlatky MA, Antman EM, et al. ACCF/ACG/AHA 2010 expert consensus document on the concomitant use of proton pump inhibitors and thienopyridines: a focused update of the ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use. Am J Gastroenterol. 2010;105:2533-2549.
34. Melloni C, Washam JB, Jones WS, et al. Modstridende resultater mellem randomiserede forsøg og observationsundersøgelser om protonpumpehæmmeres indvirkning på kardiovaskulære hændelser, når de administreres sammen med dobbelt trombocythæmmende behandling: systematisk gennemgang. Circ Cardiovasc Qual Outcomes. 2015;8:47-55.
35. FDA påmindelse om at undgå samtidig brug af Plavix (clopidogrel) og omeprazol. www.fda.gov/Drugs/DrugSafety/ucm231161.htm. Tilgået den 17. februar 2017.
36. Bundhun PK, Teeluck AR, Bhurtu A, Huang WQ. Er den samtidige brug af clopidogrel og protonpumpehæmmere stadig forbundet med øgede negative kardiovaskulære resultater efter koronar angioplastik: en systematisk gennemgang og metaanalyse af nyligt offentliggjorte undersøgelser (2012-2016). BMC Cardiovasc Disord. 2017;17:3.