US Pharm. 2017;42(6)(Generic Drugs suppl):38-42.
ABSTRAKT: Inhibitory protonové pumpy (PPI) jsou skupinou antisekrečních látek používaných k léčbě různých gastrointestinálních stavů, jako je refluxní choroba jícnu, poruchy související s Helicobacter pylori a žaludeční a dvanáctníkové vředy. Přestože jsou tyto látky účinnými léky potlačujícími kyselost, je používání IPP často diskutováno na základě hlášení o nových možných nežádoucích účincích. Problémem spojeným s IPP je nadměrné užívání a lékové interakce. Navíc vzhledem k tomu, že některé IPP jsou dostupné bez lékařského předpisu, představuje nevhodné užívání těchto látek významný problém. Lékárníci ve všech zařízeních mohou mít zásadní vliv na nevhodné užívání IPP tím, že zajistí vhodné zahájení a pokračování léčby, dávkování a délku léčby.
Inhibitory protonové pumpy (IPP) jsou skupinou léčiv běžně užívaných k léčbě různých gastrointestinálních (GI) poruch, včetně gastroezofageální refluxní choroby (GERD), poruch souvisejících s Helicobacter pylori a žaludečních a dvanáctníkových vředů. Ačkoli jsou tato antisekreční léčiva preferovanou léčbou řady onemocnění, je tato třída sužována nadužíváním a hlášeními o potenciálně závažných nežádoucích účincích a lékových interakcích.1 Dále je léčba pacientů u onemocnění léčených IPP komplikována volně prodejnou dostupností některých z těchto léčiv. Cílem tohoto článku je upozornit na vhodné užívání a poskytnout na důkazech založený popis několika nových nebo silně diskutovaných nevýhod těchto látek.
Dostupnost IPP
Šest unikátních IPP, z nichž pět je dostupných genericky, lze získat na lékařský předpis (TABULKA 1).2-7 Volně prodejné jsou nízké dávky omeprazolu, lansoprazolu a značková verze esomeprazolu magnesium. Omeprazol se také používá v koformulovaném přípravku s hydrogenuhličitanem sodným. Tento článek se zaměří především na genericky dostupné, perorálně dávkované IPP.
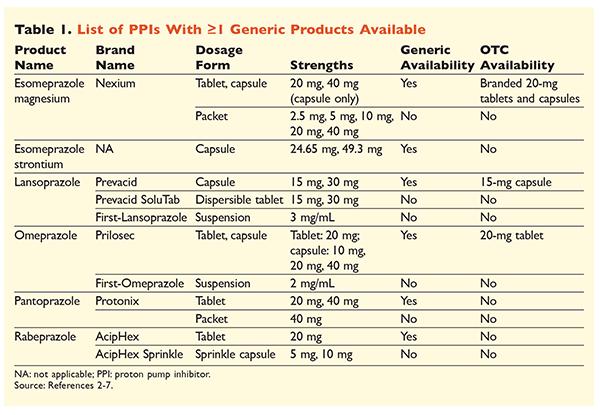
Esomeprazol stroncium byl schválen FDA na základě jeho bioekvivalence s esomeprazolem hořečnatým.3 Přestože je označení těchto dvou přípravků velmi podobné, existují tři významné rozdíly. Zaprvé, esomeprazol stroncium je dostupný v tobolkách 24,65 mg a 49,3 mg, které jsou ekvivalentní esomeprazolu magnesium 20 mg, resp. 40 mg. Za druhé, esomeprazol stroncium není schválen FDA pro použití u dětských pacientů, zatímco esomeprazol magnesium je schválen pro použití u pacientů ve věku 1 měsíc a starších. A konečně, použití esomeprazolu stroncia je třeba se vyhnout u těžké poruchy funkce ledvin, protože u této populace nebyl studován. Pro esomeprazol magnesium se nedoporučuje žádná úprava dávkování.3 Pro účely tohoto článku bude pro označení esomeprazolu magnesium používán termín esomeprazol.
Podávání
Všechny genericky dostupné IPP, včetně tobolek a tablet, by se měly polykat celé, aniž by se dělily, drtily nebo žvýkaly.2-7 Tobolky omeprazolu, lansoprazolu a esomeprazolu lze otevřít a obsah nasypat na jablečné pyré pro pacienty, kteří nejsou schopni polykat perorální lékové formy. Tobolky lansoprazolu lze navíc nasypat do 2 oz jablečného, rajčatového nebo pomerančového džusu. Jakékoli směsi obsahující obsah otevřených tobolek by měly být okamžitě spolknuty a nesmí být uchovávány pro další použití.2,4,5
Lansoprazol, omeprazol a esomeprazol by měly být podávány před jídlem, ale konkrétní doporučení ohledně doby podání se liší. Omeprazol by měl být podáván 30 až 60 minut před jídlem a esomeprazol nejméně 60 minut před jídlem; pro lansoprazol není časový rámec specifikován.2,4,5 Pantoprazol může být podáván s jídlem nebo bez jídla.6 Rabeprazol by měl být užíván po jídle při duodenálních vředech a s jídlem při eradikaci H pylori; u všech ostatních indikací může být rabeprazol užíván s jídlem nebo bez jídla.7
Dávkování a délka léčby
Vzhledem k pověsti IPP, které jsou velmi účinné a obecně bezpečné, je značně nadměrné používání IPP velkým problémem.1 Nejenže jsou IPP často podávány v indikacích bez důkazů podporujících jejich použití, ale tyto léky jsou také často předepisovány ve vyšších dávkách, než je nutné, a doba léčby přesahuje doporučené časové rámce.8,9 Schválené dávkování jednotlivých IPP a doporučená délka léčby jsou uvedeny v TABULKÁCH 2 a 3. Níže jsou uvedena doporučení pro léčbu, která se liší od doporučení schválených FDA, a také významné klinické perly týkající se zahájení, dávkování a délky léčby IPP.
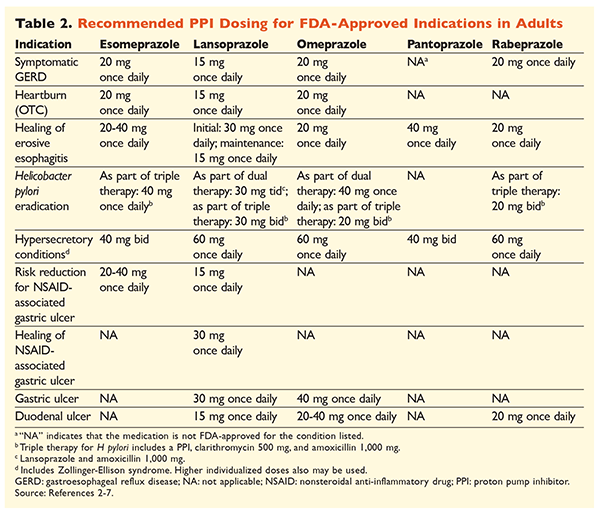
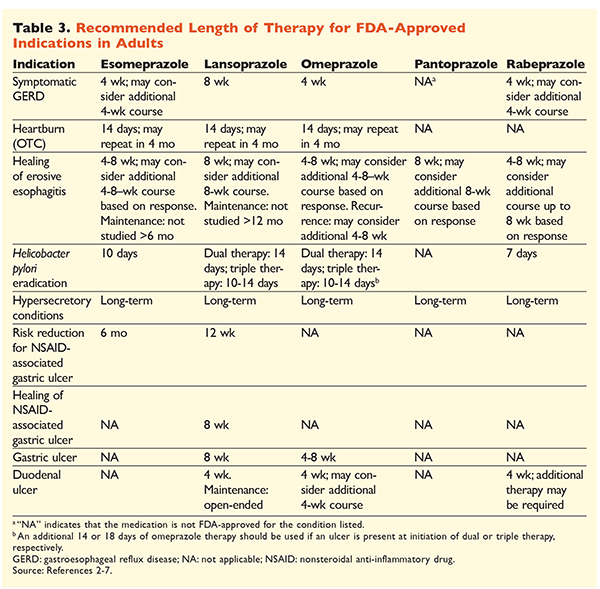
GERD: U pacientů s GERD jsou všechny IPP považovány za stejně účinné a doporučuje se 8týdenní léčba jakýmkoli dostupným přípravkem.10 Pacienti s příznaky refrakterními na léčbu po 2 až 3 měsících mohou vyžadovat dlouhodobou udržovací léčbu dávkami dvakrát denně. Měla by však být použita nejnižší účinná dávka, a pokud pacient na léčbu nereaguje, měl by být zvážen jiný PPI.10 Alternativně lze zvážit léčbu PPI podle potřeby nebo postupné nasazení antagonisty histaminových2 receptorů (H2RA).10 Léčba volně prodejným PPI by měla být omezena na 14 dní, přičemž k opakování léčby by nemělo docházet častěji než každé 4 měsíce.11
Vředy spojené s H pylori: V závislosti na používaném IPP zahrnují režimy schválené FDA pro eradikaci H pylori duální léčbu amoxicilinem nebo klaritromycinem a trojitou léčbu oběma látkami po dobu 7 až 14 dní.2-5,7 Konkrétní léčebné režimy podporované doporučeními se ve srovnání s režimy schválenými FDA liší, ale doporučená délka léčby je podobná, přičemž všechny režimy mají dávkovací dobu 10 až 14 dní.12 Po eradikaci H pylori není udržovací léčba PPI nutná.13 Podrobnější diskuse o konkrétních režimech je nad rámec tohoto článku.
Profylaxe a léčba vředů vyvolaných NSAID: Po vzniku vředu vyvolaného nesteroidními protizánětlivými léky (NSAID) je třeba přehodnotit potřebu léčby NSAID. Pokud je pokračování v léčbě NSAID považováno za vhodné, měli by být pacienti udržováni na selektivní terapii cyklooxygenázou-2 v nejnižší účinné dávce po nejkratší možnou dobu v kombinaci s PPI.13
Pro profylaxi se zahájení léčby PPI doporučuje pouze u pacientů se středním nebo vysokým rizikem gastrointestinální toxicity související s NSAID. Mezi rizikové faktory patří věk >65 let, léčba vysokými dávkami NSAID, předchozí anamnéza nekomplikovaného vředu a současné užívání aspirinu (včetně nízkých dávek), kortikosteroidů nebo antikoagulancií. Mezi pacienty se středním rizikem gastrointestinální toxicity vyvolané NSAID patří pacienti s jedním nebo dvěma z těchto rizikových faktorů, zatímco pacienti s vysokým rizikem mají více než dva rizikové faktory nebo anamnézu předchozího komplikovaného peptického vředu, zejména pokud se jednalo o nedávný vřed.14 Je vhodné pokračovat v léčbě PPI, dokud pacient se středním nebo vysokým rizikem zůstává na léčbě NSAID.13
Idiopatický vřed: U pacientů, kteří nejsou léčeni acidosupresivní terapií, se vředy bez jasně identifikovatelné příčiny pravděpodobně opakují. Pokyny jasně nedoporučují, jak dlouho by měli být pacienti léčeni udržovací terapií, ale naznačují, že pokračující léčba IPP snižuje riziko rekurentní tvorby vředů.13
Bezpečnost
PPI jsou obecně považovány za dobře snášenou skupinu léků.1 Jejich pověst však dlouhodobě kazí několik obav ohledně bezpečnosti, včetně zvýšeného rizika průjmu spojeného s Clostridium difficile, komunitní pneumonie a zlomenin kostí.15,16 V poslední době se objevují obavy z demence a chronického onemocnění ledvin a pokračují debaty ohledně hypomagnezémie a teoretické lékové interakce s klopidogrelem.
Demence: Dvě nedávné studie naznačily možnost zvýšeného rizika demence při dlouhodobém užívání IPP u starších osob.17,18 Navrhovaným mechanismem tohoto zjištění je, že IPP podporují vznik beta-amyloidových plaků, což je předpokládaná patofyziologie Alzheimerovy choroby.15 Omezení studie však nepotvrzují jednoznačný kauzální vztah mezi užíváním IPP a zvýšeným výskytem demence.19
Břišní komplikace: Ačkoli jsou IPP všeobecně uznávány jako častá příčina akutní intersticiální nefritidy, novější údaje naznačují, že se tyto látky podílejí i na vzniku dalších renálních komplikací.15,20 Tři nedávné studie naznačují, že IPP mohou být zodpovědné za zvýšené riziko chronického onemocnění ledvin a progrese do konečného stadia onemocnění ledvin.20-22 Tyto observační studie je však třeba interpretovat s opatrností, protože kauzalitu nelze potvrdit.23
Hypomagnezémie: V roce 2011 vydala FDA varování, že dlouhodobé užívání IPP po dobu delší než 1 rok může vést k hypomagnezémii.24 Od té doby toto zjištění potvrdilo několik rozsáhlých studií.25-29 Vztah mezi IPP a hypomagnezémií však není definitivní a je komplikován vnějšími rizikovými faktory.30-32 V současné době je klinicky významná hypomagnezémie vyvolaná PPI považována za vzácnou a vyskytuje se častěji při současném užívání diuretik.31,32 Sledování se doporučuje pouze u pacientů s dalšími rizikovými faktory.32
Lékové interakce s klopidogrelem: Klopidogrel hraje důležitou roli při snižování kardiovaskulárního rizika, ale je spojen s gastrointestinálním krvácením, zejména u pacientů se zvýšeným rizikem. Ochrana gastrointestinálního traktu pomocí IPP se často zavádí u pacientů, u nichž je vyšší pravděpodobnost výskytu gastrointestinálního krvácení, včetně pacientů s předchozím krvácením z horní části gastrointestinálního traktu, pokročilého věku, současného užívání antikoagulancií, kortikosteroidů nebo NSAID (včetně aspirinu) a/nebo infekce H pylori.33
Předpokládá se, že IPP inhibují enzym CYP2C19, což je primární cesta, kterou se klopidogrel aktivuje.33 Tato interakce může teoreticky snižovat protidestičkové účinky klopidogrelu a zvyšovat riziko nežádoucích kardiovaskulárních účinků.33 Na základě nekonzistentních výsledků farmakokinetických studií i studií výsledků je však klinický význam této interakce nejistý.34
Dále chybí konzistentní důkazy ohledně skutečného vlivu jednotlivých IPP na účinky klopidogrelu.33 Nejnovější doporučení FDA naznačují, že pantoprazol je bezpečnější volbou než ostatní IPP, zatímco omeprazol je považován za nejrizikovější.35 Současné údaje tento závěr nadále podporují, ale k potvrzení toho, zda mezi IPP existuje rozdíl, jsou nutné další studie.36
Při rozhodování o přidání GI-protektivní léčby je důležité zvážit přínosy a rizika protidestičkové léčby samotné nebo v kombinaci s IPP. U pacientů s vysokým rizikem gastrointestinálních komplikací může být příznivý účinek léčby IPP větší než snížená účinnost protidestičkové léčby, která byla prokázána rozporuplně. U pacientů s nižším rizikem gastrointestinálních komplikací může být rozumnou volbou léčby H2RA, ačkoli bylo prokázáno, že tato třída je v této indikaci méně účinná než IPP.33
Závěr
Farmaceuti ve všech zařízeních mohou zásadně ovlivnit nevhodné užívání IPP tím, že zajistí správné zahájení a pokračování léčby, dávkování a délku léčby. Vzhledem k tomu, že se stále objevují rozporuplné údaje týkající se bezpečnostních profilů těchto léků, stává se dlouhodobé užívání IPP složitější. Zajištěním užívání nejnižší vhodné dávky po nejkratší potřebnou dobu mohou lékárníci pomoci zabránit zbytečnému vystavení pacientů potenciálním škodám.
1. Heidelbaugh JJ, Kim AH, Chang R, Walker PC. Overutilization of proton-pump inhibitors: what the clinician needs to know (Nadměrné používání inhibitorů protonové pumpy: co by měl lékař vědět). Therap Adv Gastroenterol. 2012;5:219-232.
2. Nexium (esomeprazol magnesium) příbalový leták. Wilmington, DE: AstraZeneca Pharmaceuticals LP; prosinec 2016.
3. Esomeprazol stroncium příbalová informace. Glasgow, KY: Amneal Pharmaceuticals; prosinec 2014.
4. Prevacid (lansoprazol) příbalová informace. Deerfield, IL: Takeda Pharmaceuticals America, Inc; říjen 2016.
5. Příbalová informace. Příbalová informace přípravku Prilosec (omeprazol). Wilmington, DE: AstraZeneca Pharmaceuticals LP; prosinec 2016.
6. Protonix (pantoprazol) příbalová informace. Philadelphia, PA: Wyeth Pharmaceuticals Inc. Říjen 2016.
7. AcipHex (rabeprazol) příbalová informace. Woodcliff Lake, NJ: Eisai Inc; duben 2016.
8. Chia CT, Lim WP, Vu CK. Nevhodné používání inhibitorů protonové pumpy v lokálním prostředí. Singapore Med J. 2014;55:363-366.
9. Kelly OB, Dillane C, Patchett SE, et al. The inappropriate prescription of oral proton pump inhibitors in the hospital setting: a prospective cross-sectional study. Dig Dis Sci. 2015;60:2280-2286.
10. Katz PO, Gerson LB, Vela MF. Pokyny pro diagnostiku a léčbu gastroezofageální refluxní choroby. Am J Gastroenterol. 2013;108:308-328.
11. Sdělení FDA o bezpečnosti léčiv: možné zvýšené riziko zlomenin kyčle, zápěstí a páteře při užívání inhibitorů protonové pumpy. www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/ucm213206.htm. Přístup 17. února 2017.
12. Chey WD, Leontiadis GI, Howden CW, Moss SF. Klinické pokyny ACG: Léčba infekce Helicobacter pylori. Am J Gastroenterol. 2017;112:212-239.
13. Laine L, Jensen DM. Management pacientů s krvácením z vředu. Am J Gastroenterol. 2012;107:345-360.
14. Lanza FL, Chan FK, Quigley EM. Guidelines for prevention of NSAID-related ulcer complications [Pokyny pro prevenci vředových komplikací souvisejících s NSAID]. Am J Gastroenterol. 2009;104:728-738.
15. Eusebi LH, Rabitti S, Artesiani ML, et al. Inhibitory protonové pumpy: rizika dlouhodobého užívání. J Gastroenterol Hepatol. 2017; Jan 16 .
16. Abramowitz J, Thakkar P, Isa A, et al. Adverse event reporting for proton pump inhibitor therapy: an overview of systematic reviews. Otolaryngol Head Neck Surg. 2016;155:547-554.
17. Haenisch B, von Holt K, Wiese B, et al. Riziko demence u starších pacientů při užívání inhibitorů protonové pumpy. Eur Arch Psychiatry Clin Neurosci. 2015;265:419-428.
18. Gomm W, von Holt K, Thomé F, et al. Association of proton pump inhibitors with risk of dementia: a pharmacoepidemiological claims data analysis. JAMA Neurol. 2016;73:410-416.
19. Kuller LH. Zvyšují inhibitory protonové pumpy riziko demence? JAMA Neurol. 2016;73:379-381.
20. Arora P, Gupta A, Golzy M, et al. Inhibitory protonové pumpy jsou spojeny se zvýšeným rizikem rozvoje chronického onemocnění ledvin. BMC Nephrol. 2016;17:112.
21. Xie Y, Bowe B, Li T, et al. Inhibitory protonové pumpy a riziko vzniku CKD a progrese do ESRD. J Am Soc Nephrol. 2016;27:3153-3163.
22. Lazarus B, Chen Y, Wilson FP, et al. Proton pump inhibitor use and the risk of chronic kidney disease. JAMA Intern Med. 2016;176:238-246.
23. Kia L, Kahrilas PJ. Terapie: rizika spojená s chronickým užíváním PPI – signál nebo šum? Nat Rev Gastroenterol Hepatol. 2016;13(5):253-254.
24. Sdělení FDA o bezpečnosti léčiv: nízká hladina hořčíku může být spojena s dlouhodobým užíváním inhibitorů protonové pumpy (PPI). www.fda.gov/Drugs/DrugSafety/ucm245011.htm. Přístup 17. února 2017.
25. Kieboom BC, Kiefte-de Jong JC, Eijgelsheim M, et al. Inhibitory protonové pumpy a hypomagnezémie v obecné populaci: populační kohortová studie. Am J Kidney Dis. 2015;66:775-782.
26. Park CH, Kim EH, Roh YH, et al. The association between the use of proton pump inhibitors and the risk of hypomagnesemia: a systematic review and meta-analysis. PLoS One. 2014;9:e112558.
27. Luk CP, Parsons R, Lee YP, Hughes JD. Hypomagnezémie spojená s inhibitory protonové pumpy: co nám říkají údaje FDA? Ann Pharmacother. 2013;47:773-780.
28. Cheungpasitporn W, Thongprayoon C, Kittanamongkolchai W, et al. Proton pump inhibitors linked to hypomagnesemia: a systematic review and meta-analysis of observational studies. Ren Fail. 2015;37:1237-1241.
29. Markovits N, Loebstein R, Halkin H, et al. The association of proton pump inhibitors and hypomagnesemia in the community setting. J Clin Pharmacol. 2014;54:889-895.
30. Park SH, Lee SH, Lee JS, et al. Změny koncentrace hořčíku v séru po použití inhibitoru protonové pumpy u pacientů podstupujících perkutánní koronární intervenci. Kidney Res Clin Pract. 2015;34:98-102.
31. Danziger J, William JH, Scott DJ, et al. Užívání inhibitorů protonové pumpy je spojeno s nízkou koncentrací hořčíku v séru. Kidney Int. 2013;83:692-699.
32. Begley J, Smith T, Barnett K, et al. Proton pump inhibitor associated hypomagnesaemia-a cause for concern? Br J Clin Pharmacol. 2016;81:753-758.
33. Abraham NS, Hlatky MA, Antman EM, et al. ACCF/ACG/AHA 2010 expert consensus document on the concomitant use of proton pump inhibitors and thienopyridines: a focused update of the ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use. Am J Gastroenterol. 2010;105:2533-2549.
34. Melloni C, Washam JB, Jones WS, et al. Rozporuplné výsledky randomizovaných studií a observačních studií o vlivu inhibitorů protonové pumpy na kardiovaskulární příhody při současném podávání s duální protidestičkovou léčbou: systematický přehled. Circ Cardiovasc Qual Outcomes. 2015;8:47-55.
35. Upozornění FDA, aby se zabránilo současnému užívání přípravku Plavix (klopidogrel) a omeprazolu. www.fda.gov/Drugs/DrugSafety/ucm231161.htm. Přístup 17. února 2017.
36. Bundhun PK, Teeluck AR, Bhurtu A, Huang WQ. Je současné užívání klopidogrelu a inhibitorů protonové pumpy stále spojeno se zvýšenými nežádoucími kardiovaskulárními následky po koronární angioplastice: systematický přehled a metaanalýza nedávno publikovaných studií (2012-2016). BMC Cardiovasc Disord. 2017;17:3.