US Pharm. 2017;42(6)(Generic Drugs suppl):38-42.
ABSTRACT: Inhibitory pompy protonowej (IPP) to klasa leków antysekrecyjnych stosowanych w leczeniu różnych schorzeń przewodu pokarmowego, takich jak choroba refluksowa przełyku, zaburzenia związane z Helicobacter pylori- oraz wrzody żołądka i dwunastnicy. Mimo że leki te są skutecznymi środkami hamującymi wydzielanie kwasu, stosowanie IPP jest często przedmiotem dyskusji ze względu na doniesienia o nowych potencjalnych zdarzeniach niepożądanych. Problemem związanym ze stosowaniem IPP jest nadmierne stosowanie oraz interakcje między lekami. Dodatkowo, ponieważ kilka IPP jest dostępnych bez recepty, niewłaściwe stosowanie tych środków jest poważnym problemem. Farmaceuci we wszystkich środowiskach mogą mieć ogromny wpływ na niewłaściwe stosowanie IPP poprzez zapewnienie odpowiedniego rozpoczęcia i kontynuacji terapii, dawkowania i czasu trwania leczenia.
Inhibitory pompy protonowej (IPP) są klasą leków powszechnie stosowanych w leczeniu różnych zaburzeń żołądkowo-jelitowych (GI), w tym choroby refluksowej przełyku (GERD), zaburzeń związanych z Helicobacter pylori oraz wrzodów żołądka i dwunastnicy. Mimo że te leki antysekrecyjne są preferowaną metodą leczenia wielu schorzeń, klasa ta jest nękana nadmiernym stosowaniem i doniesieniami o potencjalnie poważnych działaniach niepożądanych oraz interakcjach między lekami.1 Co więcej, postępowanie z pacjentem w przypadku schorzeń leczonych za pomocą IPP jest skomplikowane ze względu na dostępność wielu z tych leków bez recepty. Celem tego artykułu jest zwrócenie uwagi na właściwe stosowanie tych leków i przedstawienie opartego na dowodach naukowych opisu kilku nowych lub mocno dyskutowanych wad tych leków.
Dostępność IPP
Sześć unikalnych IPP, z których pięć jest dostępnych generycznie, można nabyć na receptę (TABELA 1).2-7 Małe dawki omeprazolu, lanzoprazolu i markowa wersja esomeprazolu magnezowego są dostępne bez recepty. Omeprazol jest również stosowany w postaci koformulowanej z wodorowęglanem sodu. W niniejszym artykule skupimy się przede wszystkim na ogólnie dostępnych, doustnie podawanych IPP.
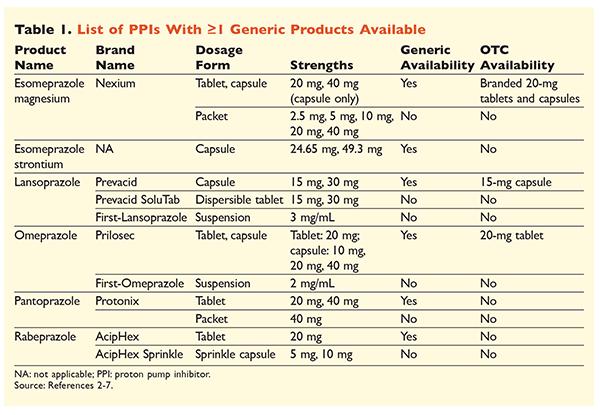
Esomeprazol strontu został zatwierdzony przez FDA na podstawie jego biorównoważności z esomeprazolem magnezu.3 Chociaż etykiety tych dwóch leków są bardzo podobne, istnieją trzy istotne różnice. Po pierwsze, esomeprazol strontium jest dostępny w kapsułkach zawierających 24,65 mg i 49,3 mg, które są równoważne esomeprazolowi magnezowemu w dawkach odpowiednio 20 mg i 40 mg. Po drugie, esomeprazol strontium nie jest zatwierdzony przez FDA do stosowania u pacjentów pediatrycznych, podczas gdy esomeprazol magnezowy jest zatwierdzony do stosowania u pacjentów w wieku 1 miesiąca i starszych. Wreszcie, należy unikać stosowania esomeprazolu strontu w przypadku ciężkich zaburzeń czynności nerek, ponieważ nie był on badany w tej populacji. Nie zaleca się dostosowania dawki dla esomeprazolu magnezowego.3 Dla celów niniejszego artykułu termin esomeprazol będzie używany do określenia esomeprazolu magnezowego.
Podawanie
Wszystkie ogólnie dostępne IPP, w tym kapsułki i tabletki, należy połykać w całości, bez dzielenia, kruszenia lub żucia.2-7 Kapsułki omeprazolu, lanzoprazolu i esomeprazolu mogą być otwierane, a ich zawartość posypana sosem jabłkowym dla pacjentów, którzy nie są w stanie połykać doustnych postaci leku. Ponadto kapsułki lanzoprazolu można zalać 2 uncjami soku jabłkowego, pomidorowego lub pomarańczowego. Wszelkie mieszaniny zawierające zawartość otwartych kapsułek należy natychmiast połknąć i nie wolno ich przechowywać do przyszłego użycia.2,4,5
Lansoprazol, omeprazol i esomeprazol należy podawać przed posiłkami, ale szczegółowe zalecenia dotyczące czasu podawania różnią się. Omeprazol należy podawać 30-60 minut przed posiłkiem, a esomeprazol co najmniej 60 minut wcześniej; dla lanzoprazolu nie określono ram czasowych.2,4,5 Pantoprazol można podawać z posiłkiem lub bez.6 Rabeprazol należy podawać po posiłku w przypadku wrzodów dwunastnicy i z posiłkiem w przypadku eradykacji H pylori; we wszystkich innych wskazaniach rabeprazol można podawać z posiłkiem lub bez.7
Dawkowanie i długość terapii
Zważywszy na reputację IPP jako leków bardzo skutecznych i generalnie bezpiecznych, poważnym problemem jest ich nadmierne stosowanie.1 Nie tylko IPP są często podawane we wskazaniach, co do których nie ma dowodów potwierdzających ich zastosowanie, ale również leki te są często przepisywane w dawkach większych niż konieczne, a czas ich stosowania wykracza poza zalecane ramy czasowe.8,9 Zatwierdzone dawkowanie każdego z IPP i zalecany czas trwania terapii podano w TABELACH 2 i 3. Poniżej przedstawiono zalecenia dotyczące leczenia, które różnią się od tych zatwierdzonych przez FDA, a także godne uwagi perły kliniczne związane z rozpoczynaniem, dawkowaniem i czasem trwania terapii IPP.
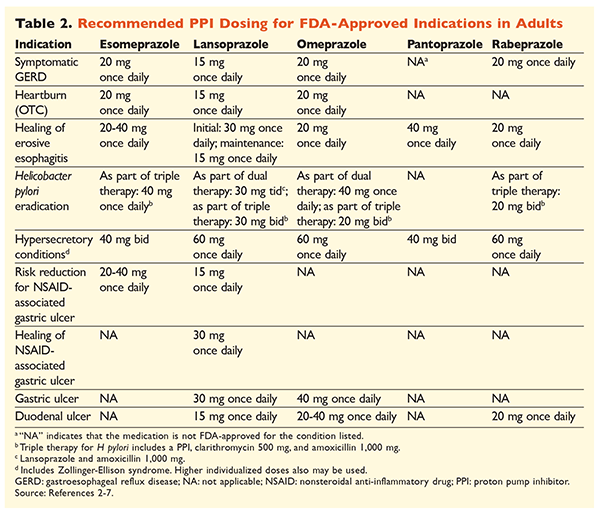
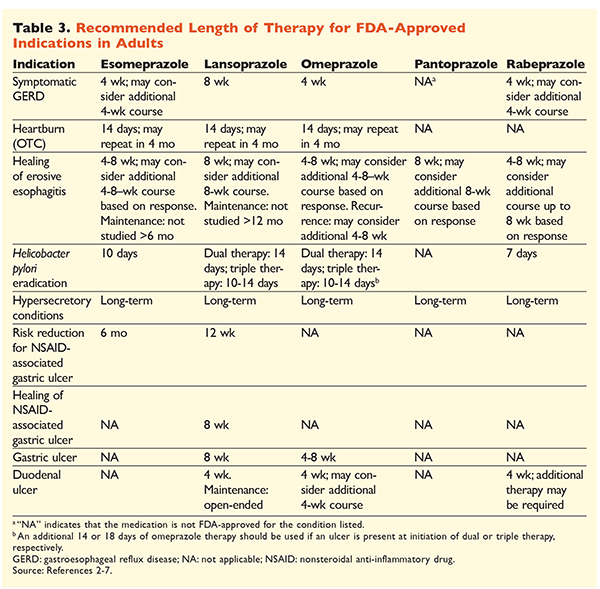
GERD: U pacjentów z GERD wszystkie IPP są uważane za równie skuteczne i zaleca się 8-tygodniowy kurs leczenia każdym dostępnym lekiem.10 Pacjenci, u których objawy nie ustępują po 2-3 miesiącach, mogą wymagać długotrwałej terapii podtrzymującej w dawkach podawanych dwa razy dziennie. Należy jednak stosować najmniejszą skuteczną dawkę, a jeśli pacjent nie reaguje na leczenie, należy rozważyć zastosowanie innego IPP.10 Można również rozważyć terapię IPP w razie potrzeby lub stopniowe przechodzenie na antagonistę receptora histaminowego2 (H2RA).10 Leczenie za pomocą IPP dostępnego bez recepty powinno być ograniczone do 14 dni, a ponowne leczenie powinno odbywać się nie częściej niż co 4 miesiące.11
Wrzody związane z H pylori: W zależności od stosowanego IPP, zatwierdzone przez FDA schematy eradykacji H pylori obejmują podwójną terapię amoksycyliną lub klarytromycyną oraz potrójną terapię obydwoma lekami przez 7 do 14 dni.2-5,7 Konkretne schematy leczenia wspierane przez wytyczne różnią się od tych zatwierdzonych przez FDA, ale zalecany czas trwania terapii jest podobny, przy czym wszystkie schematy mają ramy czasowe dawkowania od 10 do 14 dni.12 Po eradykacji H pylori podtrzymująca terapia IPP nie jest konieczna.13 Bardziej szczegółowe omówienie poszczególnych schematów wykracza poza zakres tego artykułu.
Profilaktyka i leczenie wrzodów wywołanych przez NLPZ: Po wystąpieniu owrzodzenia spowodowanego stosowaniem niesteroidowych leków przeciwzapalnych (NLPZ) należy ponownie ocenić potrzebę terapii NLPZ. Jeśli kontynuacja leczenia NLPZ jest uważana za właściwą, pacjenci powinni otrzymywać selektywną terapię cyklooksygenazą-2 w najmniejszej skutecznej dawce przez możliwie najkrótszy czas w połączeniu z IPP.13
W celach profilaktycznych rozpoczęcie stosowania IPP jest zalecane tylko u pacjentów z umiarkowanym lub dużym ryzykiem toksyczności żołądkowo-jelitowej związanej z NLPZ. Czynniki ryzyka obejmują wiek >65 lat, terapię dużymi dawkami NLPZ, niepowikłany wrzód w wywiadzie oraz jednoczesne stosowanie aspiryny (w tym małej dawki), kortykosteroidów lub leków przeciwzakrzepowych. Pacjenci, u których ryzyko toksyczności żołądkowo-jelitowej wywołanej przez NLPZ jest umiarkowane, to osoby z jednym lub dwoma z tych czynników ryzyka, natomiast pacjenci z grupy wysokiego ryzyka mają więcej niż dwa czynniki ryzyka lub przebyli w przeszłości powikłaną chorobę wrzodową, zwłaszcza jeśli wystąpiła niedawno.14 Rozsądne jest kontynuowanie terapii IPP tak długo, jak długo pacjent z grupy umiarkowanego lub wysokiego ryzyka pozostaje na terapii NLPZ.13
Wrzód idiopatyczny: Wrzody bez uchwytnej przyczyny mogą nawracać u pacjentów, którzy nie są leczeni preparatami hamującymi wydzielanie kwasu. Wytyczne nie zalecają jednoznacznie czasu, przez jaki pacjenci powinni być leczeni terapią podtrzymującą, ale sugerują, że stała terapia IPP zmniejsza ryzyko nawrotu owrzodzenia.13
Bezpieczeństwo
PPI są ogólnie uważane za dobrze tolerowaną klasę leków.1 Jednak kilka obaw związanych z bezpieczeństwem od dawna nęka ich reputację, w tym zwiększone ryzyko biegunki wywołanej przez Clostridium difficile, wspólnotowego zapalenia płuc i złamań kości.15,16 Ostatnio pojawiły się obawy dotyczące demencji i przewlekłej choroby nerek, a dyskusje dotyczące hipomagnezemii i teoretycznej interakcji lek-lek z klopidogrelem trwają nadal.
Demencja: Dwa ostatnie badania sugerują możliwość zwiększonego ryzyka demencji przy długotrwałym stosowaniu IPP u osób starszych.17,18 Proponowany mechanizm tego zjawiska polega na tym, że IPP sprzyjają rozwojowi blaszek beta-amyloidowych, co jest proponowaną patofizjologią choroby Alzheimera.15 Jednakże ograniczenia badań nie potwierdzają jednoznacznego związku przyczynowego pomiędzy stosowaniem IPP a zwiększoną częstością występowania demencji.19
Powikłania ze strony układu nerkowego: Chociaż IPP są powszechnie uznawane za powszechną przyczynę ostrego śródmiąższowego zapalenia nerek, nowsze dane wskazują również na udział tych leków w rozwoju innych powikłań nerkowych.15,20 Trzy ostatnie badania sugerują, że IPP mogą być odpowiedzialne za zwiększone ryzyko przewlekłej choroby nerek i progresji do schyłkowej niewydolności nerek.20-22 Jednak te badania obserwacyjne muszą być interpretowane z ostrożnością, ponieważ nie można potwierdzić przyczynowości.23
Hypomagnezemia: W 2011 roku FDA wydała ostrzeżenie, że długotrwałe stosowanie IPP przez okres przekraczający 1 rok może prowadzić do hipomagnezemii.24 Od tego czasu kilka dużych badań potwierdziło to stwierdzenie.25-29 Związek między IPP a hipomagnezemią nie jest jednak ostateczny i jest skomplikowany ze względu na zewnętrzne czynniki ryzyka.30-32 Obecnie klinicznie istotna hipomagnezemia wywołana przez IPP jest postrzegana jako rzadka i występuje częściej przy jednoczesnym stosowaniu diuretyków.31,32 Monitorowanie jest zalecane tylko u pacjentów z dodatkowymi czynnikami ryzyka.32
Interakcje z klopidogrelem: Klopidogrel odgrywa ważną rolę w zmniejszaniu ryzyka sercowo-naczyniowego, ale jest związany z krwawieniami z przewodu pokarmowego, szczególnie u pacjentów ze zwiększonym ryzykiem. Ochrona przewodu pokarmowego za pomocą IPP jest często stosowana u pacjentów, którzy są bardziej narażeni na wystąpienie krwawienia z przewodu pokarmowego, w tym u pacjentów z wcześniejszym krwawieniem z górnego odcinka przewodu pokarmowego; w zaawansowanym wieku; stosujących jednocześnie leki przeciwzakrzepowe, kortykosteroidy lub NLPZ (w tym aspirynę); i/lub zakażonych H pylori.33
P IPP hamują enzym CYP2C19, który jest głównym szlakiem aktywacji klopidogrelu.33 Interakcja ta może teoretycznie zmniejszać działanie przeciwpłytkowe klopidogrelu i zwiększać ryzyko niekorzystnych następstw sercowo-naczyniowych.33 Na podstawie niespójnych wyników badań farmakokinetycznych i prób klinicznych znaczenie kliniczne tej interakcji jest jednak niepewne.34
Ponadto brak jest spójnych dowodów dotyczących rzeczywistego wpływu poszczególnych IPP na działanie klopidogrelu.33 Najnowsze zalecenia FDA sugerują, że pantoprazol jest bezpieczniejszym wyborem niż inne IPP, natomiast omeprazol jest uważany za najbardziej ryzykowny.35 Aktualne dane nadal potwierdzają ten wniosek, ale konieczne są dodatkowe badania w celu potwierdzenia, czy istnieje różnica między poszczególnymi IPP.36
Podejmując decyzję o dodaniu terapii chroniącej przewód pokarmowy, należy rozważyć korzyści i ryzyko związane z leczeniem przeciwpłytkowym samym lub w połączeniu z IPP. U pacjentów z wysokim ryzykiem powikłań żołądkowo-jelitowych, korzystny wpływ terapii IPP może być większy niż zmniejszona skuteczność terapii przeciwpłytkowej, co zostało niejednoznacznie wykazane. U pacjentów z mniejszym ryzykiem powikłań żołądkowo-jelitowych rozsądną opcją terapeutyczną może być H2RA, chociaż wykazano, że ta klasa leków jest mniej skuteczna niż IPP w tym wskazaniu.33
Wnioski
Farmaceuci we wszystkich środowiskach mogą mieć ogromny wpływ na niewłaściwe stosowanie IPP poprzez zapewnienie właściwego rozpoczęcia i kontynuacji terapii, dawkowania i czasu trwania leczenia. Ponieważ wciąż pojawiają się sprzeczne dane dotyczące profilu bezpieczeństwa tych leków, długoterminowe stosowanie IPP staje się coraz bardziej skomplikowane. Dbając o to, aby najniższa odpowiednia dawka była stosowana przez najkrótszy konieczny czas, farmaceuci mogą pomóc w zapobieganiu niepotrzebnemu narażeniu pacjentów na potencjalne szkody.
1. Heidelbaugh JJ, Kim AH, Chang R, Walker PC. Overutilization of proton-pump inhibitors: what the clinician needs to know. Therap Adv Gastroenterol. 2012;5:219-232.
2. Nexium (esomeprazol magnezowy) ulotka dołączona do opakowania. Wilmington, DE: AstraZeneca Pharmaceuticals LP; grudzień 2016.
3. Ulotka dołączona do opakowania Esomeprazole strontium. Glasgow, KY: Amneal Pharmaceuticals; grudzień 2014 r.
4. Ulotka dołączona do opakowania Prevacid (lanzoprazol). Deerfield, IL: Takeda Pharmaceuticals America, Inc; październik 2016.
5. Prilosec (omeprazol) ulotka dołączona do opakowania. Wilmington, DE: AstraZeneca Pharmaceuticals LP; grudzień 2016.
6. Protonix (pantoprazol) ulotka dołączona do opakowania. Philadelphia, PA: Wyeth Pharmaceuticals Inc. October 2016.
7. ulotka dołączona do opakowania AcipHex (rabeprazol). Woodcliff Lake, NJ: Eisai Inc; kwiecień 2016 r.
8. Chia CT, Lim WP, Vu CK. Inappropriate use of proton pump inhibitors in a local setting. Singapore Med J. 2014;55:363-366.
9. Kelly OB, Dillane C, Patchett SE, et al. The inappropriate prescription of oral proton pump inhibitors in the hospital setting: a prospective cross-sectional study. Dig Dis Sci. 2015;60:2280-2286.
10. Katz PO, Gerson LB, Vela MF. Guidelines for the diagnosis and management of gastroesophageal reflux disease. Am J Gastroenterol. 2013;108:308-328.
11. FDA Drug Safety Communication: possible increased risk of fractures of the hip, wrist, and spine with the use of proton pump inhibitors. www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/ucm213206.htm. Dostęp 17 lutego 2017 r.
12. Chey WD, Leontiadis GI, Howden CW, Moss SF. ACG clinical guideline: treatment of Helicobacter pylori infection (Wytyczne kliniczne ACG: leczenie zakażenia Helicobacter pylori). Am J Gastroenterol. 2017;112:212-239.
13. Laine L, Jensen DM. Postępowanie u pacjentów z krwawieniem z wrzodów. Am J Gastroenterol. 2012;107:345-360.
14. Lanza FL, Chan FK, Quigley EM. Guidelines for prevention of NSAID-related ulcer complications. Am J Gastroenterol. 2009;104:728-738.
15. Eusebi LH, Rabitti S, Artesiani ML, et al. Proton pump inhibitors: risks of long-term use. J Gastroenterol Hepatol. 2017; Jan 16 .
16. Abramowitz J, Thakkar P, Isa A, et al. Adverse event reporting for proton pump inhibitor therapy: an overview of systematic reviews. Otolaryngol Head Neck Surg. 2016;155:547-554.
17. Haenisch B, von Holt K, Wiese B, et al. Risk of dementia in elderly patients with the use of proton pump inhibitors. Eur Arch Psychiatry Clin Neurosci. 2015;265:419-428.
18. Gomm W, von Holt K, Thomé F, et al. Association of proton pump inhibitors with risk of dementia: a pharmacoepidemiological claims data analysis. JAMA Neurol. 2016;73:410-416.
19. Kuller LH. Do proton pump inhibitors increase the risk of dementia? JAMA Neurol. 2016;73:379-381.
20. Arora P, Gupta A, Golzy M, et al. Proton pump inhibitors are associated with increased risk of development of chronic kidney disease. BMC Nephrol. 2016;17:112.
21. Xie Y, Bowe B, Li T, et al. Inhibitory pompy protonowej a ryzyko incydentu CKD i progresji do ESRD. J Am Soc Nephrol. 2016;27:3153-3163.
22. Lazarus B, Chen Y, Wilson FP, et al. Proton pump inhibitor use and the risk of chronic kidney disease. JAMA Intern Med. 2016;176:238-246.
23. Kia L, Kahrilas PJ. Terapia: ryzyko związane z przewlekłym stosowaniem IPP-sygnał czy szum? Nat Rev Gastroenterol Hepatol. 2016;13(5):253-254.
24. FDA Drug Safety Communication: niski poziom magnezu może być związany z długotrwałym stosowaniem leków z grupy inhibitorów pompy protonowej (PPIs). www.fda.gov/Drugs/DrugSafety/ucm245011.htm. Dostęp 17 lutego 2017 r.
25. Kieboom BC, Kiefte-de Jong JC, Eijgelsheim M, et al. Proton pump inhibitors and hypomagnesemia in the general population: a population-based cohort study. Am J Kidney Dis. 2015;66:775-782.
26. Park CH, Kim EH, Roh YH, et al. The association between the use of proton pump inhibitors and the risk of hypomagnesemia: a systematic review and meta-analysis. PLoS One. 2014;9:e112558.
27. Luk CP, Parsons R, Lee YP, Hughes JD. Proton pump inhibitor-associated hypomagnesemia: what do FDA data tell us? Ann Pharmacother. 2013;47:773-780.
28. Cheungpasitporn W, Thongprayoon C, Kittanamongkolchai W, et al. Proton pump inhibitors linked to hypomagnesemia: a systematic review and meta-analysis of observational studies. Ren Fail. 2015;37:1237-1241.
29. Markovits N, Loebstein R, Halkin H, et al. The association of proton pump inhibitors and hypomagnesemia in the community setting. J Clin Pharmacol. 2014;54:889-895.
30. Park SH, Lee SH, Lee JS, et al. Changes in serum magnesium concentration after use of a proton pump inhibitor in patients undergoing percutaneous coronary intervention. Kidney Res Clin Pract. 2015;34:98-102.
31. Danziger J, William JH, Scott DJ, et al. Proton-pump inhibitor use is associated with low serum magnesium concentrations. Kidney Int. 2013;83:692-699.
32. Begley J, Smith T, Barnett K, et al. Proton pump inhibitor associated hypomagnesaemia-a cause for concern? Br J Clin Pharmacol. 2016;81:753-758.
33. Abraham NS, Hlatky MA, Antman EM, et al. ACCF/ACG/AHA 2010 expert consensus document on the concomitant use of proton pump inhibitors and thienopyridines: a focused update of the ACCF/ACG/AHA 2008 expert consensus document on reducing the gastrointestinal risks of antiplatelet therapy and NSAID use. Am J Gastroenterol. 2010;105:2533-2549.
34. Melloni C, Washam JB, Jones WS, et al. Conflicting results between randomized trials and observational studies on the impact of proton pump inhibitors on cardiovascular events when coadministered with dual antiplatelet therapy: systematic review. Circ Cardiovasc Qual Outcomes. 2015;8:47-55.
35. Przypomnienie FDA o konieczności unikania jednoczesnego stosowania preparatu Plavix (klopidogrel) i omeprazolu. www.fda.gov/Drugs/DrugSafety/ucm231161.htm. Dostęp 17 lutego 2017 r.
36. Bundhun PK, Teeluck AR, Bhurtu A, Huang WQ. Is the concomitant use of clopidogrel and proton pump inhibitors still associated with increased adverse cardiovascular outcomes following coronary angioplasty?: a systematic review and meta-analysis of recently published studies (2012-2016). BMC Cardiovasc Disord. 2017;17:3.