US Pharm. 2017;42(6)(Generic Drugs suppl):38-42.
ABSTRACT : Les inhibiteurs de la pompe à protons (IPP) sont une classe d’agents antisécrétoires utilisés pour traiter diverses affections gastro-intestinales, telles que le reflux gastro-œsophagien, les troubles liés à Helicobacter pylori et les ulcères gastriques et duodénaux. Bien que ces agents soient des suppresseurs d’acide efficaces, l’utilisation des IPP est fréquemment débattue sur la base des rapports de nouveaux effets indésirables potentiels. La surutilisation et les interactions médicamenteuses sont des problèmes associés aux IPP. De plus, comme plusieurs IPP sont en vente libre, l’utilisation inappropriée de ces agents est une préoccupation importante. Les pharmaciens de tous les milieux peuvent avoir un impact profond sur l’utilisation inappropriée des IPP en veillant à ce que l’initiation et la poursuite du traitement, la posologie et la durée du traitement soient appropriées.
Les inhibiteurs de la pompe à protons (IPP) sont une classe de médicaments couramment utilisés pour le traitement de divers troubles gastro-intestinaux (GI), notamment le reflux gastro-œsophagien (RGO), les troubles liés à Helicobacter pylori et les ulcères gastriques et duodénaux. Bien que ces agents antisécrétoires soient le traitement de prédilection pour de nombreuses affections, la classe est en proie à une surutilisation et à des rapports d’effets indésirables potentiellement graves et d’interactions médicamenteuses.1 De plus, la prise en charge des patients atteints d’affections traitées par les IPP est compliquée par la disponibilité en vente libre de plusieurs de ces agents. Cet article vise à souligner l’utilisation appropriée et à fournir une description fondée sur des preuves de plusieurs inconvénients nouveaux ou fortement débattus de ces agents.
Disponibilité des IPP
Six IPP uniques, dont cinq sont disponibles sous forme générique, peuvent être obtenus sur ordonnance (TABLEAU 1).2-7 De faibles doses d’oméprazole, de lansoprazole et une version de marque de l’ésoméprazole magnésium sont disponibles en vente libre. L’oméprazole est également utilisé dans un produit coformulé avec du bicarbonate de sodium. Cet article se concentrera principalement sur les IPP disponibles génériquement et dosés par voie orale.
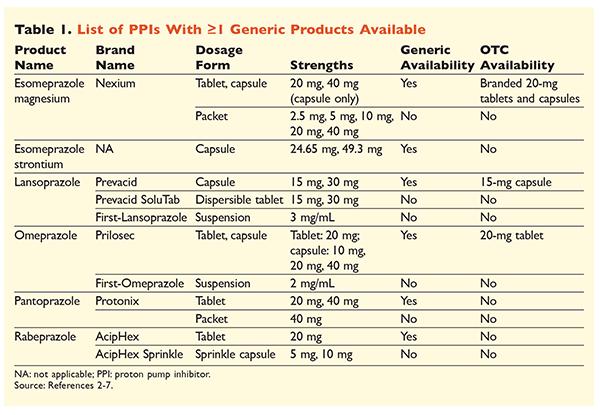
L’ésoméprazole strontium a été approuvé par la FDA sur la base de sa bioéquivalence avec l’ésoméprazole magnésium.3 Bien que l’étiquetage du produit pour ces deux agents soit très similaire, trois différences notables existent. Premièrement, l’ésoméprazole strontium est disponible en capsules de 24,65 mg et 49,3 mg, qui sont équivalentes à l’ésoméprazole magnésium 20 mg et 40 mg, respectivement. Deuxièmement, l’ésoméprazole strontium n’est pas approuvé par la FDA pour une utilisation chez les patients pédiatriques, alors que l’ésoméprazole magnésium est approuvé pour une utilisation chez les personnes âgées de 1 mois et plus. Enfin, l’utilisation de l’ésoméprazole strontium doit être évitée en cas d’insuffisance rénale sévère car il n’a pas été étudié dans cette population. Aucun ajustement posologique n’est recommandé pour l’ésoméprazole magnésium.3 Dans le cadre de cet article, le terme ésoméprazole sera utilisé pour décrire l’ésoméprazole magnésium.
Administration
Tous les IPP génériques, y compris les gélules et les comprimés, doivent être avalés entiers sans être fendus, écrasés ou mâchés2-7. Les capsules d’oméprazole, de lansoprazole et d’ésoméprazole peuvent être ouvertes et leur contenu saupoudré sur de la compote de pommes pour les patients incapables d’avaler les formes posologiques orales. De plus, les capsules de lansoprazole peuvent être saupoudrées dans 2 oz de jus de pomme, de tomate ou d’orange. Tout mélange contenant le contenu de capsules ouvertes doit être avalé immédiatement et ne doit pas être conservé pour une utilisation ultérieure.2,4,5
Leansoprazole, l’oméprazole et l’ésoméprazole doivent être administrés avant les repas, mais les recommandations spécifiques sur les moments d’administration varient. L’oméprazole doit être administré 30 à 60 minutes avant le repas, et l’ésoméprazole au moins 60 minutes avant ; un délai n’est pas précisé pour le lansoprazole.2,4,5 Le pantoprazole peut être administré avec ou sans nourriture.6 Le rabéprazole doit être pris après le repas pour les ulcères duodénaux et avec le repas pour l’éradication de H pylori ; pour toutes les autres indications, le rabéprazole peut être pris avec ou sans nourriture.7
Dosage et durée du traitement
Compte tenu de la réputation des IPP d’être très efficaces et généralement sûrs, une surutilisation importante des IPP est une préoccupation majeure.Non seulement les IPP sont souvent administrés pour des indications sans preuve à l’appui de leur utilisation, mais ces médicaments sont également fréquemment prescrits à des doses plus élevées que nécessaire pour des durées de traitement dépassant les délais recommandés.8,9 La posologie approuvée de chaque IPP et la durée recommandée du traitement sont indiquées dans les TABLEAUX 2 et 3. Les recommandations de traitement qui diffèrent de celles approuvées par la FDA, ainsi que les perles cliniques notables liées à l’initiation, à la posologie et à la durée du traitement par les IPP, sont décrites ci-dessous.
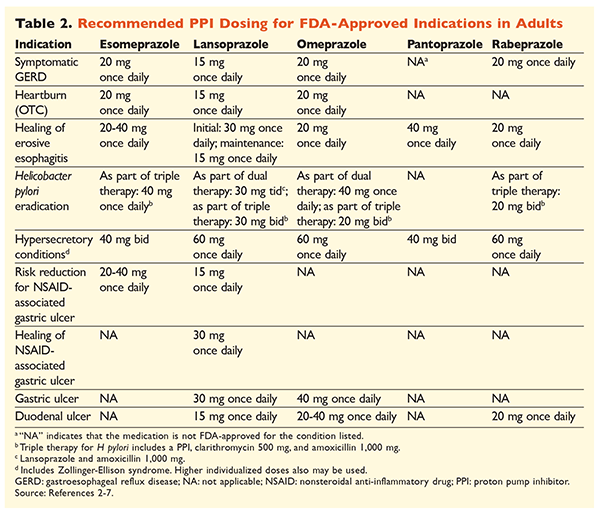
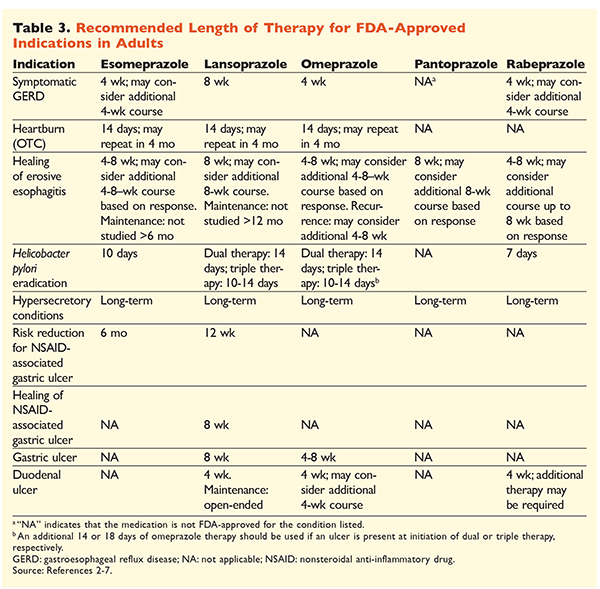
GRO : Chez les patients atteints de RGO, tous les IPP sont considérés comme également efficaces, et un traitement de 8 semaines avec tout agent disponible est recommandé.10 Les patients dont les symptômes sont réfractaires au traitement après 2 à 3 mois peuvent nécessiter un traitement d’entretien à long terme avec des doses biquotidiennes. Cependant, la dose efficace la plus faible doit être utilisée et un autre IPP doit être envisagé si le patient ne répond pas au traitement.10 On peut également envisager un traitement par IPP au besoin ou une approche progressive vers un antagoniste des récepteurs de l’histamine 2 (ARH2).10 Le traitement par un IPP en vente libre doit être limité à 14 jours, avec un retraitement au maximum tous les 4 mois.11
Ulcères associés à H. pylori : Selon l’IPP utilisé, les schémas thérapeutiques approuvés par la FDA pour l’éradication de H pylori comprennent une bithérapie avec soit de l’amoxicilline, soit de la clarithromycine, et une trithérapie avec les deux agents pendant 7 à 14 jours.2-5,7 Les schémas thérapeutiques spécifiques soutenus par les lignes directrices varient par rapport à ceux approuvés par la FDA, mais la durée recommandée du traitement est similaire, tous les schémas ayant une durée d’administration de 10 à 14 jours12. Après l’éradication de H pylori, un traitement d’entretien par IPP n’est pas nécessaire.13 Une discussion plus détaillée des régimes spécifiques dépasse le cadre de cet article.
Prophylaxie et traitement des ulcères induits par les AINS : Après le développement d’un ulcère associé à un anti-inflammatoire non stéroïdien (AINS), la nécessité d’un traitement AINS doit être réévaluée. Si la poursuite du traitement par AINS est jugée appropriée, les patients doivent être maintenus sous traitement sélectif par cyclooxygénase-2 à la dose efficace la plus faible pendant la durée la plus courte possible, en association avec un IPP.13
Pour la prophylaxie, l’initiation d’un IPP est recommandée uniquement chez les patients présentant un risque modéré ou élevé de toxicité gastro-intestinale liée aux AINS. Les facteurs de risque comprennent un âge >65 ans, un traitement par AINS à forte dose, un antécédent d’ulcère non compliqué et l’utilisation simultanée d’aspirine (y compris à faible dose), de corticostéroïdes ou d’anticoagulants. Les patients considérés comme présentant un risque modéré de toxicité gastro-intestinale induite par les AINS sont ceux qui présentent un ou deux de ces facteurs de risque, tandis que les patients à risque élevé présentent plus de deux facteurs de risque ou des antécédents d’ulcère gastroduodénal compliqué, surtout s’il était récent.14 Il est raisonnable de poursuivre le traitement par IPP tant que le patient à risque modéré ou élevé reste sous traitement AINS.13
Ulcère idiopathique : Les ulcères sans cause clairement identifiable sont susceptibles de récidiver chez les patients qui ne sont pas traités par un traitement antiacide. Les lignes directrices ne recommandent pas clairement la durée pendant laquelle les patients doivent être traités par un traitement d’entretien, mais elles suggèrent qu’un traitement continu par les IPP réduit le risque de formation d’ulcères récurrents.13
Sécurité
Les IPP sont généralement considérés comme une classe de médicaments bien tolérée.1 Cependant, plusieurs problèmes de sécurité ont longtemps entaché leur réputation, notamment un risque accru de diarrhée associée à Clostridium difficile, de pneumonie communautaire et de fractures osseuses.15,16 Plus récemment, des préoccupations concernant la démence et les maladies rénales chroniques ont été soulevées, et les débats concernant l’hypomagnésémie et une interaction médicamenteuse théorique avec le clopidogrel se sont poursuivis.
Démence : Deux études récentes ont suggéré la possibilité d’un risque accru de démence avec l’utilisation à long terme des IPP chez les personnes âgées.17,18 Un mécanisme proposé derrière cette constatation est que les IPP favorisent le développement de plaques bêta-amyloïdes, une physiopathologie proposée de la maladie d’Alzheimer.15 Cependant, les limites de l’étude ne soutiennent pas une relation causale concluante entre l’utilisation des IPP et une incidence accrue de démence.19
Complications rénales : Bien que les IPP aient été largement reconnus comme une cause courante de néphrite interstitielle aiguë, des données plus récentes impliquent également ces agents dans le développement d’autres complications rénales.15,20 Trois essais récents ont suggéré que les IPP pourraient être responsables d’un risque accru de maladie rénale chronique et de progression vers l’insuffisance rénale terminale.20-22 Cependant, ces études d’observation doivent être interprétées avec prudence, car la causalité ne peut être confirmée.23
Hypomagnésémie : En 2011, la FDA a émis un avertissement selon lequel l’utilisation prolongée des IPP pendant des périodes supérieures à 1 an peut entraîner une hypomagnésémie.24 Depuis lors, plusieurs études d’envergure ont appuyé cette constatation.25-29 La relation entre les IPP et l’hypomagnésémie n’est toutefois pas définitive et elle est compliquée par des facteurs de risque extérieurs.30-32. Actuellement, l’hypomagnésémie cliniquement significative induite par les IPP est considérée comme rare et se produit plus fréquemment avec l’utilisation concomitante de diurétiques.31,32 La surveillance est recommandée uniquement chez les patients présentant des facteurs de risque supplémentaires.32
Interaction médicamenteuse avec le clopidogrel : Le clopidogrel joue un rôle important dans la réduction du risque cardiovasculaire, mais il est associé à des saignements gastro-intestinaux, en particulier chez les patients à risque accru. Une protection GI avec des IPP est souvent mise en place chez les patients qui sont plus susceptibles de subir un saignement GI, y compris ceux qui ont déjà eu un saignement GI supérieur ; un âge avancé ; l’utilisation simultanée d’anticoagulants, de corticostéroïdes ou d’AINS (y compris l’aspirine) ; et/ou une infection par H pylori.33
On pense que les IPP inhibent l’enzyme CYP2C19, la principale voie par laquelle le clopidogrel est activé.33 Cette interaction peut théoriquement diminuer les effets antiplaquettaires du clopidogrel et augmenter le risque de résultats cardiovasculaires indésirables.33 Sur la base de résultats incohérents provenant à la fois d’études pharmacocinétiques et d’essais de résultats, l’importance clinique de cette interaction est toutefois incertaine34.
De plus, il y a un manque de cohérence dans les preuves concernant l’impact réel des IPP individuels sur les effets du clopidogrel.33 Les dernières recommandations de la FDA suggèrent que le pantoprazole est un choix plus sûr que les autres IPP, alors que l’oméprazole est considéré comme le plus risqué35. Les données actuelles continuent de soutenir cette conclusion, mais des études supplémentaires sont nécessaires pour confirmer l’existence d’une différence entre les IPP.36
Il est important de peser les avantages et les risques d’un traitement antiplaquettaire seul ou en association avec un IPP lorsqu’on décide d’ajouter un traitement gastro-protecteur. Chez les patients à haut risque de complications GI, les effets bénéfiques du traitement par IPP peuvent être plus importants que la diminution de l’efficacité du traitement antiplaquettaire, ce qui a été démontré de manière inconstante. Chez les patients présentant un risque plus faible de complications GI, un ARH2 peut constituer une option thérapeutique raisonnable, bien qu’il ait été démontré que cette classe est moins efficace que les IPP pour cette indication.33
Conclusion
Les pharmaciens de tous les milieux peuvent avoir un impact profond sur l’utilisation inappropriée des IPP en veillant à l’instauration et à la poursuite appropriées du traitement, à la posologie et à la durée du traitement. Comme des données contradictoires continuent d’émerger concernant les profils de sécurité de ces médicaments, l’utilisation à long terme des IPP devient plus compliquée. En veillant à ce que la dose appropriée la plus faible soit utilisée pendant la plus courte durée nécessaire, les pharmaciens peuvent aider à prévenir l’exposition inutile des patients à des méfaits potentiels.
1. Heidelbaugh JJ, Kim AH, Chang R, Walker PC. Surutilisation des inhibiteurs de la pompe à protons : ce que le clinicien doit savoir. Therap Adv Gastroenterol. 2012;5:219-232.
2. notice de Nexium (esoméprazole magnésium). Wilmington, DE : AstraZeneca Pharmaceuticals LP ; décembre 2016.
3. Notice d’emballage de l’esoméprazole strontium. Glasgow, KY : Amneal Pharmaceuticals ; décembre 2014.
4. notice de Prevacid (lansoprazole). Deerfield, IL : Takeda Pharmaceuticals America, Inc ; octobre 2016.
5. Prilosec (oméprazole) notice d’emballage. Wilmington, DE : AstraZeneca Pharmaceuticals LP ; décembre 2016.
6. Protonix (pantoprazole) notice d’emballage. Philadelphie, PA : Wyeth Pharmaceuticals Inc. Octobre 2016.
7. notice d’AcipHex (rabeprazole). Woodcliff Lake, NJ : Eisai Inc ; avril 2016.
8. Chia CT, Lim WP, Vu CK. Utilisation inappropriée des inhibiteurs de la pompe à protons dans un contexte local. Singapore Med J. 2014;55:363-366.
9. Kelly OB, Dillane C, Patchett SE, et al. La prescription inappropriée d’inhibiteurs oraux de la pompe à protons en milieu hospitalier : une étude prospective transversale. Dig Dis Sci. 2015;60:2280-2286.
10. Katz PO, Gerson LB, Vela MF. Lignes directrices pour le diagnostic et la prise en charge du reflux gastro-œsophagien. Am J Gastroenterol. 2013;108:308-328.
11. Communication de la FDA sur la sécurité des médicaments : augmentation possible du risque de fractures de la hanche, du poignet et de la colonne vertébrale avec l’utilisation des inhibiteurs de la pompe à protons. www.fda.gov/Drugs/DrugSafety/PostmarketDrugSafetyInformationforPatientsandProviders/ucm213206.htm. Consulté le 17 février 2017.
12. Chey WD, Leontiadis GI, Howden CW, Moss SF. Guide clinique de l’ACG : traitement de l’infection à Helicobacter pylori. Am J Gastroenterol. 2017;112:212-239.
13. Laine L, Jensen DM. Prise en charge des patients présentant des saignements d’ulcères. Am J Gastroenterol. 2012;107:345-360.
14. Lanza FL, Chan FK, Quigley EM. Lignes directrices pour la prévention des complications ulcéreuses liées aux AINS. Am J Gastroenterol. 2009;104:728-738.
15. Eusebi LH, Rabitti S, Artesiani ML, et al. Inhibiteurs de la pompe à protons : risques de l’utilisation à long terme. J Gastroenterol Hepatol. 2017 ; Jan 16 .
16. Abramowitz J, Thakkar P, Isa A, et al. Déclaration des effets indésirables du traitement par inhibiteurs de la pompe à protons : un aperçu des examens systématiques. Otolaryngol Head Neck Surg. 2016;155:547-554.
17. Haenisch B, von Holt K, Wiese B, et al. Risque de démence chez les patients âgés avec l’utilisation d’inhibiteurs de la pompe à protons. Eur Arch Psychiatry Clin Neurosci. 2015;265:419-428.
18. Gomm W, von Holt K, Thomé F, et al. Association des inhibiteurs de la pompe à protons avec le risque de démence : une analyse des données de réclamations pharmacoépidémiologiques. JAMA Neurol. 2016;73:410-416.
19. Kuller LH. Les inhibiteurs de la pompe à protons augmentent-ils le risque de démence ? JAMA Neurol. 2016;73:379-381.
20. Arora P, Gupta A, Golzy M, et al. Les inhibiteurs de la pompe à protons sont associés à un risque accru de développement d’une maladie rénale chronique. BMC Nephrol. 2016;17:112.
21. Xie Y, Bowe B, Li T, et al. Les inhibiteurs de la pompe à protons et le risque de maladie rénale chronique incidente et de progression vers l’IRT. J Am Soc Nephrol. 2016;27:3153-3163.
22. Lazarus B, Chen Y, Wilson FP, et al. L’utilisation d’un inhibiteur de la pompe à protons et le risque de maladie rénale chronique. JAMA Intern Med. 2016;176:238-246.
23. Kia L, Kahrilas PJ. Thérapie : risques associés à l’utilisation chronique des IPP-signal ou bruit ? Nat Rev Gastroenterol Hepatol. 2016;13(5):253-254.
24. Communication sur la sécurité des médicaments de la FDA : de faibles niveaux de magnésium peuvent être associés à l’utilisation à long terme des inhibiteurs de la pompe à protons (IPP). www.fda.gov/Drugs/DrugSafety/ucm245011.htm. Consulté le 17 février 2017.
25. Kieboom BC, Kiefte-de Jong JC, Eijgelsheim M, et al. Inhibiteurs de la pompe à protons et hypomagnésémie dans la population générale : une étude de cohorte basée sur la population. Am J Kidney Dis. 2015;66:775-782.
26. Park CH, Kim EH, Roh YH, et al. L’association entre l’utilisation des inhibiteurs de la pompe à protons et le risque d’hypomagnésémie : une revue systématique et une méta-analyse. PLoS One. 2014;9:e112558.
27. Luk CP, Parsons R, Lee YP, Hughes JD. Hypomagnésémie associée aux inhibiteurs de la pompe à protons : que nous disent les données de la FDA ? Ann Pharmacother. 2013;47:773-780.
28. Cheungpasitporn W, Thongprayoon C, Kittanamongkolchai W, et al. Inhibiteurs de la pompe à protons liés à l’hypomagnésémie : une revue systématique et une méta-analyse des études observationnelles. Ren Fail. 2015;37:1237-1241.
29. Markovits N, Loebstein R, Halkin H, et al. L’association des inhibiteurs de la pompe à protons et de l’hypomagnésémie dans le contexte communautaire. J Clin Pharmacol. 2014;54:889-895.
30. Park SH, Lee SH, Lee JS, et al. Changements dans la concentration de magnésium sérique après l’utilisation d’un inhibiteur de la pompe à protons chez les patients subissant une intervention coronarienne percutanée. Kidney Res Clin Pract. 2015;34:98-102.
31. Danziger J, William JH, Scott DJ, et al. L’utilisation d’un inhibiteur de la pompe à protons est associée à de faibles concentrations de magnésium sérique. Kidney Int. 2013;83:692-699.
32. Begley J, Smith T, Barnett K, et al. L’hypomagnésémie associée aux inhibiteurs de la pompe à protons : une cause d’inquiétude ? Br J Clin Pharmacol. 2016;81:753-758.
33. Abraham NS, Hlatky MA, Antman EM, et al. Document de consensus d’experts ACCF/ACG/AHA 2010 sur l’utilisation concomitante des inhibiteurs de la pompe à protons et des thiénopyridines : une mise à jour ciblée du document de consensus d’experts ACCF/ACG/AHA 2008 sur la réduction des risques gastro-intestinaux du traitement antiplaquettaire et de l’utilisation des AINS. Am J Gastroenterol. 2010;105:2533-2549.
34. Melloni C, Washam JB, Jones WS, et al. Résultats contradictoires entre les essais randomisés et les études observationnelles sur l’impact des inhibiteurs de la pompe à protons sur les événements cardiovasculaires lorsqu’ils sont coadministrés avec une double thérapie antiplaquettaire : revue systématique. Circ Cardiovasc Qual Outcomes. 2015;8:47-55.
35. Rappel de la FDA pour éviter l’utilisation concomitante de Plavix (clopidogrel) et de l’oméprazole. www.fda.gov/Drugs/DrugSafety/ucm231161.htm. Consulté le 17 février 2017.
36. Bundhun PK, Teeluck AR, Bhurtu A, Huang WQ. L’utilisation concomitante de clopidogrel et d’inhibiteurs de la pompe à protons est-elle toujours associée à une augmentation des résultats cardiovasculaires indésirables après une angioplastie coronaire ? : une revue systématique et une méta-analyse des études récemment publiées (2012-2016). BMC Cardiovasc Disord. 2017;17:3.