Descargar este número Volver al resumen
Steven E. ZIMMET2,3
Austin, Estados Unidos
ABSTRACT
La ablación láser endovenosa (EVLA) es una alternativa menos invasiva a la extirpación venosa. Los resultados parecen ser iguales o mejores que los de la extirpación venosa, con mejores puntuaciones de calidad de vida en el período postoperatorio. Se ha demostrado que la EVLA corrige o mejora significativamente la anomalía hemodinámica en pacientes con insuficiencia venosa crónica (IVC) con reflujo venoso superficial. Los primeros informes sugieren que las técnicas de ablación endovenosa, a diferencia de la extirpación quirúrgica, se asocian a una baja incidencia de neovascularización.
Se está utilizando una variedad de longitudes de onda para realizar la EVLA. Mientras que el cromóforo inicial es el agua o la hemoglobina, dependiendo de la longitud de onda utilizada, el carbono parece ser un cromóforo secundario pero clave que es probablemente independiente de la longitud de onda.
La aplicación de los principios de la anestesia tumescente a los tratamientos venosos, junto con el desarrollo de las técnicas de ablación endovenosa, ofrecen la posibilidad de tratar a la gran mayoría de los pacientes con varices en la consulta sin anestesia general ni incisiones quirúrgicas, al tiempo que se maximizan los resultados y se minimizan las recidivas.
INTRODUCCIÓN
El reflujo de la vena safena es la anomalía primaria subyacente en la mayoría de los casos de insuficiencia venosa superficial. Así, los enfoques para tratar la unión safenofemoral y la incompetencia troncal safena han dominado el pensamiento de los flebólogos. Trendelenburg describió en la década de 1890 la ligadura de la unión safenofemoral sola, sin la extirpación de la vena safena incompetente. Las ventajas de la ligadura sola sobre la ligadura y la extirpación, que todavía se ensalzan hoy en día,1 incluyen la preservación del tronco safeno para su posible uso futuro como injerto de derivación2 y la evitación de la lesión del nervio safeno.3 La ligadura alta por sí misma es menos invasiva, más rápida y sencilla de realizar, y se asocia a una recuperación más fácil en comparación con la extirpación venosa. Si bien es cierto que «salva» de forma rutinaria el tronco de la safena4 , el uso de una vena safena enferma como conducto se ha asociado a un mayor riesgo de fracaso del injerto.5 Lo más importante es que ya no hay duda de que la ligadura alta por sí sola suele dar lugar a un reflujo persistente en el tronco de la safena.6,7 La recidiva varicosa se reduce significativamente7-9 y la tasa de reintervención es entre un 60% y un 70% menor si se realiza la extirpación de la vena safena en comparación con la ligadura sola.10,11 Además, después de la ligadura sola, se encontró recurrencia o comunicación residual con la confluencia en la ingle en el 80% de los pacientes, mientras que el 34% también presentaba incompetencia de la perforante del muslo a través de la vena safena mayor (GSV) no extirpada.12 Como concluyó Neglen, la extirpación de la GSV del muslo es esencial para minimizar la recurrencia causada por el nuevo desarrollo de la comunicación incompetente con la confluencia safenofemoral, y debido a la incompetencia de la perforante del muslo.13 En pocas palabras, las deficiencias de la ligadura por sí sola superan sus ventajas.
Es importante señalar que la recurrencia es común incluso después de la ligadura y la extirpación de la vena safena. Aunque la cirugía inadecuada de la unión safenofemoral y la progresión de la enfermedad son mecanismos que explican algunos casos de recidiva, otro mecanismo importante es la neovascularización alrededor de la unión después de la cirugía venosa.11,14 De hecho, se ha informado de que la neovascularización es la principal causa de recidiva,9 con canales neovasculares de tamaño, número y tortuosidad variables que explican el reflujo a varices recurrentes en la mayoría de los casos.15 Aunque algunos han expresado dudas sobre la veracidad de la verdadera neovascularización, existen claras pruebas histológicas de que la neovascularización es una causa de las varices recurrentes.16 Los primeros informes sugieren, por el contrario, que las técnicas de ablación endovenosa se asocian a una incidencia muy baja de neovascularización. 17 Es posible que el desarrollo de neovascularización se prevenga en gran medida evitando la disección inguinal y preservando el drenaje venoso en los afluentes normales de la unión.18,19
La EVLA, al igual que la ablación por radiofrecuencia y la escleroterapia con espuma, es una alternativa menos invasiva a la extirpación venosa. La EVLA está indicada en un paciente ambulatorio con reflujo de vena safena grande, pequeña o accesoria con várices superficiales y/o síntomas o complicaciones relacionadas con la insuficiencia venosa superficial. La EVLA se realiza de forma rutinaria utilizando anestesia local diluida, con o sin ansiolíticos orales suplementarios, en un entorno de oficina. La duración de la intervención, que suele ser de 30 a 60 minutos, depende de la longitud del segmento tratado, de la experiencia del operador y de si se realizan procedimientos auxiliares, como la flebectomía ambulatoria. Independientemente de cómo se trate la incompetencia safena subyacente, suelen ser necesarios tratamientos auxiliares para tratar las varices residuales (Figura 1).
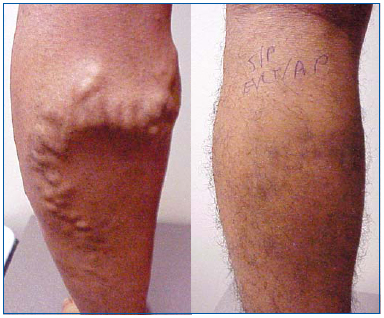
Figura 1. Varón de 26 años antes y 1 mes después de la ablación con láser endovenoso de la vena safena mayor y flebectomía ambulatoria de afluentes varicosos.
EFICACIA
Los estudios a corto y medio plazo de EVLA, independientemente de la longitud de onda utilizada, parecen ser notablemente consistentes, informando normalmente de la ablación de las venas safenas refluyentes en el 90% o más de los casos.18,20-23 Se ha demostrado que la EVLA de la vena safena corrige o mejora significativamente la anomalía hemodinámica y los síntomas clínicos de la insuficiencia venosa crónica (IVC) en pacientes de clase clínica 3-6 de la CEAP con reflujo venoso superficial.24,25 Los resultados parecen ser iguales o mejores que los de la extirpación, con mejores puntuaciones de calidad de vida en el período postoperatorio en comparación con la extirpación.20,25-27 Se ha informado de altas tasas de satisfacción de los pacientes.18,28,29 El coste total (coste del procedimiento más coste social) de los procedimientos endovenosos es probablemente igual o inferior al de la cirugía.27
Los primeros datos sobre el tratamiento de la GSV con dispositivos de 810 nm y 940 nm sugieren que el fracaso del tratamiento es infrecuente en los pacientes tratados con > 70 J/cm.30,31 Una velocidad de retirada de 2 mm/seg a 14 vatios proporciona 70 J/cm.
MECANISMO DE ACCIÓN
Las siguientes longitudes de onda se utilizan actualmente para la EVLA: 810, 940, 980, 1064, 1319, 1320 y 2068 nm. Se ha postulado que la lesión de la pared de la vena está mediada tanto por el efecto directo como indirectamente a través del vapor inducido por el láser generado por el calentamiento de pequeñas cantidades de sangre dentro de la vena.32 Algunos han sugerido que la elección de la longitud de onda afecta en gran medida a los resultados.23
El principal cromóforo de los láseres de 1320 y 2078 nm, al menos inicialmente, es el agua, mientras que otras longitudes de onda utilizadas para EVLA se dirigen principalmente a la hemoglobina. Obviamente, es imprescindible dañar térmicamente la pared de la vena de forma adecuada para obtener una ablación eficaz. Puede producirse cierto calentamiento por absorción directa de energía fotónica (radiación) por la pared de la vena, así como por convección de las burbujas de vapor y por conducción de la sangre calentada. Sin embargo, es poco probable que estos últimos mecanismos representen la mayor parte del impacto en la vena. La temperatura máxima de la sangre es de 100°C. Se ha observado que el tratamiento con láser produce la carbonización de la pared de la vena.33 La carbonización de la punta del láser, que se produce a unos 300°C, se observa tras la EVLA, y parece producirse independientemente de la longitud de onda utilizada.34 La carbonización de la punta de la fibra láser crea una fuente de calor puntual y reduce esencialmente la penetración de la luz en el tejido a cero.34,35 Mordon et al afirmaron que «el vapor producido por la absorción de la energía del láser por la sangre es una pequeña fracción de la energía necesaria para dañar la pared de la vena y no puede ser el principal mecanismo de lesión de la vena con el láser endovenoso. La carbonización y el tracto dentro de las paredes de la vena que se observan en la histología después del láser endovenoso sólo pueden ser el resultado del contacto directo entre la punta de la fibra láser y la pared de la vena».36 El Dr. Rox Anderson, director del Centro Wellman de Fotomedicina del Hospital General de Massachusetts, informó de que el carbono parece ser un cromóforo secundario pero clave que probablemente es independiente de la longitud de onda (Figura 2).34 Obsérvese que la punta y la forma de la fibra pueden influir en el desarrollo de la carbonización.37

Figura 2. Carbonización de la punta de la fibra láser de 600 micras secundaria a la ablación láser endovenosa con un láser de 1320 nm (Fotografía cortesía de Mark Forrestal, MD, FACPh).
ANESTESIA TUMESCENTE
La EVLA debe realizarse bajo anestesia local utilizando grandes volúmenes de una solución diluida de lidocaína y epinefrina (volumen medio de 200-400 mL de lidocaína al 0,1% con epinefrina al 1:1.000.000) que se tampona con bicarbonato sódico. Esta solución debe administrarse manualmente o con una bomba de infusión bajo guía ecográfica, de modo que la vena quede rodeada por el líquido anestésico a lo largo de todo el segmento a tratar (figura 3).
Las ventajas de la anestesia tumescente para la ablación endovenosa son:
– anestesia,
– separación de la vena a tratar de las estructuras circundantes,
– sumidero térmico, que reduce los picos de temperatura en los tejidos perivenosos,
– compresión de la vena, que maximiza el efecto del tratamiento en la pared venosa.
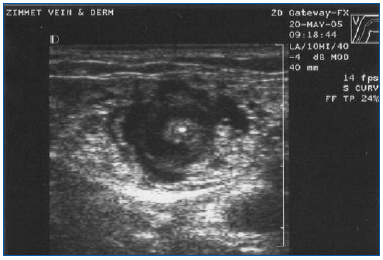
Figura 3. Imagen ecográfica transversal del líquido anestésico tumescente que rodea la vena safena mayor situada en el centro y la fibra/vaina láser.
Aunque la dosis máxima segura de lidocaína utilizando la técnica tumescente para procedimientos venosos no está bien estudiada, una dosis de 35 mg/kg es una estimación razonable.
Usando estos parámetros, la anestesia tumescente en el contexto de la liposucción ha demostrado ser extraordinariamente segura. Puede obtenerse más información en http://www.liposuction.com/pharmacology/drug_inter act.php.
CONTRAINDICACIONES DE LA EVLA
Las contraindicaciones de la técnica de EVLA se resumen en la Tabla I.

Tabla I. Contraindicaciones del láser endovenoso.
Secuelas adversas
Se han observado con frecuencia dolor y equimosis a corto plazo después de la EVLA. En una revisión retrospectiva se ha informado de que el pullback de fibra láser de pulso intermitente causa niveles significativamente mayores de dolor y hematomas postoperatorios, en comparación con un protocolo de pullback continuo.38 La adición de un vendaje de estiramiento corto durante 3 días después de la EVLA de modo intermitente redujo sustancialmente los hematomas y el dolor notificados por los pacientes. El empleo del modo continuo de pullback redujo aún más la gravedad del dolor y los hematomas hasta tal punto que los niveles fueron similares a los notificados por los pacientes tratados con ablación por radiofrecuencia (tablas II y III). Los informes preliminares sugieren que puede haber algunas diferencias en el curso postoperatorio dependiendo de la longitud de onda utilizada para realizar la EVLA.22,39 Sin embargo, esto se basa en datos escasos con un seguimiento a corto plazo.
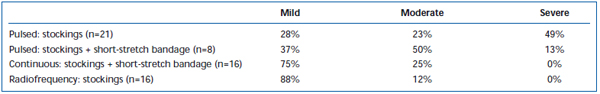
Tabla II. Hematomas postoperatorios valorados por los pacientes entre 3 y 7 días después de la ablación endovenosa con láser pulsado (EVLA) con medias de clase II, EVLA pulsado con medias más vendaje de corta duración, EVLA en modo continuo con medias y vendaje de corta duración, y ablación por radiofrecuencia con medias.
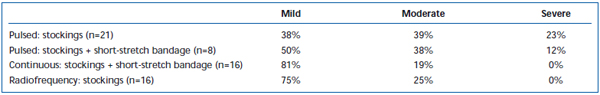
Tabla III. Dolor postoperatorio calificado por el paciente entre 3 y 7 días después de la ablación con láser endovenoso pulsado (EVLA) con medias de clase II, EVLA pulsado con medias más vendaje de estiramiento corto, EVLA de modo continuo con medias y vendaje de estiramiento corto, y ablación por radiofrecuencia con medias.
Termia colateral
La temperatura intravascular máxima media durante la EVLA (vena yugular de cabra, 12 vatios, pulsos de 1 segundo, intervalos de 1 segundo), medida a ras de la punta del láser, fue de 729°C de media, mientras que la de 4 mm distal a la punta fue de 93°C de media.40 Sin embargo, el riesgo de lesión térmica colateral depende del calentamiento del tejido perivenoso, no de la temperatura intravascular.
Se ha observado que el colágeno se contrae a unos 50°C, mientras que la necrosis se produce entre 70°C y 100°C.41 El alcance de la lesión térmica del tejido depende en gran medida de la cantidad y la duración del calor al que se expone el tejido. Henriques y Moritz investigaron la respuesta tiempo-temperatura de los tejidos expuestos hasta 70°C.42 Descubrieron que la piel podía soportar aumentos de temperatura durante tiempos de exposición muy cortos, y que la respuesta parece ser logarítmica a medida que los tiempos de exposición se acortan. Por ejemplo, un aumento de la temperatura corporal a 58°C producirá la destrucción de las células si la exposición es superior a 10 segundos. Sin embargo, los tejidos pueden soportar temperaturas de hasta 70°C si la duración de la exposición se mantiene durante menos de 1 segundo. Li et al. informaron de que el calentamiento de células endoteliales a 48°C durante 10 minutos no indujo la muerte celular.43 También descubrieron que los osteoblastos, tras una exposición de 10 minutos o menos a 45°C, sufrieron cambios transitorios y reversibles. En otro estudio se observó un daño tisular reversible en la extremidad posterior de los ratones tras la inmersión en un baño de agua a 44°C.44
En un estudio reciente se midió la temperatura máxima en la pared de la vena externa durante la EVLA en una vena de la oreja de cerdo viva y en las venas de la extremidad posterior expuestas.45 Los ajustes de la EVLA oscilaron entre 8 vatios (duración del pulso de 1-2 segundos), 10 vatios (duración del pulso de 1-1,5 segundos), 12 vatios (duración del pulso de 0,5-1,5 segundos) y 15 vatios (duración del pulso de 0,5-1,0 segundos), con y sin anestesia tumescente. Los resultados demuestran que las temperaturas máximas oscilaron entre 34,6 °C y 49,1 °C en función de los julios suministrados, obteniéndose temperaturas máximas más bajas cuando había líquido tumescente (Figura 4).
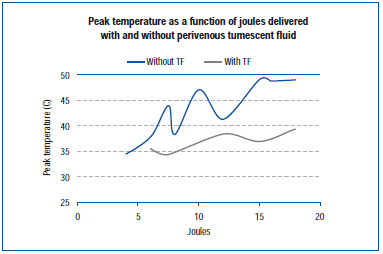
Figura 4. Adaptado de Zimmet SE, Min RJ. Temperature changes in perivenous tissue during endovenous laser treatment in a swine model. J Vasc Interv Radiol. 2003;14:911-915 (ref 45).
La temperatura máxima medida durante el EVLA (63 pacientes, 980 nm, 15 vatios, pulsos de 1,5 segundos) en la pared de la vena externa en humanos, 3 cm por debajo de la unión safenofemoral, fue de 40,9°C y 49,8°C con y sin líquido tumescente, respectivamente.46 En otro estudio en humanos durante la EVLA (12 pacientes, 810 nm, 12 W, pulsos de 1 segundo, intervalos de 1 segundo, técnica tumescente) se obtuvieron resultados similares, con temperaturas máximas de 43,3 °C, 42,0 °C y 36,0 °C a 3 mm, 5 mm y 10 mm de la VAG, respectivamente. 47
Parece haber un descenso muy rápido de la temperatura en distancias cortas durante la EVLA. Esto probablemente contrasta con la energía de radiofrecuencia, en la que el calentamiento por microondas se produce alrededor de la interfaz tejido-electrodo. Los datos de animales y humanos sugieren que es poco probable que las temperaturas máximas perivenosas generadas durante el láser endovenoso causen daños permanentes en el tejido perivenoso en la mayoría de las situaciones. La temperatura máxima generada se reduce con el uso de líquido tumescente perivenoso. Estos resultados parecen explicar la escasa incidencia notificada de lesiones nerviosas y quemaduras cutáneas tras la EVLA. Un estudio, en el que se utilizó un láser Nd: YAG de 1064 nm, informó de una incidencia muy elevada de parestesias en el 36,5% y de quemaduras en la piel en el 4,8%.48 Cabe señalar que la cantidad de energía suministrada fue aproximadamente tres veces superior a la que se utiliza habitualmente y que el tratamiento se realizó sin anestesia tumescente. A pesar de las bajas temperaturas perivenosas registradas con la EVLA, es importante tener en cuenta que se requiere una precaución especial al considerar la intervención endovenosa en ciertos casos, como las várices del nervio ciático.49,50
COMPLICACIONES MAYORES
Las complicaciones mayores tras la EVLA se han registrado en raras ocasiones. Las tasas de trombosis venosa profunda (TVP), agrupadas a partir de múltiples series, son muy inferiores al 1%.17,18,20,28 Un grupo informó de una incidencia de extensión del trombo a la vena femoral del 7,7%.51 Sin embargo, en ese estudio la EVLA se realizó bajo anestesia general o espinal. El hecho de que los pacientes no pudieran deambular inmediatamente después de la operación puede haber contribuido a la elevada incidencia de extensión del trombo. Existe un único informe de una fístula arteriovenosa que se desarrolló tras la EVLA de la vena safena corta (SSV).52 Un paciente desarrolló una tromboflebitis séptica tras la EVLA combinada con la ligadura abierta de las perforadoras y la flebectomía con arma blanca.53 Esto se resolvió con tratamiento antibiótico y desbridamiento.
ENFOQUES ALTERNATIVOS
La EVLA y la ablación por radiofrecuencia (ARF)54,55 parecen ser tratamientos eficaces para la incompetencia safena. Las ventajas de la EVLA sobre la ARF incluyen tiempos de procedimiento más cortos y un menor coste por tratamiento. Las tasas de oclusión notificadas de la EVLA suelen ser ligeramente superiores a las obtenidas con la ARF.56 Las desventajas de la EVLA pueden incluir más hematomas y molestias en el período postoperatorio temprano, aunque esto puede depender de la técnica. Ambas técnicas siguen perfeccionándose, lo que mejorará los resultados. Ambos procedimientos, cuando se realizan con anestesia tumescente, se asocian a bajas tasas de complicaciones.
Otro tratamiento emergente para el reflujo safeno es el uso de esclerosantes espumosos administrados bajo control ecográfico. Un gas, como el aire o el CO2, puede mezclarse con esclerosantes detergentes líquidos para crear espuma, que se calcula que es unas cuatro veces más potente que la forma líquida del mismo agente. Los primeros resultados sugieren que puede ser una modalidad valiosa, ya que es rápida y barata de realizar, con tasas de éxito a corto y medio plazo de entre el 75% y el 90%. Hay muchas variables en relación con la espuma (por ejemplo, el tipo y la cantidad de gas, la técnica utilizada para crear la espuma, la concentración y el tipo de esclerosante utilizado, el volumen inyectado, etc.). Puede haber un mayor riesgo de trombosis venosa profunda tras la escleroterapia con espuma en comparación con la escleroterapia estándar. Una técnica adecuada es importante para minimizar el riesgo de esta complicación. Otros efectos secundarios notificados tras la escleroterapia con espuma son los eventos visuales y neurológicos. Se ha publicado un informe sobre un accidente cerebrovascular después de la escleroterapia con espuma (20 ml de espuma de polidocanol) en un paciente con un foramen oval permeable de 1,8 cm.57 La experiencia y la investigación futuras sobre esta modalidad permitirán delimitar mejor sus riesgos y su eficacia a largo plazo.
CONCLUSIÓN
Los principios actualmente aceptados para el tratamiento de las varices sirven para maximizar los resultados desde el punto de vista hemodinámico y del paciente, al tiempo que minimizan el riesgo de recidiva. El tratamiento adecuado de las varices comienza con una evaluación precisa de la patología venosa subyacente y la identificación de las fuentes de hipertensión venosa. Los objetivos del tratamiento incluyen la eliminación de las conexiones incompetentes entre los sistemas profundo y superficial, así como la obliteración de las vías de incompetencia venosa y las varices incompetentes. Es evidente que la recurrencia se reduce si se ablaciona el segmento incompetente del tronco safeno.
La ablación con láser endovenoso es una alternativa menos invasiva a la extirpación venosa. Los resultados parecen ser iguales o mejores que los de la extirpación, con mejores puntuaciones de calidad de vida en el período postoperatorio. Se ha demostrado que la EVLA corrige o mejora significativamente la anomalía hemodinámica en pacientes con insuficiencia venosa crónica con reflujo venoso superficial. Los primeros informes sugieren que las técnicas de ablación endovenosa, en contraste con la extirpación quirúrgica, se asocian con una baja incidencia de neovascularización.
La aplicación de los principios de la anestesia tumescente a los tratamientos venosos, junto con el desarrollo de las técnicas de ablación endovenosa, ofrecen la posibilidad de tratar a la gran mayoría de los pacientes con insuficiencia venosa superficial en la consulta sin anestesia general ni incisiones quirúrgicas, al tiempo que se maximizan los resultados y se minimizan las recidivas.
Este artículo se presentó el 29 de julio de 2006.

2. Large J. Surgical treatment of saphenous varices, with preservation of the main great saphenous trunk. J Vasc Surg. 1985;2:886-891.
3. Holme JB, Holme K, Sorensen LS. The anatomic relationship between the long saphenous vein and the saphenous nerve. Relevancia para la cirugía radical de las varices. Acta Chir Scand. 1988;154:631-633.
4. Rutherford RB, Sawyer JD, Jones DN. The fate of residual saphenous vein after partial removal or ligation. J Vasc Surg. 1990;12:422-426.
5. Panetta TF, Marin ML, Veith FJ, et al. Unsuspected preexisting saphenous vein disease: an unrecognized cause of vein bypass failure. J Vasc Surg. 1992;15:102- 110.
6. McMullin GM, Coleridge-Smith PD, Scurr JH. Objective assessment of ligation without stripping the long saphenous vein. Br J Surg. 1991;78:1139-1142.
7. Sarin S, Scurr JH, Coleridge Smith PD. Assessment of stripping the long saphenous vein in the treatment of primary varicose veins. Br J Surg. 1992;79:889-893.
8. Munn SR, Morton JB, Macbeth WA, McLeish AR. ¿Extraer o no extraer la vena safena larga? A varicose vein trial. Br J Surg. 1981;68:426-481.
9. Jones L, Braithwaite BD, Selwyn D, Cooke S, Earnshaw JJ. La neovascularización es la causa principal de la recurrencia de las varices: resultados de un ensayo aleatorio de extirpación de la vena safena larga. Eur J Vasc Endovasc Surg. 1996;12:442-445.
10. Dwerryhouse S, Davies B, Harradine K, Earnshaw JJ. La extirpación de la vena safena larga reduce la tasa de reoperación por varices recurrentes: resultados de cinco años de un ensayo aleatorio. J Vasc Surg. 1999;29:589-592.
11. Winterborn RJ, Foy C, Earnshaw JJ. Causas de recurrencia de las varices: resultados tardíos de un ensayo controlado aleatorio de extirpación de la vena safena larga. J Vasc Surg. 2004;40:634-639.
12. Corbett CR, Runcie JJ, Lea TM, Jamieson CW. Reasons to strip the long saphenous vein. Phlebologie. 1988;41:766-769.
13. Neglen P. Treatment of varicosities of saphenous origin: comparison of ligation, selective excision, and sclerotherapy. En: Bergan JJ, Goldman MP eds. Varicose Veins and Telangiectasias: Diagnosis and Treatment. Louis, Mo, USA: Quality Medical Publishing; 1993:148-165.
14. Kostas T, Ioannou CV, Touloupakis E, et al. Recurrence varicose veins after surgery: a new appraisal of a common and complex problem in vascular surgery. Eur J Vasc Endovasc Surg. 2004;27:275-282.
15. Van Rij AM, Jones GT, Hill GB, Jiang P. Neovascularization and recurrent varicose veins: more histologic and ultrasound evidence. J Vasc Surg. 2004;40:296-302.
16. Nyamekye I, Shephard NA, Davies B, et al. Clinicopathological evidence that neovascularization is a cause of recurrent varicose veins. Eur J Vasc Endovasc Surg. 1998;15: 412-415.
17. Ravi R, Rodriguez-Lopez JA, Trayler EA, et al. Endovenous ablation of incompetent saphenous veins: a large single-center experience. J Endovasc Ther. 2006;13:244- 248.
18. Min RJ, Khilnani N, Zimmet SE. Endovenous laser treatment of saphenous vein reflux: long-term results. J Vasc Interv Radiol. 2003;14:991-996.
19. Bergan JJ, Rattner Z. Endovenous therapy-2005. Acta Chir Bel. 2005;105:12- 15.
20. Agus GB, Mancini S, Magi G. The first 1000 cases of Italian endovenous-laser Working Group (IEWG). Fundamentos y resultados a largo plazo en el período 1999-2003. Int Angiol. 2006;25:209-215.
21. Kalra M, Gloviczki P. Hace quince años se suponía que el láser abría arterias, ahora se supone que cierra venas: ¿cuál es la realidad detrás de la herramienta? Perspect Vasc Surg Endovasc Ther. 2006;18:3-8 (discusión 9- 10).
22. Kabnick LS. Outcome of different endovenous laser wavelengths for great saphenous vein ablation. J Vasc Surg. 2006;43: 88-93.
23. Goldman MP, Maritess M, Rao J. Intravascular 1320-nm laser closure of the great saphenous vein: a 6- to 12-month follow-up study. Dermatol Surg. 2004;30: 1380-1385.
24. Marston WA, Owens LV, Davies S, et al. La ablación endovenosa de la safena corrige la anomalía hemodinámica en pacientes con IVC de clase clínica 3-6 de la CEAP debido a reflujo superficial. Vasc Endovascular Surg. 2006;40:125-130.
25. De Medeiros CA, Luccas GC. Comparación del tratamiento endovenoso con un láser de 810 nm frente al stripping convencional de la vena safena mayor en pacientes con varices primarias. Dermatol Surg. 2005;31:1685-1694.
26. Mekako AI, Hatfield J, Bryce J, et al. A nonrandomised controlled trial of endovenous laser therapy and surgery in the treatment of varicose veins. Ann Vasc Surg. 2006;Jun 27:.
27. Vuylsteke M, Van den Bussche D, Audenaert EA, Lissens P. Endovenous laser obliteration for the treatment of primary varicose veins. Phlebology. 2006;21:80-87. 28. Perkowski P, Ravi R, Gowda RC, et al. Endovenous laser ablation of the saphenous vein for treatment of venous insufficiency and varicose veins: early results from a large single-center experience. J Endovasc Ther. 2004;11:132-138.
29. Sharif MA, Soong CV, Lau LL, et al. Endovenous laser treatment for long saphenous vein incompetence. Br J Surg. 2006;93:831-835.
30. Proebstle TM, Krummenauer F, Gul D, Knop J. Nonocclusion and early reopening of the great saphenous vein after endovenous laser treatment is fluence dependent. Dermatol Surg. 2004;30:174-178.
31. Timperman PE, Sichlau M, Ryu RK. Un mayor suministro de energía mejora el éxito del tratamiento con láser endovenoso de las venas safenas incompetentes. J Vasc Interv Radiol. 2004;15:1061-1063.
32. Proebstle TM, Sandhofer M, Kargl A, et al. Thermal damage of the inner vein wall during endovenous laser treatment: key role of energy absorption by intravascular blood. Dermatol Surg. 2002;28:596-600.
33. Schmedt CG, Sroka R, Steckmeier S, et al. Investigation on radiofrequency and laser (980 nm) effects after endoluminal treatment of saphenous vein insufficiency in an ex-vivo model. Eur J Vasc Endovasc Surg. 2006;Jun 14;.
34. Anderson RR. Láser endovenoso: mecanismo de acción. Paper presented at the Annual Meeting of the American Academy of Dermatology; March 3-7, 2006; San Francisco, California, USA.
35. Izzo F. Otras técnicas de ablación térmica: ablación por microondas y láser intersticial de tumores hepáticos. Annals of Surgical Oncology. 2003;10:491-497.
36. Mordon SR, Wassmer B y Zemmouri J. Mathematical modeling of endovenous laser treatment (ELT). BioMedical Engineering OnLine. 2006;5:26. Disponible en: http://www.biomedical-engineeringonline. com/content/5/1/26. Consultado el 19 de julio de 2006.
37. De-Fei Hong, Shu-You Peng, Song-Ying Li, Li-Min Tong. Estudio experimental de la termocoagulación inducida por diodelaser en el tejido hepático con punta de fibra de escáner. World J Gastroenterol. 2003;9:2350-2352.
38. Zimmet SE. Dolor, hematomas y eficacia a corto plazo tras el tratamiento con láser endovenoso de la vena safena mayor: el efecto de la técnica operatoria y los cuidados postoperatorios. Ponencia presentada en el 16º Congreso Anual del American College of Phlebology; 7-10 de noviembre de 2002; Fort Lauderdale, Florida, EE.UU.
39. Proebstle TM, Moehler T, Gul D, Herdemann S. Endovenous treatment of the great saphenous vein using a 1320 nm Nd:YAG laser causes less side effects than using a 940 nm diode laser. Dermatol Surg. 2005;31:1678-1683.
40. Weiss RA. Comparación de la radiofrecuencia endovenosa frente a la oclusión con láser de diodo de 810 nm de grandes venas en un modelo animal. Dermatol Surg. 2002;28:56-61.
41. Biesman BS, Khan J. Laser incisional surgery. Clinics in Plastic Surg. 2000;27:213- 220.
42. Moritz AR, Henriques Jr EC. Studies of thermal injury II: the relative importance of time and surface temperature in the causation of cutaneous bums. Am J Pathol. 1947;23:695-720.
43. Li S, Chien S, Branemark P. Heat shockinduced necrosis and apoptosis in osteoblasts. J Orthop Res. 1999;17:891-899.
44. Jansen W, Haveman J. Histopathological changes in the skin and subcutaneous tissues of mouse legs after treatment with hyperthermia. Path Res Pract. 1990;186: 247-253.
45. Zimmet SE, Min RJ. Temperature changes in perivenous tissue during endovenous laser treatment in a swine model. J Vasc Interv Radiol. 2003;14:911-915.
46. Lahl W. Thermometric investigations of perivenous temperature during endovenous laser therapy of varicose veins. Paper presented at the 15th World Congress of the Union Internationale de Phlébologie; October 2-7, 2005; Rio de Janeiro, Brazil.
47. Beale RJ, Mavor AID, Gough MJ. Disipación de calor durante el tratamiento con láser endovenoso de las venas varicosas: ¿existe riesgo de lesión nerviosa? Phlebology. 2006;21:32-35.
48. Chang CJ, Chua JJ. Endovenous laser photocoagulation (EVLP) for varicose veins. Lasers Surg Med. 2002;31:257-262.
49. Ricci S, Georgiev M, Jawien A, Zamboni P. Sciatic nerve varices. Eur J Vasc Endovasc Surg. 2005;29:83-87.
50 Ricci S. Ultrasound observation of the sciatic nerve and its branches at the popliteal fossa: always visible, never seen. Eur J Vasc Endovasc Surg. 2005;30:659-663. 51 Mozes G, Kalra M, Carmo M, Swenson L, Gloviczki P. Extension of saphenous thrombus into the femoral vein: a potential complication of new endovenous ablation techniques. J Vasc Surg. 2005;41:130-135.
52 Timperman, PE. Fístula arteriovenosa tras el tratamiento endovenoso con láser de la vena safena corta. J Vasc Interv Radiol. 2004;15:625-627.
53 Dunst KM, Huemer GM, Wayand W, Shamiyeh A. Diffuse phlegmonous phlebitis after endovenous laser treatment of the greater saphenous vein. J Vasc Surg. 2006;43:1056-1058.
54 Lurie F, Creton D, Eklof B, et al. Prospective randomized study of endovenous radiofrequency obliteration (closure procedure) versus ligation and stripping in a selected patient population (EVOLVeS Study). J Vasc Surg. 2003;38:207-214.
55 Merchant RF, DePalma RG, Kabnick LS. Obliteración endovascular del reflujo safeno: un estudio multicéntrico. J Vasc Surg. 2002;35:1190-1196.
56 Puggioni A, Kalra M, Carmo M, Mozes G, Gloviczki P. Endovenous laser therapy and radiofrequency ablation of the great saphenous vein: analysis of early efficacy and complications. J Vasc Surg. 2005;42; 488-493.
57 Forlee MV, Grouden M, Moore DJ, Shanik G. Stroke after varicose vein foam injection sclerotherapy. J Vasc Surg. 2006;43: 162-164.