Scarica questo numero Torna al sommario
Steven E. ZIMMET2,3
Austin, USA
ABSTRACT
L’ablazione laser endovenosa (EVLA) è un’alternativa meno invasiva allo stripping venoso. I risultati sembrano uguali o migliori di quelli dello stripping, con una migliore qualità della vita nel periodo post-operatorio. L’EVLA ha dimostrato di correggere o migliorare significativamente l’anomalia emodinamica nei pazienti con insufficienza venosa cronica (CVI) con reflusso venoso superficiale. I primi rapporti suggeriscono che le tecniche di ablazione endovenosa, in contrasto con lo stripping chirurgico, sono associate a una bassa incidenza di neovascolarizzazione.
Una varietà di lunghezze d’onda viene utilizzata per eseguire l’EVLA. Mentre il cromoforo iniziale è l’acqua o l’emoglobina, a seconda della lunghezza d’onda utilizzata, il carbonio sembra essere un cromoforo secondario ma chiave che è probabilmente indipendente dalla lunghezza d’onda.
L’applicazione dei principi dell’anestesia tumescente ai trattamenti venosi, insieme allo sviluppo delle tecniche di ablazione endovenosa, offrono la possibilità di trattare la grande maggioranza dei pazienti con vene varicose in ufficio senza anestesia generale o incisioni chirurgiche, massimizzando allo stesso tempo i risultati e minimizzando le recidive.
INTRODUZIONE
Il reflusso della safena è l’anomalia primaria sottostante nella maggior parte dei casi di insufficienza venosa superficiale. Pertanto, gli approcci al trattamento della giunzione safenofemorale e dell’incompetenza safeno-tronchiale hanno dominato il pensiero dei flebologi. Trendelenburg ha descritto la legatura della giunzione safeno-femorale da sola, senza stripping della safena incompetente, negli anni 1890. I vantaggi della sola legatura rispetto alla legatura e allo stripping, che vengono decantati ancora oggi,1 comprendono la conservazione del tronco safenico per un possibile uso futuro come innesto di bypass2 e la prevenzione della lesione del nervo safenico.3 La legatura alta da sola è meno invasiva, più rapida e più semplice da eseguire e associata a un recupero più facile rispetto allo stripping della vena. Anche se è vero che “risparmia” abitualmente il tronco safenico,4 l’uso di una safena malata come condotto è stato associato ad un aumento del rischio di fallimento dell’innesto.5 Soprattutto, non vi è più alcun dubbio che la sola legatura alta di solito provoca un reflusso persistente nel tronco safenico.6,7 Le recidive varicose sono notevolmente ridotte7-9 e il tasso di reintervento è inferiore del 60-70% se la safena viene strippata rispetto alla sola legatura.10,11 Inoltre, dopo la sola legatura, la recidiva o la comunicazione residua con la giunzione inguinale è stata riscontrata nell’80% dei pazienti, mentre il 34% presentava anche un’incompetenza dei perforatori della coscia attraverso la grande safena non spellata (GSV).12 Come ha concluso Neglen, lo stripping della GSV della coscia è essenziale per ridurre al minimo le recidive causate dal nuovo sviluppo della comunicazione incompetente con la confluenza safeno-femorale e dall’incompetenza dei perforatori della coscia.13 In poche parole, le carenze della sola legatura superano i suoi vantaggi.
È importante notare che la recidiva è comune anche dopo la legatura e lo stripping della safena. Mentre una chirurgia inadeguata della giunzione safeno-femorale e la progressione della malattia sono meccanismi che spiegano alcuni casi di recidiva, un altro importante meccanismo è la neovascolarizzazione intorno alla giunzione dopo la chirurgia venosa.11,14 Infatti, la neovascolarizzazione è stata riportata come la causa principale della recidiva,9 con canali neovascolari di dimensioni, numero e tortuosità variabili che rappresentano il reflusso verso varicosità ricorrenti nella maggior parte dei casi.15 Sebbene alcuni abbiano espresso dubbi sulla veridicità della vera neovascolarizzazione, esiste una chiara evidenza istologica che la neovascolarizzazione sia una causa di varici ricorrenti.16 I primi rapporti suggeriscono, al contrario, che le tecniche di ablazione endovenosa sono associate a un’incidenza molto bassa di neovascolarizzazione. 17 È possibile che lo sviluppo della neovascolarizzazione sia in gran parte prevenuto evitando la dissezione inguinale e preservando il drenaggio venoso nei normali tributari giunzionali.18,19
L’EVLA, come l’ablazione a radiofrequenza e la scleroterapia con schiuma, è un’alternativa meno invasiva allo stripping venoso. L’EVLA è indicata in un paziente ambulatoriale con reflusso della safena grande, piccola o accessoria con varici superficiali e/o sintomi o complicazioni legati all’insufficienza venosa superficiale. L’EVLA viene eseguita di routine utilizzando un’anestesia locale diluita, con o senza ansiolitici orali supplementari, in un ambiente d’ufficio. Generalmente l’esecuzione richiede 30-60 minuti, ma i tempi della procedura dipendono dalla lunghezza del segmento trattato, dall’esperienza dell’operatore e dall’esecuzione o meno di procedure accessorie, come la flebectomia ambulatoriale. Indipendentemente dal modo in cui viene trattata l’incompetenza safena sottostante, i trattamenti accessori sono in genere necessari per trattare le varici residue (Figura 1).
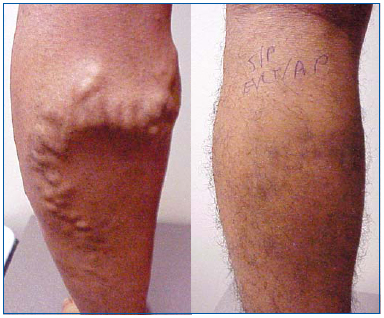
Figura 1. Maschio di 26 anni prima e 1 mese dopo l’ablazione laser endovenosa della grande safena e flebectomia ambulatoriale degli affluenti varicosi.
EFFICACIA
Gli studi a breve e medio termine di EVLA, indipendentemente dalla lunghezza d’onda utilizzata, sembrano notevolmente coerenti, riportando in genere l’ablazione delle vene safene refluenti nel 90% o più dei casi.18,20-23 L’EVLA della safena ha dimostrato di correggere o migliorare significativamente l’anomalia emodinamica e i sintomi clinici dell’insufficienza venosa cronica (CVI) in pazienti di classe clinica, eziologica, anatomica e fisiopatologica (CEAP) 3-6 con reflusso venoso superficiale.24,25 I risultati sembrano uguali o migliori di quelli dello stripping, con punteggi di qualità della vita migliori nel periodo post-operatorio rispetto allo stripping.20,25-27 Sono stati riportati alti tassi di soddisfazione dei pazienti.18,28,29 Il costo totale (costo della procedura più costo sociale) delle procedure endovenose è probabilmente uguale o inferiore a quello della chirurgia.27
I primi dati sul trattamento del GSV con dispositivi a 810 nm e 940 nm suggeriscono che il fallimento del trattamento è raro nei pazienti trattati con > 70 J/cm.30,31 Una velocità di prelievo di 2 mm/sec a 14 watt fornisce 70 J/cm.
MECCANISMO D’AZIONE
Le seguenti lunghezze d’onda sono attualmente in uso per l’EVLA: 810, 940, 980, 1064, 1319, 1320, e 2068 nm. È stato postulato che la lesione della parete della vena è mediata sia per effetto diretto che indirettamente attraverso il vapore indotto dal laser generato dal riscaldamento di piccole quantità di sangue all’interno della vena.32 Alcuni hanno suggerito che la scelta della lunghezza d’onda influisce notevolmente sui risultati.23
Il cromoforo principale dei laser a 1320 e 2078 nm, almeno inizialmente, è l’acqua, mentre le altre lunghezze d’onda utilizzate per l’EVLA mirano principalmente all’emoglobina. Ovviamente è imperativo danneggiare termicamente la parete della vena in modo adeguato per ottenere un’ablazione efficace. Un certo riscaldamento può avvenire per assorbimento diretto dell’energia fotonica (radiazione) da parte della parete della vena così come per convezione dalle bolle di vapore e per conduzione dal sangue riscaldato. Tuttavia, è improbabile che questi ultimi meccanismi rappresentino la maggior parte dell’impatto sulla vena. La temperatura massima del sangue è di 100°C. È stato riscontrato che il trattamento laser produce la carbonizzazione della parete della vena.33 La carbonizzazione della punta del laser, che si verifica a circa 300°C, viene notata in seguito all’EVLA e sembra verificarsi indipendentemente dalla lunghezza d’onda utilizzata.34 La carbonizzazione della punta della fibra laser crea una fonte di calore puntiforme e riduce essenzialmente a zero la penetrazione della luce nel tessuto.34,35 Mordon et al hanno dichiarato “Il vapore prodotto dall’assorbimento dell’energia laser da parte del sangue è una piccola frazione dell’energia necessaria per danneggiare la parete della vena e non può essere il meccanismo primario di lesione della vena con il laser endovenoso. La carbonizzazione e il tratto all’interno delle pareti della vena visti dall’istologia in seguito al laser endovenoso possono essere solo il risultato del contatto diretto tra la punta della fibra laser e la parete della vena. “36 Il dottor Rox Anderson, direttore del Wellman Center for Photomedicine al Massachusetts General Hospital, ha riferito che il carbonio sembra essere un cromoforo secondario ma fondamentale che è probabilmente indipendente dalla lunghezza d’onda (Figura 2).34 Si noti che la punta e la forma della fibra possono influire sullo sviluppo della carbonizzazione.37

Figura 2. Carbonizzazione della punta della fibra laser da 600 micron secondaria all’ablazione laser endovenosa con un laser da 1320 nm (Foto per gentile concessione di Mark Forrestal, MD, FACPh).
ANESTESIA TUMENTALE
EVLA deve essere eseguita in anestesia locale utilizzando grandi volumi di una soluzione diluita di lidocaina ed epinefrina (volume medio di 200-400 mL di lidocaina 0,1% con 1:1.000.000 di epinefrina) che è tamponata con bicarbonato di sodio. Questa soluzione dovrebbe essere erogata manualmente o con una pompa di infusione sotto guida ecografica in modo che la vena sia circondata dal liquido anestetico per tutta la lunghezza del segmento da trattare (Figura 3).
I vantaggi dell’anestesia tumescente per l’ablazione endovenosa includono:
– anestesia,
– separazione della vena da trattare dalle strutture circostanti,
– lavandino termico, che riduce le temperature di picco nei tessuti perivenosi,
– compressione della vena, che massimizza l’effetto del trattamento sulla parete della vena.
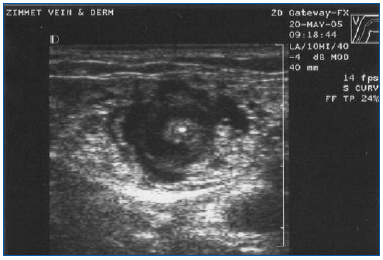
Figura 3. Immagine ecografica trasversale del fluido anestetico tumescente che circonda la grande safena in posizione centrale e la fibra/guaina laser.
Anche se il massimo dosaggio sicuro di lidocaina utilizzando la tecnica tumescente per procedure venose non è ben studiato, un dosaggio di 35 mg/kg è una stima ragionevole.
Utilizzando questi parametri, l’anestesia tumescente nel contesto della liposuzione ha dimostrato di essere straordinariamente sicura. Maggiori informazioni sono disponibili su http://www.liposuction.com/pharmacology/drug_inter act.php.
CONTRAINDICAZIONI ALL’EVLA
Le controindicazioni alla tecnica EVLA sono riassunte nella tabella I.

Tabella I. Controindicazioni al laser endovenoso.
Sequelae avverse
Dolore ed ecchimosi a breve termine sono stati comunemente osservati dopo EVLA. È stato riportato, in una revisione retrospettiva, che il pullback a fibre laser a impulsi intermittenti provoca livelli significativamente maggiori di dolore ed ecchimosi post-operatorie, rispetto a un protocollo di pullback continuo.38 L’aggiunta di un bendaggio di breve durata per 3 giorni dopo l’EVLA in modalità intermittente ha sostanzialmente ridotto le ecchimosi e il dolore riferiti dai pazienti. L’impiego del pullback in modalità continua ha ridotto ulteriormente la gravità del dolore e degli ematomi in misura tale che i livelli erano simili a quelli riportati dai pazienti trattati con ablazione a radiofrequenza (Tabelle II e III). I rapporti preliminari suggeriscono che ci possono essere alcune differenze nel decorso postoperatorio a seconda della lunghezza d’onda utilizzata per eseguire l’EVLA.22,39 Tuttavia, questo si basa su dati scarsi con follow-up a breve termine.
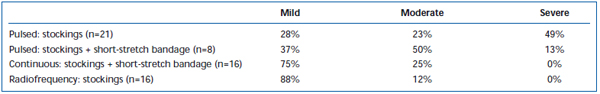
Tabella II. Lividi post-operatori valutati dai pazienti 3-7 giorni dopo l’ablazione laser endovenosa pulsata (EVLA) con calze di classe II, EVLA pulsata con calze più bendaggio a breve estensione, EVLA in modalità continua con calze e bendaggio a breve estensione, e ablazione a radiofrequenza con calze.
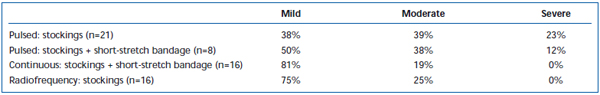
Tabella III. Dolore post-operatorio valutato dal paziente 3-7 giorni dopo l’ablazione laser endovenosa pulsata (EVLA) con calze di classe II, EVLA pulsata con calze più bendaggio a breve estensione, EVLA in modalità continua con calze e bendaggio a breve estensione, e ablazione a radiofrequenza con calze.
Giudizio termico pervio
Le temperature medie di picco intravascolare durante l’EVLA (vena giugulare di capra, 12 watt, impulsi di 1 secondo, intervalli di 1 secondo), misurate a filo della punta del laser, erano in media 729°C, mentre quelle a 4 mm dalla punta erano in media 93°C.40 Tuttavia, il rischio di lesioni termiche collaterali dipende dal riscaldamento del tessuto perivenoso, non dalla temperatura intravascolare.
Si è notato che il collagene si contrae a circa 50°C, mentre la necrosi si verifica tra i 70°C e i 100°C.41 L’entità delle lesioni termiche ai tessuti dipende fortemente dalla quantità e dalla durata del calore cui il tessuto è esposto. Henriques e Moritz hanno studiato la risposta tempo-temperatura per i tessuti esposti fino a 70°C.42 Hanno scoperto che la pelle può sopportare aumenti di temperatura per tempi di esposizione molto brevi e che la risposta sembra essere logaritmica man mano che i tempi di esposizione diventano più brevi. Per esempio, un aumento della temperatura corporea a 58°C produrrà la distruzione delle cellule se l’esposizione è più lunga di 10 secondi. I tessuti, tuttavia, possono sopportare temperature fino a 70°C se la durata dell’esposizione è mantenuta per meno di 1 secondo. Li et al hanno riportato che il riscaldamento delle cellule endoteliali a 48°C per 10 minuti non induce la morte cellulare.43 Hanno anche scoperto che gli osteoblasti, dopo l’esposizione per 10 minuti o meno a 45°C, hanno subito cambiamenti transitori e reversibili. Un altro studio ha trovato danni reversibili ai tessuti dell’arto posteriore dei topi dopo l’immersione in un bagno d’acqua a 44°C.44
Uno studio recente ha misurato la temperatura di picco sulla parete esterna della vena durante l’EVLA in una vena dell’orecchio di maiale vivo e nelle vene dell’arto posteriore esposte.45 Le impostazioni EVLA variavano da 8 watt (durata dell’impulso 1-2 secondi), 10 watt (durata dell’impulso 1-1,5 secondi), 12 watt (durata dell’impulso 0,5-1,5 secondi) a 15 watt (durata dell’impulso 0,5-1,0 secondi), con e senza anestesia tumescente. I risultati dimostrano che le temperature di picco variavano da 34,6°C a 49,1°C in funzione dei joule erogati, con temperature di picco inferiori ottenute in presenza di fluido tumescente (Figura 4).
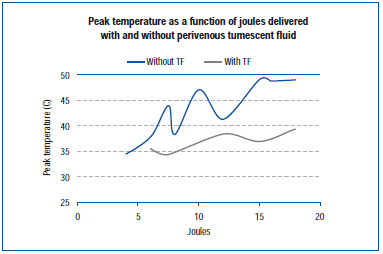
Figura 4. Adattato da Zimmet SE, Min RJ. Variazioni di temperatura nel tessuto perivenoso durante il trattamento laser endovenoso in un modello suino. J Vasc Interv Radiol. 2003;14:911-915 (rif. 45).
La temperatura di picco misurata durante l’EVLA (63 pazienti, 980 nm, 15 watt, impulsi di 1,5 secondi) sulla parete esterna della vena negli esseri umani, 3 cm sotto la giunzione safeno-femorale, era di 40,9°C e 49,8°C con e senza liquido tumescente, rispettivamente.46 Risultati simili sono stati riportati da un altro studio sull’uomo durante l’EVLA (12 pazienti, 810 nm, 12 W, impulsi di 1 secondo, intervalli di 1 secondo, tecnica tumescente), con temperature di picco di 43,3°C, 42,0°C e 36,0°C a 3 mm, 5 mm e 10 mm dalla GSV, rispettivamente. 47
Sembra esserci una caduta molto rapida della temperatura su brevi distanze durante l’EVLA. Questo è probabilmente in contrasto con l’energia a radiofrequenza dove il riscaldamento a microonde avviene intorno all’interfaccia tessuto-elettrodo. I dati sugli animali e sull’uomo suggeriscono che è improbabile che le temperature di picco perivenose generate durante il laser endovenoso causino danni permanenti al tessuto perivenoso nella maggior parte delle situazioni. La temperatura di picco generata si riduce con l’uso del fluido tumescente perivenoso. Questi risultati sembrano spiegare l’incidenza molto bassa riportata di lesioni nervose e ustioni cutanee in seguito all’EVLA. Uno studio, che utilizzava un laser Nd: YAG da 1064 nm, ha riportato un’incidenza molto elevata di parestesia nel 36,5% e di ustioni cutanee nel 4,8%.48 Va notato che la quantità di energia erogata era circa tre volte superiore a quella tipicamente utilizzata e che il trattamento è stato effettuato senza anestesia tumescente. Nonostante le basse temperature perivenose riportate con l’EVLA, è importante notare che è necessaria una particolare cautela quando si considera l’intervento endovenoso in alcuni casi come le varici del nervo sciatico.49,50
COMPLICANZE MAGGIORI
Le complicazioni maggiori dopo l’EVLA sono state riportate raramente. I tassi di trombosi venosa profonda (TVP), raggruppati da più serie, sono molto inferiori all’1%.17,18,20,28 Un gruppo ha riportato un’incidenza di estensione del trombo nella vena femorale del 7,7%.51 Tuttavia, in quello studio l’EVLA è stata eseguita in anestesia generale o spinale. Il fatto che i pazienti non fossero in grado di deambulare immediatamente dopo l’intervento può aver contribuito all’alta incidenza di estensione del trombo. Esiste una singola segnalazione di una fistola artero-venosa sviluppatasi in seguito all’EVLA della vena safena corta (SSV).52 Un paziente ha sviluppato una tromboflebite settica in seguito all’EVLA combinata con la legatura aperta dei perforatori e la flebectomia a taglio.53 Questo si è risolto con il trattamento antibiotico e lo sbrigliamento.
APPROCCI ALTERNATIVI
EVLA e ablazione a radiofrequenza (RFA)54,55 sembrano essere entrambi trattamenti efficaci per l’incompetenza safena. I vantaggi dell’EVLA rispetto alla RFA includono tempi di procedura più brevi e costi inferiori per trattamento. I tassi di occlusione riportati per l’EVLA sono in genere leggermente superiori a quelli ottenuti con la RFA.56 Gli svantaggi dell’EVLA possono includere più lividi e disagio nel primo periodo postoperatorio, sebbene ciò possa dipendere dalla tecnica. Entrambe le tecniche continuano a essere perfezionate, il che migliorerà i risultati. Entrambe le procedure, se eseguite con anestesia tumescente, sono associate a bassi tassi di complicazione.
Un altro trattamento emergente per il reflusso safenico è l’uso di sclerosanti schiumosi consegnati sotto controllo ecografico. Un gas, come l’aria o la CO2, può essere mescolato con sclerosanti detergenti liquidi per creare una schiuma, stimata essere circa quattro volte più potente della forma liquida dello stesso agente. I primi risultati suggeriscono che questa può essere una modalità valida, in quanto è veloce e poco costosa da eseguire con tassi di successo a breve e medio termine di circa il 75% al 90%. Ci sono molte variabili riguardo alla schiuma (per esempio, tipo e quantità di gas, tecnica usata per creare la schiuma, concentrazione e tipo di sclerosante usato, volume iniettato, ecc.) Ci può essere un rischio maggiore di trombosi venosa profonda dopo la scleroterapia con schiuma rispetto alla scleroterapia standard. Una tecnica adeguata è importante per ridurre al minimo il rischio di questa complicazione. Altri effetti collaterali riportati in seguito alla scleroterapia con schiuma includono eventi visivi e neurologici. Esiste un rapporto pubblicato di ictus in seguito a scleroterapia con schiuma (20 mL di schiuma di polidocanolo) in un paziente con un forame ovale pervio di 1,8 cm.57 Ulteriori esperienze e ricerche su questa modalità ne delineeranno meglio i rischi e l’efficacia a lungo termine.
CONCLUSIONE
I principi di trattamento delle vene varicose attualmente accettati servono a massimizzare i risultati dal punto di vista emodinamico e del paziente, riducendo al minimo il rischio di recidiva. Il trattamento appropriato delle vene varicose inizia con una valutazione accurata della patologia venosa sottostante e l’identificazione delle fonti di ipertensione venosa. Gli obiettivi del trattamento includono l’eliminazione delle connessioni incompetenti tra il sistema profondo e quello superficiale, nonché l’obliterazione delle vie di incompetenza venosa e delle vene varicose incompetenti. È evidente che la recidiva è ridotta se il segmento incompetente del tronco safenico viene ablato.
L’ablazione laser endovenosa è un’alternativa meno invasiva allo stripping delle vene. I risultati sembrano uguali o migliori di quelli dello stripping, con migliori punteggi di qualità della vita nel periodo post-operatorio. L’EVLA ha dimostrato di correggere o migliorare significativamente l’anomalia emodinamica nei pazienti con insufficienza venosa cronica con reflusso venoso superficiale. I primi rapporti suggeriscono che le tecniche di ablazione endovenosa, a differenza dello stripping chirurgico, sono associate a una bassa incidenza di neovascolarizzazione.
L’applicazione dei principi dell’anestesia tumescente ai trattamenti venosi, insieme allo sviluppo delle tecniche di ablazione endovenosa, offrono la possibilità di trattare la grande maggioranza dei pazienti con insufficienza venosa superficiale in ufficio senza anestesia generale o incisioni chirurgiche, massimizzando allo stesso tempo i risultati e minimizzando le recidive.
Questo articolo è stato presentato il 29 luglio 2006.

2. Large J. Trattamento chirurgico delle varici safene, con conservazione del tronco safeno principale. J Vasc Surg. 1985;2:886-891.
3. Holme JB, Holme K, Sorensen LS. Il rapporto anatomico tra la vena safena lunga e il nervo safeno. Rilevanza per la chirurgia radicale della vena varicosa. Acta Chir Scand. 1988;154:631-633.
4. Rutherford RB, Sawyer JD, Jones DN. Il destino della vena safena residua dopo la rimozione parziale o la legatura. J Vasc Surg. 1990;12:422-426.
5. Panetta TF, Marin ML, Veith FJ, et al. Malattia della safena preesistente non sospettata: una causa non riconosciuta di fallimento del bypass venoso. J Vasc Surg. 1992;15:102- 110.
6. McMullin GM, Coleridge-Smith PD, Scurr JH. Valutazione oggettiva della legatura senza stripping della vena safena lunga. Br J Surg. 1991;78:1139-1142.
7. Sarin S, Scurr JH, Coleridge Smith PD. Valutazione dello stripping della vena safena lunga nel trattamento delle vene varicose primarie. Br J Surg. 1992;79:889-893.
8. Munn SR, Morton JB, Macbeth WA, McLeish AR. Spogliare o non spogliare la vena safena lunga? Una prova della vena varicosa. Br J Surg. 1981;68:426-481.
9. Jones L, Braithwaite BD, Selwyn D, Cooke S, Earnshaw JJ. La neovascolarizzazione è la causa principale della recidiva della vena varicosa: risultati di uno studio randomizzato di stripping della vena safena lunga. Eur J Vasc Endovasc Surg. 1996;12:442-445.
10. Dwerryhouse S, Davies B, Harradine K, Earnshaw JJ. Lo stripping della vena safena lunga riduce il tasso di reintervento per le vene varicose ricorrenti: risultati a cinque anni di uno studio randomizzato. J Vasc Surg. 1999;29:589-592.
11. Winterborn RJ, Foy C, Earnshaw JJ. Cause di recidiva della vena varicosa: risultati tardivi di uno studio controllato randomizzato di stripping della vena safena lunga. J Vasc Surg. 2004;40:634-639.
12. Corbett CR, Runcie JJ, Lea TM, Jamieson CW. Motivi per spogliare la vena safena lunga. Phlebologie. 1988;41:766-769.
13. Neglen P. Trattamento delle varicosità di origine safena: confronto tra legatura, escissione selettiva e scleroterapia. In: Bergan JJ, Goldman MP eds. Vene varicose e teleangectasie: Diagnosi e trattamento. St. Louis, Mo, USA: Quality Medical Publishing; 1993:148-165.
14. Kostas T, Ioannou CV, Touloupakis E, et al. Varici ricorrenti dopo la chirurgia: una nuova valutazione di un problema comune e complesso nella chirurgia vascolare. Eur J Vasc Endovasc Surg. 2004;27:275-282.
15. Van Rij AM, Jones GT, Hill GB, Jiang P. Neovascolarizzazione e vene varicose ricorrenti: ulteriori prove istologiche ed ecografiche. J Vasc Surg. 2004;40:296-302.
16. Nyamekye I, Shephard NA, Davies B, et al. Prove clinicopatologiche che la neovascolarizzazione è una causa di vene varicose ricorrenti. Eur J Vasc Endovasc Surg. 1998;15: 412-415.
17. Ravi R, Rodriguez-Lopez JA, Trayler EA, et al. Ablazione endovenosa delle vene safene incompetenti: una grande esperienza in un solo centro. J Endovasc Ther. 2006;13:244- 248.
18. Min RJ, Khilnani N, Zimmet SE. Trattamento laser endovenoso del reflusso della safena: risultati a lungo termine. J Vasc Interv Radiol. 2003;14:991-996.
19. Bergan JJ, Rattner Z. Terapia endovenosa-2005. Acta Chir Bel. 2005;105:12- 15.
20. Agus GB, Mancini S, Magi G. I primi 1000 casi dell’Italian endovenous-laser Working Group (IEWG). Rationale e risultati a lungo termine nel periodo 1999-2003. Int Angiol. 2006;25:209-215.
21. Kalra M, Gloviczki P. Quindici anni fa il laser doveva aprire le arterie, ora deve chiudere le vene: qual è la realtà dietro lo strumento? Perspect Vasc Surg Endovasc Ther. 2006;18:3-8 (discussione 9- 10).
22. Kabnick LS. Risultati di diverse lunghezze d’onda del laser endovenoso per l’ablazione della grande safena. J Vasc Surg. 2006;43: 88-93.
23. Goldman MP, Maritess M, Rao J. Chiusura laser intravascolare 1320-nm della grande safena: uno studio di follow-up da 6 a 12 mesi. Dermatol Surg. 2004;30: 1380-1385.
24. Marston WA, Owens LV, Davies S, et al. L’ablazione safena endovenosa corregge l’anormalità emodinamica in pazienti con CEAP classe clinica 3-6 CVI dovuta al reflusso superficiale. Vasc Endovascular Surg. 2006;40:125-130.
25. De Medeiros CA, Luccas GC. Confronto del trattamento endovenoso con un laser 810 nm rispetto allo stripping convenzionale della grande safena in pazienti con vene varicose primarie. Dermatol Surg. 2005;31:1685-1694.
26. Mekako AI, Hatfield J, Bryce J, et al. Uno studio controllato non randomizzato di terapia laser endovenosa e chirurgia nel trattamento delle vene varicose. Ann Vasc Surg. 2006;Jun 27:.
27. Vuylsteke M, Van den Bussche D, Audenaert EA, Lissens P. Obliterazione laser endovenosa per il trattamento delle vene varicose primarie. Flebologia. 2006;21:80-87. 28. Perkowski P, Ravi R, Gowda RC, et al. Ablazione laser endovenosa della safena per il trattamento dell’insufficienza venosa e delle vene varicose: primi risultati di una grande esperienza in un unico centro. J Endovasc Ther. 2004;11:132-138.
29. Sharif MA, Soong CV, Lau LL, et al. Trattamento laser endovenoso per incompetenza della vena safena lunga. Br J Surg. 2006;93:831-835.
30. Proebstle TM, Krummenauer F, Gul D, Knop J. Nonocclusione e riapertura precoce della grande safena dopo il trattamento laser endovenoso dipende dalla fluenza. Dermatol Surg. 2004;30:174-178.
31. Timperman PE, Sichlau M, Ryu RK. Una maggiore erogazione di energia migliora il successo del trattamento laser endovenoso delle vene safene incompetenti. J Vasc Interv Radiol. 2004;15:1061-1063.
32. Proebstle TM, Sandhofer M, Kargl A, et al. Danno termico della parete interna della vena durante il trattamento laser endovenoso: ruolo chiave dell’assorbimento di energia dal sangue intravascolare. Dermatol Surg. 2002;28:596-600.
33. Schmedt CG, Sroka R, Steckmeier S, et al. Indagine sugli effetti della radiofrequenza e del laser (980 nm) dopo il trattamento endoluminale dell’insufficienza della safena in un modello ex-vivo. Eur J Vasc Endovasc Surg. 2006;Jun 14;.
34. Anderson RR. Laser endovenoso: meccanismo d’azione. Paper presented at the Annual Meeting of the American Academy of Dermatology; March 3-7, 2006; San Francisco, California, USA.
35. Izzo F. Altre tecniche di ablazione termica: ablazione a microonde e laser interstiziale dei tumori del fegato. Annali di oncologia chirurgica. 2003;10:491-497.
36. Mordon SR, Wassmer B e Zemmouri J. Modellazione matematica del trattamento laser endovenoso (ELT). BioMedical Engineering OnLine. 2006;5:26. Disponibile a: http://www.biomedical-engineeringonline. com/content/5/1/26. Accessed July 19, 2006.
37. De-Fei Hong, Shu-You Peng, Song-Ying Li, Li-Min Tong. Studio sperimentale della termocoagulazione indotta da diodelaser sul tessuto epatico con la punta della fibra dello scanner. World J Gastroenterol. 2003;9:2350-2352.
38. Zimmet SE. Dolore, lividi ed efficacia a breve termine dopo il trattamento laser endovenoso della vena safena maggiore: l’effetto della tecnica operativa e delle cure postoperatorie. Documento presentato al 16° Congresso annuale dell’American College of Phlebology; 7-10 novembre 2002; Fort Lauderdale, Florida, USA.
39. Proebstle TM, Moehler T, Gul D, Herdemann S. Il trattamento endovenoso della grande safena con un laser Nd:YAG da 1320 nm causa meno effetti collaterali rispetto all’uso di un laser a diodi da 940 nm. Dermatol Surg. 2005;31:1678-1683.
40. Weiss RA. Confronto tra radiofrequenza endovenosa e occlusione laser a diodo da 810 nm di grandi vene in un modello animale. Dermatol Surg. 2002;28:56-61.
41. Biesman BS, Khan J. Chirurgia laser incisionale. Clinics in Plastic Surg. 2000;27:213- 220.
42. Moritz AR, Henriques Jr EC. Studi di lesioni termiche II: l’importanza relativa del tempo e della temperatura superficiale nella causalità dei bum cutanei. Am J Pathol. 1947;23:695-720.
43. Li S, Chien S, Branemark P. Necrosi e apoptosi indotta da shock termico negli osteoblasti. J Orthop Res. 1999;17:891-899.
44. Jansen W, Haveman J. Cambiamenti istopatologici nella pelle e nei tessuti sottocutanei delle gambe del topo dopo il trattamento con ipertermia. Path Res Pract. 1990;186: 247-253.
45. Zimmet SE, Min RJ. Variazioni di temperatura nel tessuto perivenoso durante il trattamento laser endovenoso in un modello suino. J Vasc Interv Radiol. 2003;14:911-915.
46. Lahl W. Indagini termometriche della temperatura perivenosa durante la terapia laser endovenosa delle vene varicose. Paper presentato al 15 ° Congresso Mondiale della Union Internationale de Phlébologie; ottobre 2-7, 2005; Rio de Janeiro, Brasile.
47. Beale RJ, Mavor AID, Gough MJ. Dissipazione del calore durante il trattamento laser endovenoso di vene varicose – c’è un rischio di lesioni nervose? Flebologia. 2006;21:32-35.
48. Chang CJ, Chua JJ. Fotocoagulazione laser endovenosa (EVLP) per le vene varicose. Lasers Surg Med. 2002;31:257-262.
49. Ricci S, Georgiev M, Jawien A, Zamboni P. Varici del nervo sciatico. Eur J Vasc Endovasc Surg. 2005;29:83-87.
50 Ricci S. Osservazione ecografica del nervo sciatico e dei suoi rami alla fossa poplitea: sempre visibile, mai visto. Eur J Vasc Endovasc Surg. 2005;30:659-663. 51 Mozes G, Kalra M, Carmo M, Swenson L, Gloviczki P. Estensione del trombo safenico nella vena femorale: una potenziale complicazione delle nuove tecniche di ablazione endovenosa. J Vasc Surg. 2005;41:130-135.
52 Timperman, PE. Fistola artero-venosa dopo trattamento laser endovenoso della vena safena corta. J Vasc Interv Radiol. 2004;15:625-627.
53 Dunst KM, Huemer GM, Wayand W, Shamiyeh A. Flebite flemmatica diffusa dopo trattamento laser endovenoso della vena safena maggiore. J Vasc Surg. 2006;43:1056-1058.
54 Lurie F, Creton D, Eklof B, et al. Studio prospettico randomizzato di obliterazione endovenosa con radiofrequenza (procedura di chiusura) rispetto a legatura e stripping in una popolazione di pazienti selezionati (EVOLVeS Study). J Vasc Surg. 2003;38:207-214.
55 Merchant RF, DePalma RG, Kabnick LS. Obliterazione endovascolare del reflusso safenico: uno studio multicentrico. J Vasc Surg. 2002;35:1190-1196.
56 Puggioni A, Kalra M, Carmo M, Mozes G, Gloviczki P. Terapia laser endovenosa e ablazione a radiofrequenza della grande safena: analisi dell’efficacia iniziale e delle complicazioni. J Vasc Surg. 2005;42; 488-493.
57 Forlee MV, Grouden M, Moore DJ, Shanik G. Stroke dopo scleroterapia con iniezione di schiuma per vene varicose. J Vasc Surg. 2006;43: 162-164.