Stáhnout toto číslo Zpět na přehled
Steven E. ZIMMET2,3
Austin, USA
ABSTRACT
Endovenózní laserová ablace (EVLA) je méně invazivní alternativou strippingu žil. Výsledky se zdají být stejné nebo lepší než při strippingu, s lepším skóre kvality života v pooperačním období. Bylo prokázáno, že EVLA upravuje nebo významně zlepšuje hemodynamické abnormality u pacientů s chronickou žilní insuficiencí (CVI) s povrchovým žilním refluxem. První zprávy naznačují, že techniky endovenózní ablace jsou na rozdíl od chirurgického strippingu spojeny s nízkým výskytem neovaskularizace.
K provádění EVLA se používají různé vlnové délky. Zatímco výchozím chromoforem je voda nebo hemoglobin v závislosti na použité vlnové délce, uhlík se jeví jako sekundární, ale klíčový chromofor, který je pravděpodobně nezávislý na vlnové délce.
Použití principů tumescentní anestezie při léčbě žil spolu s rozvojem technik endovenózní ablace nabízí možnost léčit naprostou většinu pacientů s křečovými žilami v ordinaci bez celkové anestezie nebo chirurgických řezů a zároveň maximalizovat výsledky a minimalizovat recidivy.
ÚVOD
Reflux vena saphena je základní primární abnormalitou ve většině případů povrchové žilní insuficience. Proto v myšlení flebologů převládly přístupy k řešení inkompetence safénofemorálního spojení a kmene safény. Trendelenburg popsal v 90. letech 19. století samotnou ligaci safénofemorální junkce bez strippingu inkompetentní safény. Mezi výhody samotného podvazu oproti podvazu a strippingu, které jsou dodnes vychvalovány,1 patří zachování podkožního kmene pro případné budoucí použití jako bypassového štěpu2 a zabránění poranění podkožního nervu.3 Samotný vysoký podvaz je méně invazivní, rychleji a jednodušeji proveditelný a ve srovnání se strippingem žíly je spojen se snazší rekonvalescencí. Je sice pravda, že rutinně „šetří“ safénový kmen,4 ale použití nemocné safény jako konduitu je spojeno se zvýšeným rizikem selhání štěpu.5 A co je nejdůležitější, již není pochyb o tom, že samotná vysoká ligace obvykle vede k přetrvávajícímu refluxu v safénovém kmeni.6,7 Recidivy varixů se významně snižují7-9 a míra reoperací je o 60 až 70 % nižší, pokud se provede stripping safény ve srovnání se samotnou ligací.10,11 Také po samotné ligaci byla recidiva nebo reziduální komunikace se spojkou v třísle zjištěna u 80 % pacientů, zatímco 34 % mělo také inkompetenci perforátoru střední části stehna přes nestriptovanou velkou safénovou žílu (GSV).12 Jak Neglen uzavřel, stripping GSV stehna je nezbytný pro minimalizaci recidiv, které jsou způsobeny opětovným rozvojem inkompetentní komunikace se safénofemorální spojkou a v důsledku inkompetence perforátoru stehna.13 Jednoduše řečeno, nedostatky samotné ligace převažují nad jejími výhodami.
Je důležité poznamenat, že recidiva je častá i po ligaci a strippingu podkožní žíly. Zatímco neadekvátní operace safénofemorální junkce a progrese onemocnění jsou mechanismy, které vysvětlují některé případy recidivy, dalším důležitým mechanismem je neovaskularizace v okolí junkce po žilní operaci.11,14 Ve skutečnosti byla neovaskularizace popsána jako hlavní příčina recidivy,9 přičemž neovaskulární kanálky různé velikosti, počtu a tortuozity představují ve většině případů reflux k recidivujícím varikozitám.15 Ačkoli někteří vyjádřili pochybnosti o pravdivosti skutečné neovaskularizace, existují jasné histologické důkazy, že neovaskularizace je příčinou recidivujících varixů.16 První zprávy naopak naznačují, že techniky endovenózní ablace jsou spojeny s velmi nízkým výskytem neovaskularizace. 17 Je možné, že vzniku neovaskularizace se do značné míry zabrání tím, že se vyhneme disekci třísla a zachováme žilní drenáž v normálních junkčních přítocích.18,19
EVLA, stejně jako radiofrekvenční ablace a pěnová skleroterapie, je méně invazivní alternativou strippingu žil. EVLA je indikována u ambulantního pacienta s refluxem velké, malé nebo akcesorní podkožní žíly s povrchovými varixy a/nebo příznaky či komplikacemi souvisejícími s povrchovou žilní insuficiencí. EVLA se rutinně provádí v ordinaci za použití zředěné lokální anestezie s doplňkovými perorálními anxiolytiky nebo bez nich. Provedení zákroku trvá zpravidla 30-60 minut, doba zákroku závisí na délce ošetřovaného úseku, zkušenostech operatéra a na tom, zda jsou prováděny pomocné postupy, jako je ambulantní flebektomie. Bez ohledu na to, jakým způsobem je ošetřena základní inkompetence podkožní žíly, jsou k ošetření reziduálních varixů obvykle nutné pomocné zákroky (obr. 1).
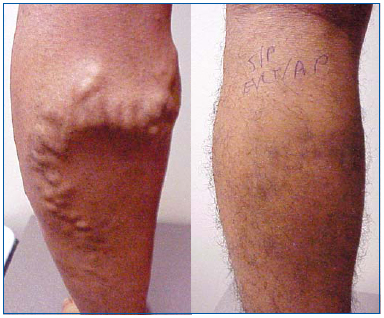
Obr. 1. Muž ve věku 26 let před a 1 měsíc po endovenózní laserové ablaci velké podkožní žíly a ambulantní flebektomii varikózních přítoků.
EFEKTIVITA
Krátkodobé a střednědobé studie EVLA bez ohledu na použitou vlnovou délku se zdají být pozoruhodně konzistentní a obvykle uvádějí ablaci refluxních podkožních žil v 90 % a více případů.18,20-23 Bylo prokázáno, že EVLA podkožní žíly upravuje nebo významně zlepšuje hemodynamické abnormality a klinické příznaky chronické žilní insuficience (CVI) u pacientů klinické, etiologické, anatomické a patofyziologické třídy 3-6 (CEAP) s povrchovým žilním refluxem.24,25 Výsledky se zdají být stejné nebo lepší než výsledky strippingu, s lepším skóre kvality života v pooperačním období ve srovnání se strippingem.20,25-27 Byla zaznamenána vysoká míra spokojenosti pacientů.18,28,29 Celkové náklady (náklady na zákrok plus společenské náklady) endovenózních zákroků jsou pravděpodobně stejné nebo nižší než náklady na chirurgický zákrok.27
Předběžné údaje o léčbě GSV pomocí zařízení s vlnovou délkou 810 nm a 940 nm naznačují, že selhání léčby je u pacientů léčených > 70 J/cm neobvyklé.30,31 Rychlost stažení 2 mm/s při 14 wattech poskytuje 70 J/cm.
MECHANISMUS ÚČINKU
V současné době se pro EVLA používají následující vlnové délky: 810, 940, 980, 1064, 1319, 1320 a 2068 nm. Předpokládá se, že poškození žilní stěny je zprostředkováno jak přímým účinkem, tak nepřímo prostřednictvím laserem indukované páry, která vzniká ohřevem malého množství krve v žíle.32 Někteří naznačují, že volba vlnové délky výrazně ovlivňuje výsledky.23
Hlavním chromoforem laserů 1320 a 2078 nm je, alespoň zpočátku, voda, zatímco ostatní vlnové délky používané pro EVLA cílí především na hemoglobin. Je zřejmé, že pro dosažení účinné ablace je nezbytné dostatečně tepelně poškodit stěnu žíly. K určitému ohřevu může dojít přímou absorpcí fotonové energie (záření) žilní stěnou a také konvekcí z bublinek páry a vedením z ohřáté krve. Je však nepravděpodobné, že by tyto poslední mechanismy představovaly většinu dopadu na žílu. Maximální teplota krve je 100 °C. Bylo zjištěno, že při laserovém ošetření dochází ke karbonizaci žilní stěny.33 Karbonizace laserového hrotu, ke které dochází při teplotě přibližně 300 °C, byla zaznamenána po EVLA a zdá se, že k ní dochází bez ohledu na použitou vlnovou délku.34 Karbonizace hrotu laserového vlákna vytváří bodový zdroj tepla a v podstatě snižuje průnik světla do tkáně na nulu.34,35 Mordon et al uvedli: „Pára vznikající absorpcí laserové energie krví představuje nepatrný zlomek energie potřebné k poškození žilní stěny a nemůže být primárním mechanismem poškození žíly endovenózním laserem. Karbonizace a trakt ve stěnách žil, které jsou pozorovány histologicky po endovenózním laseru, mohou být pouze důsledkem přímého kontaktu hrotu laserového vlákna se stěnou žíly. „36 Dr. Rox Anderson, ředitel The Wellman Center for Photomedicine v Massachusetts General Hospital, uvedl, že uhlík se zdá být sekundárním, ale klíčovým chromoforem, který je pravděpodobně nezávislý na vlnové délce (obrázek 2).34 Všimněte si, že hrot a tvar vlákna mohou mít vliv na rozvoj karbonizace.37

Obrázek 2. Karbonizace 600mikronového hrotu laserového vlákna sekundárně po endovenózní laserové ablaci laserem o vlnové délce 1320 nm (foto s laskavým svolením Marka Forrestala, MD, FACPh).
TUMESCENTNÍ ANESTÉZIE
EVLA by měla být prováděna v lokální anestezii za použití velkých objemů zředěného roztoku lidokainu a adrenalinu (průměrný objem 200-400 ml 0,1% lidokainu s adrenalinem 1:1 000 000), který je pufrován hydrogenuhličitanem sodným. Tento roztok by měl být podáván buď manuálně, nebo pomocí infuzní pumpy pod ultrazvukovou kontrolou tak, aby byla žíla obklopena anestetickou tekutinou po celé délce ošetřovaného segmentu (obrázek 3).
Mezi výhody tumescentní anestezie pro endovenózní ablaci patří:
– anestezie,
– oddělení ošetřované žíly od okolních struktur,
– tepelný ponor, který snižuje maximální teploty v perivenózních tkáních,
– komprese žíly, která maximalizuje účinek léčby na stěnu žíly.
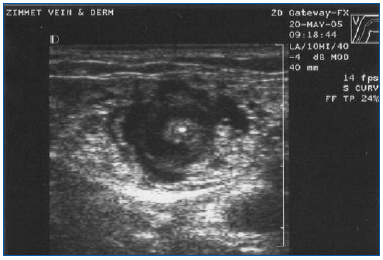
Obrázek 3. Příčný ultrazvukový obraz tumescentní anestetické tekutiny obklopující centrálně umístěnou velkou podkolenní žílu a laserové vlákno/pouzdro.
Ačkoli maximální bezpečná dávka lidokainu při použití tumescentní techniky u žilních výkonů není dobře prozkoumána, dávka 35 mg/kg je rozumným odhadem.
Při použití těchto parametrů se tumescentní anestezie v souvislosti s liposukcí ukázala jako mimořádně bezpečná. Další informace jsou k dispozici na http://www.liposuction.com/pharmacology/drug_inter act.php.
KONTRAINDIKACE K EVLA
Kontraindikace k technice EVLA jsou letmo uvedeny v tabulce I.

Tabulka I. Kontraindikace k endovenóznímu laseru.
KRÁTKODOBÉ SEBEVRAŽDY
Po EVLA byly běžně pozorovány krátkodobé bolesti a ekchymózy. V retrospektivním přehledu bylo zaznamenáno, že přerušované pulzní stahování laserových vláken způsobuje významně vyšší míru pooperační bolesti a modřin ve srovnání s protokolem kontinuálního stahování.38 Přidání krátkého strečového obvazu po dobu 3 dnů po EVLA v přerušovaném režimu podstatně snížilo modřiny a bolest hlášené pacienty. Nasazení kontinuálního režimu pullback dále snížilo intenzitu bolesti a modřin do té míry, že jejich úroveň byla podobná jako u pacientů léčených radiofrekvenční ablací (tabulky II a III). Předběžné zprávy naznačují, že mohou existovat určité rozdíly v pooperačním průběhu v závislosti na vlnové délce použité k provedení EVLA.22,39 To však vychází z kusých údajů s krátkodobým sledováním.
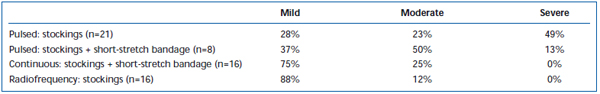
Tabulka II. Pacienty hodnocené pooperační modřiny 3-7 dní po pulzní endovenózní laserové ablaci (EVLA) s punčochami II. třídy, pulzní EVLA s punčochami plus obvazem s krátkým roztažením, EVLA v kontinuálním režimu s punčochami a obvazem s krátkým roztažením a radiofrekvenční ablaci s punčochami.
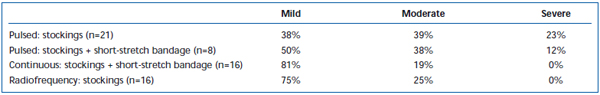
Tabulka III. Pacienty hodnocená pooperační bolest 3-7 dní po pulzní endovenózní laserové ablaci (EVLA) s punčochami II. třídy, pulzní EVLA s punčochami plus krátká natahovací bandáž, kontinuální režim EVLA s punčochami a krátkou natahovací bandáží a radiofrekvenční ablace s punčochami.
PERIVENOUS THERMAL INJURY
Mediální maximální intravaskulární teploty během EVLA (kozí jugulární žíla, 12 wattů, 1sekundové pulzy, 1sekundové intervaly), měřené v rovině s laserovým hrotem, byly v průměru 729 °C, zatímco teploty 4 mm distálně od hrotu byly v průměru 93 °C.40 Riziko kolaterálního tepelného poškození však závisí na perivenózním ohřevu tkáně, nikoli na intravaskulární teplotě.
Bylo zjištěno, že kolagen se smršťuje při teplotě přibližně 50 °C, zatímco k nekróze dochází mezi 70 °C a 100 °C.41 Rozsah tepelného poškození tkáně je silně závislý na množství a době trvání tepla, kterému je tkáň vystavena. Henriques a Moritz zkoumali časovou a teplotní odezvu tkáně vystavené teplotě do 70 °C.42 Zjistili, že kůže snese zvýšení teploty po velmi krátkou dobu expozice a že se zdá, že s kratší dobou expozice je odezva logaritmická. Například zvýšení tělesné teploty na 58 °C způsobí destrukci buněk, pokud je expozice delší než 10 sekund. Tkáně však vydrží teplotu až 70 °C, pokud je doba expozice kratší než 1 sekunda. Li a spol. uvedli, že zahřátí endoteliálních buněk na teplotu 48 °C po dobu 10 minut nevyvolalo buněčnou smrt.43 Zjistili také, že u osteoblastů došlo po vystavení teplotě 45 °C po dobu 10 minut nebo kratší k přechodným a reverzibilním změnám. Jiná studie zjistila reverzibilní poškození tkáně zadní končetiny myší po ponoření do vodní lázně při 44 °C.44
Nedávná studie měřila maximální teplotu na vnější stěně žíly během EVLA v živé žíle prasečího ucha a v exponovaných žilách zadní končetiny.45 Nastavení EVLA se pohybovalo od 8 wattů (1-2 sekundy trvání pulzu), 10 wattů (1-1,5 sekundy trvání pulzu), 12 wattů (0,5-1,5 sekundy trvání pulzu) až po 15 wattů (0,5-1,0 sekundy trvání pulzu), s tumescentní anestezií i bez ní. Výsledky ukazují, že vrcholové teploty se pohybovaly v rozmezí 34,6 °C až 49,1 °C v závislosti na dodaných joulech, přičemž nižších vrcholových teplot bylo dosaženo při přítomnosti tumescentní tekutiny (Obrázek 4).
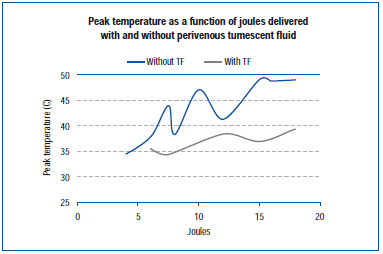
Obrázek 4. Převzato z Zimmet SE, Min RJ. Změny teploty v perivenózní tkáni během endovenózní laserové léčby na prasečím modelu. J Vasc Interv Radiol. 2003;14:911-915 (ref 45).
Vrcholová teplota naměřená během EVLA (63 pacientů, 980 nm, 15 wattů, 1,5sekundové pulzy) na vnější stěně žíly u lidí, 3 cm pod safénofemorální spojkou, byla 40,9 °C a 49,8 °C s tumescentní tekutinou a bez ní.46 Podobné výsledky byly zaznamenány z jiné studie u lidí během EVLA (12 pacientů, 810 nm, 12 W, 1sekundové pulzy, 1sekundové intervaly, tumescentní technika), s maximálními teplotami 43,3 °C, 42,0 °C a 36,0 °C ve vzdálenosti 3 mm, 5 mm a 10 mm od GSV. 47
Zdá se, že během EVLA dochází k velmi rychlému poklesu teploty na krátkou vzdálenost. To je pravděpodobně na rozdíl od radiofrekvenční energie, kde dochází k mikrovlnnému ohřevu v okolí rozhraní tkáň-elektroda. Údaje o zvířatech a lidech naznačují, že vrcholové perivenózní teploty vznikající při endovenózním laseru pravděpodobně ve většině situací nezpůsobí trvalé poškození perivenózní tkáně. Vrcholová teplota se snižuje při použití perivenózní tumescentní tekutiny. Tato zjištění zřejmě vysvětlují velmi nízký hlášený výskyt poranění nervů a popálenin kůže po EVLA. V jedné studii, v níž byl použit Nd: YAG laser o vlnové délce 1064 nm, byl zaznamenán velmi vysoký výskyt parestezií u 36,5 % a popálenin kůže u 4,8 %.48 Je třeba poznamenat, že množství dodané energie bylo přibližně třikrát vyšší, než se obvykle používá, a že ošetření bylo provedeno bez tumescentní anestezie. Navzdory nízkým perivenózním teplotám hlášeným při EVLA je důležité poznamenat, že při zvažování endovenózní intervence v některých případech, jako jsou varixy sedacího nervu, je nutná zvláštní opatrnost.49,50
VĚTŠÍ KOMPLIKACE
Větší komplikace po EVLA byly hlášeny vzácně. Míra výskytu hluboké žilní trombózy (HŽT), shrnutá z více sérií, je mnohem nižší než 1 %.17,18,20,28 Jedna skupina uvádí výskyt rozšíření trombu do femorální žíly 7,7 %.51 V této studii však byla EVLA provedena v celkové nebo spinální anestezii. K vysokému výskytu rozšíření trombu mohla přispět skutečnost, že pacienti nebyli schopni bezprostředně po operaci ambulovat. Existuje jediná zpráva o arteriovenózní píštěli, která vznikla po EVLA krátké podkožní žíly (SSV).52 U jednoho pacienta se po EVLA v kombinaci s otevřenou ligací perforátorů a bodovou flebektomií vyvinula septická tromboflebitida.53 Ta se vyřešila antibiotickou léčbou a debridementem.
ALTERNATIVNÍ PŘÍSTUPY
EVLA a radiofrekvenční ablace (RFA)54,55 se zdají být účinnými způsoby léčby inkompetence safény. Mezi výhody EVLA oproti RFA patří kratší doba zákroku a nižší náklady na jedno ošetření. Uváděná míra okluze při EVLA je obecně o něco vyšší než při RFA.56 Mezi nevýhody EVLA může patřit větší množství modřin a nepohodlí v časném pooperačním období, i když to může záviset na technice. Obě techniky se nadále zdokonalují, což povede ke zlepšení výsledků. Oba zákroky, pokud jsou prováděny v tumescentní anestezii, jsou spojeny s nízkou mírou komplikací.
Další nově se objevující metodou léčby podkožního refluxu je použití pěnových sklerozantů podávaných pod ultrazvukovou kontrolou. Plyn, například vzduch nebo CO2, lze smíchat s tekutými detergentními sklerotizátory a vytvořit tak pěnu, která je podle odhadů asi čtyřikrát účinnější než tekutá forma téhož prostředku. První výsledky naznačují, že se může jednat o cennou metodu, neboť její provedení je rychlé a levné a uvádí se, že krátkodobá a střednědobá úspěšnost se pohybuje kolem 75 % až 90 %. Existuje mnoho proměnných týkajících se pěny (např. typ a množství plynu, technika použitá k vytvoření pěny, koncentrace a typ použitého sklerotizačního prostředku, vstřikovaný objem atd.) Po pěnové skleroterapii může být vyšší riziko hluboké žilní trombózy ve srovnání se standardní skleroterapií. Pro minimalizaci rizika této komplikace je důležitá správná technika. Mezi další nežádoucí účinky hlášené po pěnové skleroterapii patří zrakové a neurologické příhody. Existuje publikovaná zpráva o cévní mozkové příhodě po pěnové skleroterapii (20 ml polidokanolové pěny) u pacienta s 1,8cm patentním foramen ovale.57 Další zkušenosti a výzkum s touto metodou lépe vymezí její rizika i dlouhodobou účinnost.
ZÁVĚR
Současně přijímané zásady léčby křečových žil slouží k maximalizaci výsledků z hemodynamického hlediska i z hlediska pacienta a zároveň k minimalizaci rizika recidivy. Vhodná léčba křečových žil začíná přesným posouzením základní žilní patologie a identifikací zdrojů žilní hypertenze. Mezi cíle léčby patří odstranění nekompetentních spojení mezi hlubokým a povrchovým systémem, jakož i obliterace cest žilní inkompetence a nekompetentních křečových žil. Je zřejmé, že recidivy se snižují, pokud je ablován inkompetentní segment podkožního kmene.
Endovenózní laserová ablace je méně invazivní alternativou strippingu žil. Výsledky se zdají být stejné nebo lepší než u strippingu, s lepším hodnocením kvality života v pooperačním období. Bylo prokázáno, že EVLA koriguje nebo významně zlepšuje hemodynamické abnormality u pacientů s chronickou žilní insuficiencí s povrchovým žilním refluxem. První zprávy naznačují, že techniky endovenózní ablace jsou na rozdíl od chirurgického strippingu spojeny s nízkým výskytem neovaskularizace.
Použití principů tumescentní anestezie při léčbě žil spolu s rozvojem technik endovenózní ablace nabízí možnost léčit naprostou většinu pacientů s povrchovou žilní insuficiencí v ordinaci bez celkové anestezie nebo chirurgických řezů a zároveň maximalizovat výsledky a minimalizovat recidivy.
Tento článek byl odeslán 29. července 2006.

2. Large J. Chirurgická léčba podkožních varixů se zachováním hlavního velkého podkožního kmene. J Vasc Surg. 1985;2:886-891.
3. Holme JB, Holme K, Sorensen LS. Anatomický vztah mezi dlouhou podkožní žílou a podkožním nervem. Význam pro radikální operaci křečových žil. Acta Chir Scand. 1988;154:631-633.
4. Rutherford RB, Sawyer JD, Jones DN. Osud reziduální podkožní žíly po částečném odstranění nebo podvázání. J Vasc Surg. 1990;12:422-426.
5. Panetta TF, Marin ML, Veith FJ, et al. Unsuspected preexisting saphenous vein disease: an unrecognized cause of vein bypass failure. J Vasc Surg. 1992;15:102- 110.
6. McMullin GM, Coleridge-Smith PD, Scurr JH. Objektivní hodnocení ligace bez strippingu dlouhé podkožní žíly. Br J Surg. 1991;78:1139-1142.
7. Sarin S, Scurr JH, Coleridge Smith PD. Hodnocení strippingu dlouhé podkožní žíly při léčbě primárních křečových žil. Br J Surg. 1992;79:889-893.
8. Munn SR, Morton JB, Macbeth WA, McLeish AR. To strip or not to strip the long saphenous vein? A varicose vein trial. Br J Surg. 1981;68:426-481.
9. Jones L, Braithwaite BD, Selwyn D, Cooke S, Earnshaw JJ. Neovaskularizace je hlavní příčinou recidivy křečových žil: výsledky randomizované studie strippingu dlouhé podkožní žíly. Eur J Vasc Endovasc Surg. 1996;12:442-445.
10. Dwerryhouse S, Davies B, Harradine K, Earnshaw JJ. Stripping dlouhé podkožní žíly snižuje míru reoperací pro recidivující křečové žíly: pětileté výsledky randomizované studie. J Vasc Surg. 1999;29:589-592.
11. Winterborn RJ, Foy C, Earnshaw JJ. Příčiny recidivy křečových žil: pozdní výsledky randomizované kontrolované studie strippingu dlouhé podkožní žíly. J Vasc Surg. 2004;40:634-639.
12. Corbett CR, Runcie JJ, Lea TM, Jamieson CW. Důvody pro stripping dlouhé podkožní žíly. Phlebologie. 1988;41:766-769.
13. Neglen P. Léčba varikozit podkožního původu: srovnání ligace, selektivní excize a skleroterapie. In: Srovnávací studie k problematice žilní tkáně: Bergan JJ, Goldman MP eds. Varikózní žíly a teleangiektázie: Diagnostika a léčba. St. Louis, Mo, USA: Quality Medical Publishing; 1993:148-165.
14. Kostas T, Ioannou CV, Touloupakis E, et al. Recurrent varicose veins after surgery: a new appraisal of a common and complex problem in vascular surgery. Eur J Vasc Endovasc Surg. 2004;27:275-282.
15. Van Rij AM, Jones GT, Hill GB, Jiang P. Neovascularization and recurrent varicose veins: more histologic and ultrasound evidence. J Vasc Surg. 2004;40:296-302.
16. Nyamekye I, Shephard NA, Davies B, et al. Clinicopathological evidence that neovascularization is a cause of recurrent varicose veins. Eur J Vasc Endovasc Surg. 1998;15: 412-415.
17. Ravi Ravi, Rodriguez-Lopez JA, Trayler EA, et al. Endovenózní ablace inkompetentních podkožních žil: velké zkušenosti z jednoho centra. J Endovasc Ther. 2006;13:244- 248.
18. Min RJ, Khilnani N, Zimmet SE. Endovenózní laserová léčba refluxu podkožních žil: dlouhodobé výsledky. J Vasc Interv Radiol. 2003;14:991-996.
19. Bergan JJ, Rattner Z. Endovenózní terapie-2005. Acta Chir Bel. 2005;105:12- 15.
20. Agus GB, Mancini S, Magi G. Prvních 1000 případů italské pracovní skupiny pro endovenózní laser (IEWG). Zdůvodnění a dlouhodobé výsledky za období 1999-2003. Int Angiol. 2006;25:209-215.
21. Kalra M, Gloviczki P. Před patnácti lety měl laser otevírat tepny, nyní má uzavírat žíly: jaká je realita tohoto nástroje? Perspect Vasc Surg Endovasc Ther. 2006;18:3-8 (diskuse 9- 10).
22. Kabnick LS. Výsledky různých vlnových délek endovenózního laseru pro ablaci velké podkožní žíly. J Vasc Surg. 2006;43: 88-93.
23. Goldman MP, Maritess M, Rao J. Intravaskulární 1320-nm laserový uzávěr velké podkožní žíly: 6-12měsíční sledovací studie. Dermatol Surg. 2004;30: 1380-1385.
24. Marston WA, Owens LV, Davies S, et al. Endovenózní ablace podkožní žíly koriguje hemodynamické abnormality u pacientů s CVI klinické třídy 3-6 podle CEAP v důsledku povrchového refluxu. Vasc Endovascular Surg. 2006;40:125-130.
25. De Medeiros CA, Luccas GC. Srovnání endovenózní léčby pomocí 810 nm laseru oproti konvenčnímu strippingu velké podkožní žíly u pacientů s primárními křečovými žilami. Dermatol Surg. 2005;31:1685-1694.
26. Mekako AI, Hatfield J, Bryce J, et al. Nerandomizovaná kontrolovaná studie endovenózní laserové terapie a chirurgického zákroku při léčbě křečových žil. Ann Vasc Surg. 2006;Jun 27:.
27. Vuylsteke M, Van den Bussche D, Audenaert EA, Lissens P. Endovenózní laserová obliterace při léčbě primárních křečových žil. Phlebology. 2006;21:80-87. 28. Perkowski P, Ravi R, Gowda RC, et al. Endovenózní laserová ablace podkožní žíly pro léčbu žilní insuficience a křečových žil: první výsledky z velké zkušenosti z jednoho centra. J Endovasc Ther. 2004;11:132-138.
29. Sharif MA, Soong CV, Lau LL, et al. Endovenózní laserová léčba inkompetence dlouhé podkožní žíly. Br J Surg. 2006;93:831-835.
30. Proebstle TM, Krummenauer F, Gul D, Knop J. Nonocclusion and early reopening of the great saphenous vein after endovenous laser treatment is fluence dependent. Dermatol Surg. 2004;30:174-178.
31. Timperman PE, Sichlau M, Ryu RK. Větší dodávka energie zlepšuje úspěšnost léčby endovenózního laserového ošetření inkompetentních podkožních žil. J Vasc Interv Radiol. 2004;15:1061-1063.
32. Proebstle TM, Sandhofer M, Kargl A, et al. Thermal damage of the inner vein wall during endovenous laser treatment: key role of energy absorption by intravascular blood. Dermatol Surg. 2002;28:596-600.
33. Schmedt CG, Sroka R, Steckmeier S, et al. Investigation on radiofrequency and laser (980 nm) effects after endoluminal treatment of saphenous vein insufficiency in an ex-vivo model. Eur J Vasc Endovasc Surg. 2006;Jun 14;.
34. Anderson RR. Endovenózní laser: mechanismus účinku. Příspěvek přednesený na výročním zasedání Americké akademie dermatologie; 3.-7. března 2006; San Francisco, Kalifornie, USA.
35. Izzo F. Další tepelné ablační techniky: mikrovlnná a intersticiální laserová ablace jaterních nádorů. Annals of Surgical Oncology. 2003;10:491-497.
36. Mordon SR, Wassmer B a Zemmouri J. Matematické modelování endovenózní laserové léčby (ELT). BioMedical Engineering OnLine. 2006;5:26. Dostupné na internetu: http://www.biomedical-engineeringonline. com/content/5/1/26. Přístup 19. července 2006.
37. De-Fei Hong, Shu-You Peng, Song-Ying Li, Li-Min Tong. Experimentální studie diodelaserem indukované termokoagulace jaterní tkáně pomocí hrotu skenovacího vlákna. World J Gastroenterol. 2003;9:2350-2352.
38. Zimmet SE. Bolest, modřiny a krátkodobá účinnost po endovenózním laserovém ošetření velké podkožní žíly: vliv operační techniky a pooperační péče. Příspěvek přednesený na 16. výročním kongresu American College of Phlebology; 7.-10. listopadu 2002; Fort Lauderdale, Florida, USA.
39. Proebstle TM, Moehler T, Gul D, Herdemann S. Endovenózní ošetření velké podkožní žíly pomocí Nd:YAG laseru o vlnové délce 1320 nm způsobuje méně vedlejších účinků než použití diodového laseru o vlnové délce 940 nm. Dermatol Surg. 2005;31:1678-1683.
40. Weiss RA. Srovnání endovenózní radiofrekvence versus 810 nm diodového laseru při okluzi velkých žil na zvířecím modelu. Dermatol Surg. 2002;28:56-61.
41. Biesman BS, Khan J. Laserová incize. Clinics in Plastic Surg. 2000;27:213- 220.
42. Moritz AR, Henriques Jr EC. Studies of thermal injury II: the relative importance of time and surface temperature in the causation of cutaneous bums [Studie tepelného poranění II: relativní význam času a povrchové teploty při vzniku kožních bublin]. Am J Pathol. 1947;23:695-720.
43. Li S, Chien S, Branemark P. Heat shockinduced necrosis and apoptosis in osteoblasts [Tepelným šokem indukovaná nekróza a apoptóza v osteoblastech]. J Orthop Res. 1999;17:891-899.
44. Jansen W, Haveman J. Histopatologické změny v kůži a podkožních tkáních myších nohou po léčbě hypertermií. Path Res Pract. 1990;186: 247-253.
45. Zimmet SE, Min RJ. Teplotní změny v perivenózní tkáni během endovenózní laserové léčby na prasečím modelu. J Vasc Interv Radiol. 2003;14:911-915.
46. Lahl W. Thermometric investigations of perivenous temperature during endovenous laser therapy of varicose veins [Termometrické vyšetření perivenózní teploty během endovenózní laserové terapie křečových žil]. Příspěvek přednesený na 15. světovém kongresu Union Internationale de Phlébologie; 2.-7. října 2005; Rio de Janeiro, Brazílie.
47. Beale RJ, Mavor AID, Gough MJ. Heat dissipation during endovenous laser treatment of varicose veins-is there a risk of nerve injury? Phlebology. 2006;21:32-35.
48. Chang CJ, Chua JJ. Endovenózní laserová fotokoagulace (EVLP) křečových žil. Lasers Surg Med. 2002;31:257-262.
49. Ricci S, Georgiev M, Jawien A, Zamboni P. Sciatic nerve varices. Eur J Vasc Endovasc Surg. 2005;29:83-87.
50 Ricci S. Ultrazvukové pozorování sedacího nervu a jeho větví v podkolenní jamce: vždy viditelné, nikdy neviditelné. Eur J Vasc Endovasc Surg. 2005;30:659-663. 51 Mozes G, Kalra M, Carmo M, Swenson L, Gloviczki P. Extension of saphenous thrombus into the femoral vein: a potential complication of new endovenous ablation techniques. J Vasc Surg. 2005;41:130-135.
52 Timperman, PE. Arteriovenózní píštěl po endovenózním laserovém ošetření krátké podkožní žíly. J Vasc Interv Radiol. 2004;15:625-627.
53 Dunst KM, Huemer GM, Wayand W, Shamiyeh A. Diffuse phlegmonous phlebitis after endovenous laser treatment of the greater saphenous vein. J Vasc Surg. 2006;43:1056-1058.
54 Lurie F, Creton D, Eklof B, et al. Prospective randomized study of endovenous radiofrequency obliteration (closure procedure) versus ligation and stripping in the selected patient population (EVOLVeS Study). J Vasc Surg. 2003;38:207-214.
55 Merchant RF, DePalma RG, Kabnick LS. Endovaskulární obliterace podkožního refluxu: multicentrická studie. J Vasc Surg. 2002;35:1190-1196.
56 Puggioni A, Kalra M, Carmo M, Mozes G, Gloviczki P. Endovenózní laserová terapie a radiofrekvenční ablace velké podkožní žíly: analýza časné účinnosti a komplikací. J Vasc Surg. 2005;42; 488-493.
57 Forlee MV, Grouden M, Moore DJ, Shanik G. Stroke after varicose vein foam injection sclerotherapy. J Vasc Surg. 2006;43: 162-164.
.