Diese Ausgabe herunterladen Zurück zur Zusammenfassung
Steven E. ZIMMET2,3
Austin, USA
ABSTRACT
Die endovenöse Laserablation (EVLA) ist eine weniger invasive Alternative zum Venenstripping. Die Ergebnisse scheinen denen des Strippings zu entsprechen oder sie zu übertreffen, wobei die Lebensqualität nach der Operation besser ist. Es hat sich gezeigt, dass EVLA hämodynamische Anomalien bei Patienten mit chronischer Veneninsuffizienz (CVI) mit oberflächlichem venösem Reflux korrigieren oder deutlich verbessern kann. Erste Berichte deuten darauf hin, dass endovenöse Ablationstechniken im Gegensatz zum chirurgischen Stripping mit einer geringen Inzidenz von Neovaskularisationen einhergehen.
Zur Durchführung der EVLA werden verschiedene Wellenlängen verwendet. Während das erste Chromophor je nach Wellenlänge Wasser oder Hämoglobin ist, scheint Kohlenstoff ein sekundäres, aber wichtiges Chromophor zu sein, das wahrscheinlich unabhängig von der Wellenlänge ist.
Die Anwendung der Prinzipien der Tumeszenzanästhesie auf Venenbehandlungen sowie die Entwicklung endovenöser Ablationstechniken bieten die Möglichkeit, die überwiegende Mehrheit der Patienten mit Krampfadern in der Praxis ohne Vollnarkose oder chirurgische Schnitte zu behandeln und gleichzeitig die Ergebnisse zu maximieren und das Wiederauftreten zu minimieren.
EINFÜHRUNG
Der Reflux der Vena saphena magna ist die zugrundeliegende primäre Anomalie in der Mehrzahl der Fälle von oberflächlicher Veneninsuffizienz. Daher haben die Ansätze zur Behandlung der saphenofemoralen Verbindung und der saphenösen Stamminsuffizienz das Denken der Phlebologen dominiert. Trendelenburg beschrieb in den 1890er Jahren die alleinige Ligatur des saphenofemoralen Übergangs, ohne Stripping der inkompetenten Vena saphena magna. Zu den Vorteilen der alleinigen Ligatur gegenüber Ligatur und Stripping, die auch heute noch angepriesen werden,1 gehören der Erhalt des Saphena-Stammes für eine mögliche spätere Verwendung als Bypass-Transplantat2 und die Vermeidung einer Verletzung des Nervus saphenus.3 Die alleinige Hochligatur ist weniger invasiv, schneller und einfacher durchzuführen und geht im Vergleich zum Venenstripping mit einer leichteren Erholung einher. Es stimmt zwar, dass der Stamm der Vena saphena magna routinemäßig „geschont“ wird,4 aber die Verwendung einer erkrankten Vena saphena magna als Conduit wird mit einem erhöhten Risiko für ein Transplantatversagen in Verbindung gebracht.5 Vor allem steht nicht mehr in Frage, dass die Hochligatur allein in der Regel zu einem persistierenden Reflux im Stamm der Vena saphena magna führt.6,7 Das Wiederauftreten von Varizen wird deutlich reduziert7-9 und die Reoperationsrate ist um 60 % bis 70 % geringer, wenn die Vena saphena magna gestrippt wird, als wenn nur eine Ligatur erfolgt.10,11 Außerdem wurde nach der alleinigen Ligatur bei 80 % der Patienten ein Rezidiv oder eine Restkommunikation mit der Verbindungsstelle in der Leiste festgestellt, während 34 % auch eine Perforansinkompetenz in der Mitte des Oberschenkels über die nicht gestrippte Vena saphena magna (GSV) aufwiesen.12 Wie Neglen abschließend feststellte, ist das Strippen der GSV des Oberschenkels von wesentlicher Bedeutung für die Minimierung des Rezidivs, das durch die Neuentwicklung einer inkompetenten Kommunikation mit der saphenofemoralen Einmündung und durch eine Perforansinkompetenz im Oberschenkel verursacht wird.13 Einfach ausgedrückt: Die Nachteile der Ligatur allein überwiegen ihre Vorteile.
Es ist wichtig zu beachten, dass Rezidive auch nach Ligatur und Stripping der Vena saphena magna häufig auftreten. Während unzureichende chirurgische Eingriffe an der saphenofemoralen Verbindung und das Fortschreiten der Erkrankung Mechanismen sind, die einige Fälle von Rezidiven erklären, ist ein weiterer wichtiger Mechanismus die Neovaskularisierung um die Verbindung nach venösen Eingriffen.11,14 Tatsächlich wurde die Neovaskularisierung als Hauptursache für Rezidive angegeben,9 wobei neovaskuläre Kanäle unterschiedlicher Größe, Anzahl und Tortuosität in der Mehrzahl der Fälle für den Reflux zu wiederkehrenden Varizen verantwortlich sind.15 Obwohl einige Zweifel am Wahrheitsgehalt einer echten Neovaskularisierung geäußert haben, gibt es eindeutige histologische Beweise dafür, dass Neovaskularisierung eine Ursache für rezidivierende Varizen ist.16 Frühe Berichte deuten dagegen darauf hin, dass endovenöse Ablationstechniken mit einer sehr geringen Inzidenz von Neovaskularisierung verbunden sind. 17 Möglicherweise wird die Entwicklung von Neovaskularisationen weitgehend dadurch verhindert, dass eine Dissektion der Leiste vermieden und der venöse Abfluss in den normalen junktionalen Zuflüssen erhalten wird.18,19
EVLA ist wie die Radiofrequenzablation und die Schaumsklerotherapie eine weniger invasive Alternative zum Venenstripping. EVLA ist bei ambulanten Patienten mit Reflux der großen, kleinen oder akzessorischen Vena saphena magna mit oberflächlichen Varizen und/oder Symptomen oder Komplikationen im Zusammenhang mit oberflächlicher Veneninsuffizienz indiziert. Die EVLA wird routinemäßig unter verdünnter Lokalanästhesie mit oder ohne zusätzliche orale Anxiolytika in einer Praxis durchgeführt. Der Eingriff dauert in der Regel 30 bis 60 Minuten und ist abhängig von der Länge des behandelten Segments, der Erfahrung des Operateurs und davon, ob zusätzliche Verfahren wie die ambulante Phlebektomie durchgeführt werden. Unabhängig davon, wie die zugrunde liegende Saphena-Inkompetenz behandelt wird, sind in der Regel zusätzliche Behandlungen erforderlich, um verbleibende Varizen zu behandeln (Abbildung 1).
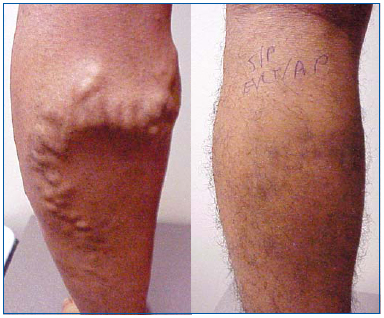
Abbildung 1. 26 Jahre alter Mann vor und 1 Monat nach endovenöser Laserablation der Vena saphena magna und ambulanter Phlebektomie variköser Zuflüsse.
EFFIZIENZ
Kurz- und mittelfristige Studien zur EVLA, unabhängig von der verwendeten Wellenlänge, scheinen bemerkenswert konsistent zu sein und berichten in der Regel über die Ablation von refluxierenden Saphena-Venen in 90% oder mehr der Fälle.18,20-23 Es hat sich gezeigt, dass die EVLA der Vena saphena magna die hämodynamischen Anomalien und klinischen Symptome der chronischen venösen Insuffizienz (CVI) bei Patienten der klinischen, ätiologischen, anatomischen und pathophysiologischen Klasse 3-6 (CEAP) mit oberflächlichem venösem Reflux korrigiert oder signifikant verbessert.24,25 Die Ergebnisse scheinen denen des Strippings zu entsprechen oder besser zu sein, wobei die Lebensqualität in der postoperativen Phase besser ist als beim Stripping.20,25-27 Es wurde über eine hohe Patientenzufriedenheit berichtet.18,28,29 Die Gesamtkosten (Kosten des Verfahrens plus gesellschaftliche Kosten) endovenöser Verfahren sind wahrscheinlich gleich oder niedriger als die der Chirurgie.27
Frühe Daten zur Behandlung der GSV mit 810-nm- und 940-nm-Geräten deuten darauf hin, dass ein Behandlungsversagen bei Patienten, die mit > 70 J/cm behandelt werden, selten ist.30,31 Eine Rückzugsrate von 2 mm/s bei 14 Watt liefert 70 J/cm.
Wirkungsmechanismus
Die folgenden Wellenlängen werden derzeit für EVLA verwendet: 810, 940, 980, 1064, 1319, 1320 und 2068 nm. Es wurde postuliert, dass die Verletzung der Venenwand sowohl direkt als auch indirekt über laserinduzierten Dampf erfolgt, der durch die Erhitzung kleiner Blutmengen in der Vene erzeugt wird.32 Einige haben behauptet, dass die Wahl der Wellenlänge einen großen Einfluss auf die Ergebnisse hat.23
Das Hauptchromophor von 1320- und 2078-nm-Lasern ist, zumindest anfänglich, Wasser, während andere für EVLA verwendete Wellenlängen in erster Linie auf Hämoglobin abzielen. Um eine wirksame Ablation zu erreichen, muss die Venenwand unbedingt angemessen thermisch geschädigt werden. Eine gewisse Erwärmung kann durch direkte Absorption von Photonenenergie (Strahlung) durch die Venenwand sowie durch Konvektion von Dampfblasen und Konduktion von erwärmtem Blut erfolgen. Es ist jedoch unwahrscheinlich, dass die letztgenannten Mechanismen für den größten Teil der Auswirkungen auf die Vene verantwortlich sind. Die Höchsttemperatur von Blut beträgt 100 °C. Es wurde festgestellt, dass die Laserbehandlung zu einer Karbonisierung der Venenwand führt.33 Die Karbonisierung der Laserspitze, die bei ca. 300°C auftritt, wird nach der EVLA festgestellt und scheint unabhängig von der verwendeten Wellenlänge aufzutreten.34 Die Karbonisierung der Laserfaserspitze erzeugt eine punktuelle Wärmequelle und reduziert im Wesentlichen die Lichtpenetration in das Gewebe auf Null.34,35 Mordon et al. stellten fest: „Der Dampf, der durch die Absorption der Laserenergie durch das Blut erzeugt wird, ist ein winziger Bruchteil der Energie, die notwendig ist, um die Venenwand zu schädigen, und kann nicht der primäre Mechanismus der Schädigung der Vene durch endovenöse Laser sein. Die Karbonisierung und der Trakt in den Venenwänden, die in der Histologie nach endovenöser Laserbehandlung zu sehen sind, können nur das Ergebnis eines direkten Kontakts zwischen der Spitze der Laserfaser und der Venenwand sein.36 Dr. Rox Anderson, Direktor des Wellman Center for Photomedicine am Massachusetts General Hospital, berichtete, dass Kohlenstoff ein sekundäres, aber wichtiges Chromophor zu sein scheint, das wahrscheinlich unabhängig von der Wellenlänge ist (Abbildung 2).34 Beachten Sie, dass die Faserspitze und die Form der Faser die Entwicklung der Karbonisierung beeinflussen können.37

Abbildung 2. Karbonisierung einer 600-Mikrometer-Laserfaserspitze als Folge einer endovenösen Laserablation mit einem 1320-nm-Laser (Foto mit freundlicher Genehmigung von Mark Forrestal, MD, FACPh).
TUMESZENTANÄSTHESIE
EVLA sollte unter örtlicher Betäubung mit großen Mengen einer verdünnten Lösung von Lidocain und Epinephrin (durchschnittliches Volumen von 200-400 ml 0,1 % Lidocain mit 1:1.000.000 Epinephrin) durchgeführt werden, die mit Natriumbicarbonat gepuffert ist. Diese Lösung sollte entweder manuell oder mit einer Infusionspumpe unter Ultraschallkontrolle verabreicht werden, so dass die Vene über die gesamte Länge des zu behandelnden Segments von der Anästhesieflüssigkeit umgeben ist (Abbildung 3).
Die Vorteile der Tumeszenzanästhesie für die endovenöse Ablation umfassen:
– Anästhesie,
– Trennung der zu behandelnden Vene von den umgebenden Strukturen,
– Wärmesenke, die die Temperaturspitzen im perivenösen Gewebe reduziert,
– Venenkompression, die die Wirkung der Behandlung auf die Venenwand maximiert.
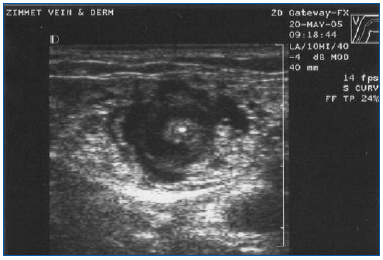
Abbildung 3. Transversales Ultraschallbild der Tumeszenzanästhesieflüssigkeit, die die zentral gelegene Vena saphena magna und die Laserfaser/den Laserkanal umgibt.
Obwohl die maximale sichere Dosierung von Lidocain bei der Tumeszenztechnik für venöse Eingriffe nicht gut untersucht ist, ist eine Dosierung von 35 mg/kg eine vernünftige Schätzung.
Unter Verwendung dieser Parameter hat sich die Tumeszenzanästhesie im Rahmen der Fettabsaugung als außerordentlich sicher erwiesen. Weitere Informationen finden Sie unter http://www.liposuction.com/pharmacology/drug_inter act.php.
KONTRAINDIKATIONEN FÜR EVLA
Kontraindikationen für die EVLA-Technik sind in Tabelle I zusammengefasst.

Tabelle I. Kontraindikationen für den endovenösen Laser.
UNERWÜNSCHTE SEQUELAE
Kurzfristige Schmerzen und Ekchymosen sind nach EVLA häufig beobachtet worden. In einer retrospektiven Untersuchung wurde berichtet, dass der intermittierende Laserfaser-Pullback im Vergleich zu einem kontinuierlichen Pullback-Protokoll signifikant mehr postoperative Schmerzen und Blutergüsse verursachte.38 Durch das Anlegen einer Kurzzugbinde für drei Tage nach der intermittierenden EVLA wurden die von den Patienten berichteten Blutergüsse und Schmerzen deutlich reduziert. Die Anwendung des kontinuierlichen Rückzugs reduzierte den Schweregrad von Schmerzen und Blutergüssen weiter, so dass die Werte ähnlich denen waren, die von Patienten berichtet wurden, die mit Radiofrequenzablation behandelt wurden (Tabellen II und III). Vorläufige Berichte deuten darauf hin, dass es einige Unterschiede im postoperativen Verlauf geben könnte, je nachdem, welche Wellenlänge zur Durchführung der EVLA verwendet wird.22,39 Dies basiert jedoch auf spärlichen Daten mit kurzfristiger Nachbeobachtung.
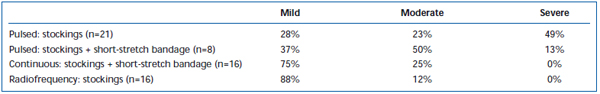
Tabelle II. Von Patienten bewertete postoperative Blutergüsse 3-7 Tage nach gepulster endovenöser Laserablation (EVLA) mit Strümpfen der Klasse II, gepulster EVLA mit Strümpfen plus Kurzzugbinde, kontinuierlicher EVLA mit Strümpfen und Kurzzugbinde und Radiofrequenzablation mit Strümpfen.
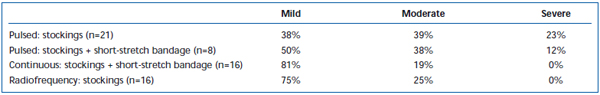
Tabelle III. Von Patienten bewertete postoperative Schmerzen 3-7 Tage nach gepulster endovenöser Laserablation (EVLA) mit Strümpfen der Klasse II, gepulster EVLA mit Strümpfen plus Kurzzugbinde, kontinuierlicher EVLA mit Strümpfen und Kurzzugbinde und Radiofrequenzablation mit Strümpfen.
PERIVENOUS THERMAL INJURY
Die durchschnittlichen intravaskulären Spitzentemperaturen während der EVLA (Jugularvene der Ziege, 12 Watt, 1-Sekunden-Pulse, 1-Sekunden-Intervalle), die bündig mit der Laserspitze gemessen wurden, betrugen durchschnittlich 729°C, während die Temperaturen 4 mm distal von der Spitze durchschnittlich 93°C betrugen.40 Das Risiko einer kollateralen thermischen Schädigung hängt jedoch von der perivenösen Gewebeerwärmung und nicht von der intravaskulären Temperatur ab.
Es wurde festgestellt, dass sich Kollagen bei etwa 50°C zusammenzieht, während Nekrose zwischen 70°C und 100°C auftritt.41 Das Ausmaß der thermischen Schädigung des Gewebes hängt stark von der Menge und der Dauer der Hitzeeinwirkung auf das Gewebe ab. Henriques und Moritz untersuchten die Zeit-Temperatur-Reaktion von Gewebe, das einer Temperatur von bis zu 70 °C ausgesetzt war.42 Sie fanden heraus, dass die Haut Temperaturerhöhungen bei sehr kurzen Expositionszeiten standhalten kann und dass die Reaktion logarithmisch zu sein scheint, je kürzer die Expositionszeiten werden. So führt beispielsweise ein Anstieg der Körpertemperatur auf 58 °C zur Zerstörung der Zellen, wenn die Exposition länger als 10 Sekunden dauert. Gewebe können jedoch Temperaturen von bis zu 70 °C standhalten, wenn die Dauer der Exposition weniger als 1 Sekunde beträgt. Li et al. berichteten, dass die 10-minütige Erhitzung von Endothelzellen auf 48 °C nicht zum Zelltod führt.43 Sie fanden auch heraus, dass Osteoblasten nach einer 10-minütigen oder kürzeren Exposition bei 45 °C vorübergehende und reversible Veränderungen aufweisen. In einer anderen Studie wurde eine reversible Gewebeschädigung der hinteren Gliedmaßen von Mäusen nach Eintauchen in ein Wasserbad bei 44°C festgestellt.44
In einer neueren Studie wurde die Spitzentemperatur an der äußeren Venenwand während der EVLA in einer lebenden Schweineohrvene und in exponierten Venen der hinteren Gliedmaßen gemessen.45 Die EVLA-Einstellungen reichten von 8 Watt (1-2 Sekunden Pulsdauer), 10 Watt (1-1,5 Sekunden Pulsdauer), 12 Watt (0,5-1,5 Sekunden Pulsdauer) bis 15 Watt (0,5-1,0 Sekunden Pulsdauer), mit und ohne Tumeszenzanästhesie. Die Ergebnisse zeigen, dass die Spitzentemperaturen in Abhängigkeit von den abgegebenen Joule zwischen 34,6°C und 49,1°C lagen, wobei niedrigere Spitzentemperaturen erreicht wurden, wenn Tumeszenzflüssigkeit vorhanden war (Abbildung 4).
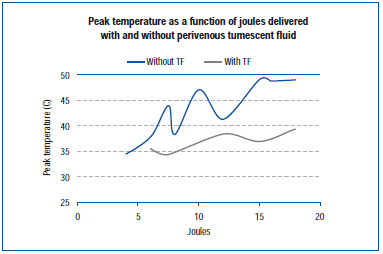
Abbildung 4. Adaptiert von Zimmet SE, Min RJ. Temperaturveränderungen im perivenösen Gewebe während einer endovenösen Laserbehandlung in einem Schweinemodell. J Vasc Interv Radiol. 2003;14:911-915 (ref 45).
Die während der EVLA (63 Patienten, 980 nm, 15 Watt, 1,5-Sekunden-Pulse) gemessene Spitzentemperatur an der äußeren Venenwand beim Menschen, 3 cm unterhalb des saphenofemoralen Übergangs, betrug 40,9°C und 49,8°C mit bzw. ohne Tumeszenzflüssigkeit.46 Ähnliche Ergebnisse wurden aus einer anderen Humanstudie während der EVLA (12 Patienten, 810 nm, 12 W, 1-Sekunden-Pulse, 1-Sekunden-Intervalle, Tumeszenztechnik) berichtet, mit Spitzentemperaturen von 43,3°C, 42,0°C und 36,0°C in 3 mm, 5 mm bzw. 10 mm Entfernung von der GSV. 47
Es scheint einen sehr schnellen Temperaturabfall über kurze Entfernungen während der EVLA zu geben. Dies steht wahrscheinlich im Gegensatz zur Hochfrequenzenergie, bei der eine Mikrowellenerwärmung an der Schnittstelle zwischen Gewebe und Elektrode auftritt. Die Daten aus Tierversuchen und beim Menschen deuten darauf hin, dass die während der endovenösen Laserbehandlung erzeugten perivenösen Spitzentemperaturen in den meisten Situationen wahrscheinlich keine dauerhaften Schäden am perivenösen Gewebe verursachen. Die erzeugte Spitzentemperatur wird durch die Verwendung von perivenöser Tumeszenzflüssigkeit reduziert. Diese Ergebnisse scheinen die sehr geringe Inzidenz von Nervenverletzungen und Hautverbrennungen nach EVLA zu erklären. In einer Studie, in der ein 1064-nm-Nd:YAG-Laser verwendet wurde, wurde über eine sehr hohe Inzidenz von Parästhesien bei 36,5 % und Hautverbrennungen bei 4,8 % berichtet.48 Dabei ist zu beachten, dass die abgegebene Energiemenge etwa dreimal so hoch war wie die üblicherweise verwendete und dass die Behandlung ohne Tumeszenzanästhesie durchgeführt wurde. Trotz der niedrigen perivenösen Temperaturen, über die bei der EVLA berichtet wurde, ist zu beachten, dass in bestimmten Fällen, wie z. B. bei Ischiasnerv-Varizen, besondere Vorsicht geboten ist, wenn ein endovenöser Eingriff in Betracht gezogen wird.49,50
GRÖSSERE KOMPLIKATIONEN
Schwere Komplikationen nach der EVLA wurden selten berichtet. Die Raten für tiefe Venenthrombosen (DVT), gepoolt aus mehreren Serien, liegen deutlich unter 1 %.17,18,20,28 Eine Gruppe berichtete über eine Inzidenz der Thrombusausdehnung in die Oberschenkelvene von 7,7 %.51 In dieser Studie wurde die EVLA jedoch unter Vollnarkose oder Spinalanästhesie durchgeführt. Die Tatsache, dass die Patienten nicht in der Lage waren, unmittelbar nach der Operation zu gehen, könnte zu der hohen Inzidenz der Thrombuserweiterung beigetragen haben. Es gibt einen einzigen Bericht über eine arteriovenöse Fistel, die sich nach einer EVLA der kurzen Vena saphena magna (SSV) entwickelte.52 Ein Patient entwickelte eine septische Thrombophlebitis nach einer EVLA in Kombination mit einer offenen Ligatur der Perforatoren und einer Stichphlebektomie.53 Dies klang mit einer Antibiotikabehandlung und einem Débridement ab.
ALTERNATIVE ANSÄTZE
EVLA und Radiofrequenzablation (RFA)54,55 scheinen beide wirksame Behandlungen für die Saphena-Insuffizienz zu sein. Zu den Vorteilen der EVLA gegenüber der RFA gehören eine kürzere Verfahrensdauer und niedrigere Kosten pro Behandlung. Die gemeldeten Verschlussraten der EVLA sind im Allgemeinen etwas höher als die der RFA.56 Zu den Nachteilen der EVLA gehören möglicherweise mehr Blutergüsse und Beschwerden in der frühen postoperativen Phase, obwohl dies von der Technik abhängig sein kann. Beide Techniken werden weiter verfeinert, was die Ergebnisse verbessern wird. Beide Verfahren sind, wenn sie unter Tumeszenzanästhesie durchgeführt werden, mit niedrigen Komplikationsraten verbunden.
Eine weitere neue Behandlungsmethode für den Reflux der Saphena saphena magna ist die Verwendung von geschäumten Sklerosierungsmitteln, die unter Ultraschallkontrolle verabreicht werden. Ein Gas, wie Luft oder CO2, kann mit flüssigen Sklerosierungsmitteln gemischt werden, um einen Schaum zu erzeugen, der schätzungsweise viermal wirksamer ist als die flüssige Form desselben Mittels. Erste Ergebnisse deuten darauf hin, dass dies eine wertvolle Methode ist, da sie schnell und kostengünstig durchgeführt werden kann und kurz- und mittelfristige Erfolgsquoten von 75 % bis 90 % aufweist. Beim Schaum gibt es viele Variablen (z. B. Art und Menge des Gases, Technik der Schaumerzeugung, Konzentration und Art des verwendeten Sklerosierungsmittels, injiziertes Volumen usw.). Das Risiko einer tiefen Venenthrombose kann bei der Schaumsklerotherapie höher sein als bei der Standard-Sklerotherapie. Eine korrekte Technik ist wichtig, um das Risiko dieser Komplikation zu minimieren. Zu den weiteren Nebenwirkungen, die nach einer Schaumsklerotherapie berichtet wurden, gehören visuelle und neurologische Ereignisse. Es gibt einen veröffentlichten Bericht über einen Schlaganfall nach Schaumsklerotherapie (20 ml Polidocanolschaum) bei einem Patienten mit einem 1,8 cm großen Foramen ovale.57 Weitere Erfahrungen und Forschungen mit dieser Methode werden die Risiken und die langfristige Wirksamkeit besser beschreiben.
ZUSAMMENFASSUNG
Die gegenwärtig akzeptierten Prinzipien der Behandlung von Krampfadern dienen dazu, die Ergebnisse aus hämodynamischer und patientenseitiger Sicht zu maximieren und gleichzeitig das Risiko eines Rückfalls zu minimieren. Die angemessene Behandlung von Krampfadern beginnt mit einer genauen Beurteilung der zugrundeliegenden Venenpathologie und der Identifizierung der Quellen der venösen Hypertonie. Zu den Behandlungszielen gehören die Beseitigung der inkompetenten Verbindungen zwischen dem tiefen und dem oberflächlichen System sowie die Verödung der Venenbahnen und der inkompetenten Krampfadern. Es ist offensichtlich, dass die Rezidivrate verringert wird, wenn das inkompetente Segment des Truncus saphenus abgetragen wird.
Die endovenöse Laserablation ist eine weniger invasive Alternative zum Venenstripping. Die Ergebnisse scheinen denen des Strippings zu entsprechen oder besser zu sein, mit besseren Lebensqualitätswerten in der postoperativen Phase. Es hat sich gezeigt, dass EVLA hämodynamische Anomalien bei Patienten mit chronischer Veneninsuffizienz mit oberflächlichem venösen Reflux korrigieren oder deutlich verbessern kann. Erste Berichte deuten darauf hin, dass endovenöse Ablationstechniken im Gegensatz zum chirurgischen Stripping mit einer geringen Inzidenz von Neovaskularisationen verbunden sind.
Die Anwendung der Prinzipien der Tumeszenzanästhesie auf Venenbehandlungen sowie die Entwicklung endovenöser Ablationstechniken bieten die Möglichkeit, die überwiegende Mehrheit der Patienten mit oberflächlicher Veneninsuffizienz ohne Vollnarkose oder chirurgische Schnitte in der Praxis zu behandeln und gleichzeitig die Ergebnisse zu maximieren und das Wiederauftreten zu minimieren.
Diese Arbeit wurde am 29. Juli 2006 eingereicht.

2. Large J. Chirurgische Behandlung von Saphena-Varizen, mit Erhaltung des großen Saphena-Hauptstammes. J Vasc Surg. 1985;2:886-891.
3. Holme JB, Holme K, Sorensen LS. Die anatomische Beziehung zwischen der langen Vena saphena magna und dem Nervus saphenus. Bedeutung für die radikale Krampfaderchirurgie. Acta Chir Scand. 1988;154:631-633.
4. Rutherford RB, Sawyer JD, Jones DN. Das Schicksal der restlichen Vena saphena magna nach teilweiser Entfernung oder Ligatur. J Vasc Surg. 1990;12:422-426.
5. Panetta TF, Marin ML, Veith FJ, et al. Unsuspected preexisting saphenous vein disease: an unrecognized cause of vein bypass failure. J Vasc Surg. 1992;15:102- 110.
6. McMullin GM, Coleridge-Smith PD, Scurr JH. Objective assessment of ligation without stripping the long saphenous vein. Br J Surg. 1991;78:1139-1142.
7. Sarin S, Scurr JH, Coleridge Smith PD. Bewertung des Strippings der langen Vena saphena magna bei der Behandlung von primären Varizen. Br J Surg. 1992;79:889-893.
8. Munn SR, Morton JB, Macbeth WA, McLeish AR. Strippen oder nicht Strippen der langen Vena saphena magna? A varicose vein trial. Br J Surg. 1981;68:426-481.
9. Jones L, Braithwaite BD, Selwyn D, Cooke S, Earnshaw JJ. Neovaskularisation ist die Hauptursache für das Wiederauftreten von Krampfadern: Ergebnisse einer randomisierten Studie zum Stripping der langen Vena saphena magna. Eur J Vasc Endovasc Surg. 1996;12:442-445.
10. Dwerryhouse S, Davies B, Harradine K, Earnshaw JJ. Stripping der langen Vena saphena magna reduziert die Rate der Reoperationen bei rezidivierenden Krampfadern: Fünf-Jahres-Ergebnisse einer randomisierten Studie. J Vasc Surg. 1999;29:589-592.
11. Winterborn RJ, Foy C, Earnshaw JJ. Ursachen für das Wiederauftreten von Krampfadern: Späte Ergebnisse einer randomisierten kontrollierten Studie zum Stripping der langen Vena saphena magna. J Vasc Surg. 2004;40:634-639.
12. Corbett CR, Runcie JJ, Lea TM, Jamieson CW. Gründe für das Strippen der langen Vena saphena magna. Phlebologie. 1988;41:766-769.
13. Neglen P. Treatment of varicosities of saphenous origin: comparison of ligation, selective excision, and sclerotherapy. In: Bergan JJ, Goldman MP eds. Varizen und Telangiektasien: Diagnosis and Treatment. St. Louis, Mo, USA: Quality Medical Publishing; 1993:148-165.
14. Kostas T, Ioannou CV, Touloupakis E, et al. Recurrent varicose veins after surgery: a new appraisal of a common and complex problem in vascular surgery. Eur J Vasc Endovasc Surg. 2004;27:275-282.
15. Van Rij AM, Jones GT, Hill GB, Jiang P. Neovascularization and recurrent varicose veins: more histologic and ultrasound evidence. J Vasc Surg. 2004;40:296-302.
16. Nyamekye I, Shephard NA, Davies B, et al. Clinicopathological evidence that neovascularization is a cause of recurrent varicose veins. Eur J Vasc Endovasc Surg. 1998;15: 412-415.
17. Ravi R, Rodriguez-Lopez JA, Trayler EA, et al. Endovenous ablation of incompetent saphenous veins: a large single-center experience. J Endovasc Ther. 2006;13:244- 248.
18. Min RJ, Khilnani N, Zimmet SE. Endovenöse Laserbehandlung des Refluxes der Vena saphena magna: Langzeitergebnisse. J Vasc Interv Radiol. 2003;14:991-996.
19. Bergan JJ, Rattner Z. Endovenous therapy-2005. Acta Chir Bel. 2005;105:12- 15.
20. Agus GB, Mancini S, Magi G. The first 1000 cases of Italian endovenous-laser Working Group (IEWG). Rationale und Langzeitergebnisse für den Zeitraum 1999-2003. Int Angiol. 2006;25:209-215.
21. Kalra M, Gloviczki P. Vor fünfzehn Jahren sollte der Laser Arterien öffnen, jetzt soll er Venen verschließen: Was ist die Realität hinter dem Gerät? Perspect Vasc Surg Endovasc Ther. 2006;18:3-8 (Diskussion 9- 10).
22. Kabnick LS. Outcome of different endovenous laser wavelengths for great saphenous vein ablation. J Vasc Surg. 2006;43: 88-93.
23. Goldman MP, Maritess M, Rao J. Intravaskulärer 1320-nm-Laserverschluss der Vena saphena magna: eine 6- bis 12-monatige Nachuntersuchung. Dermatol Surg. 2004;30: 1380-1385.
24. Marston WA, Owens LV, Davies S, et al. Endovenous saphenous ablations corrects the hemodynamic abnormality in patients with CEAP clinical class 3-6 CVI due to superficial reflux. Vasc Endovascular Surg. 2006;40:125-130.
25. De Medeiros CA, Luccas GC. Vergleich der endovenösen Behandlung mit einem 810-nm-Laser gegenüber dem konventionellen Stripping der Vena saphena magna bei Patienten mit primären Krampfadern. Dermatol Surg. 2005;31:1685-1694.
26. Mekako AI, Hatfield J, Bryce J, et al. A nonrandomised controlled trial of endovenous laser therapy and surgery in the treatment of varicose veins. Ann Vasc Surg. 2006;Jun 27:.
27. Vuylsteke M, Van den Bussche D, Audenaert EA, Lissens P. Endovenous laser obliteration for the treatment of primary varicose veins. Phlebologie. 2006;21:80-87. 28. Perkowski P, Ravi R, Gowda RC, et al. Endovenöse Laserablation der Vena saphena magna zur Behandlung von Veneninsuffizienz und Krampfadern: Erste Ergebnisse aus einer großen Einzelpraxis. J Endovasc Ther. 2004;11:132-138.
29. Sharif MA, Soong CV, Lau LL, et al. Endovenous laser treatment for long saphenous vein incompetence. Br J Surg. 2006;93:831-835.
30. Proebstle TM, Krummenauer F, Gul D, Knop J. Nonocclusion and early reopening of the great saphenous vein after endovenous laser treatment is fluence dependent. Dermatol Surg. 2004;30:174-178.
31. Timperman PE, Sichlau M, Ryu RK. Höhere Energieabgabe verbessert den Behandlungserfolg der endovenösen Laserbehandlung von inkompetenten Saphenavenen. J Vasc Interv Radiol. 2004;15:1061-1063.
32. Proebstle TM, Sandhofer M, Kargl A, et al. Thermische Schädigung der Veneninnenwand bei endovenöser Laserbehandlung: Schlüsselrolle der Energieabsorption durch intravasales Blut. Dermatol Surg. 2002;28:596-600.
33. Schmedt CG, Sroka R, Steckmeier S, et al. Untersuchung von Radiofrequenz- und Lasereffekten (980 nm) nach endoluminaler Behandlung der Vena saphena magna-Insuffizienz in einem ex-vivo-Modell. Eur J Vasc Endovasc Surg. 2006;Jun 14;.
34. Anderson RR. Endovenous laser: mechanism of action. Paper presented at the Annual Meeting of the American Academy of Dermatology; March 3-7, 2006; San Francisco, California, USA.
35. Izzo F. Other thermal ablation techniques: microwave and interstitial laser ablation of liver tumors. Annals of Surgical Oncology. 2003;10:491-497.
36. Mordon SR, Wassmer B und Zemmouri J. Mathematische Modellierung der endovenösen Laserbehandlung (ELT). BioMedical Engineering OnLine. 2006;5:26. Available at: http://www.biomedical-engineeringonline. com/content/5/1/26. Zugriff am 19. Juli 2006.
37. De-Fei Hong, Shu-You Peng, Song-Ying Li, Li-Min Tong. Experimentelle Studie zur diodelaserinduzierten Thermokoagulation an Lebergewebe mit einer Scanner-Faserspitze. World J Gastroenterol. 2003;9:2350-2352.
38. Zimmet SE. Schmerzen, Blutergüsse und kurzfristige Wirksamkeit nach endovenöser Laserbehandlung der Vena saphena magna: der Einfluss der Operationstechnik und der postoperativen Versorgung. Vortrag auf dem 16. Jahreskongress des American College of Phlebology; Nov 7-10, 2002; Fort Lauderdale, Florida, USA.
39. Proebstle TM, Moehler T, Gul D, Herdemann S. Endovenous treatment of the great saphenous vein using a 1320 nm Nd:YAG laser causes fewer side effects than using a 940 nm diode laser. Dermatol Surg. 2005;31:1678-1683.
40. Weiss RA. Vergleich zwischen endovenöser Radiofrequenz und 810-nm-Diodenlaser-Okklusion großer Venen in einem Tiermodell. Dermatol Surg. 2002;28:56-61.
41. Biesman BS, Khan J. Laser incisional surgery. Clinics in Plastic Surg. 2000;27:213- 220.
42. Moritz AR, Henriques Jr. EC. Studies of thermal injury II: the relative importance of time and surface temperature in the causation of cutaneous bums. Am J Pathol. 1947;23:695-720.
43. Li S, Chien S, Branemark P. Heat shockinduced necrosis and apoptosis in osteoblasts. J Orthop Res. 1999;17:891-899.
44. Jansen W, Haveman J. Histopathologische Veränderungen der Haut und des subkutanen Gewebes von Mäusebeinen nach Behandlung mit Hyperthermie. Path Res Pract. 1990;186: 247-253.
45. Zimmet SE, Min RJ. Temperaturveränderungen im perivenösen Gewebe während einer endovenösen Laserbehandlung in einem Schweinemodell. J Vasc Interv Radiol. 2003;14:911-915.
46. Lahl W. Thermometrische Untersuchungen der perivenösen Temperatur während der endovenösen Lasertherapie von Varizen. Vortrag auf dem 15. Weltkongress der Union Internationale de Phlébologie; 2-7. Oktober 2005; Rio de Janeiro, Brasilien.
47. Beale RJ, Mavor AID, Gough MJ. Wärmeableitung bei der endovenösen Laserbehandlung von Krampfadern – besteht das Risiko einer Nervenverletzung? Phlebology. 2006;21:32-35.
48. Chang CJ, Chua JJ. Endovenöse Laserphotokoagulation (EVLP) bei Krampfadern. Lasers Surg Med. 2002;31:257-262.
49. Ricci S, Georgiev M, Jawien A, Zamboni P. Ischiasnerv-Varizen. Eur J Vasc Endovasc Surg. 2005;29:83-87.
50 Ricci S. Ultraschallbeobachtung des Ischiasnervs und seiner Äste an der Fossa poplitea: immer sichtbar, nie gesehen. Eur J Vasc Endovasc Surg. 2005;30:659-663. 51 Mozes G, Kalra M, Carmo M, Swenson L, Gloviczki P. Extension of saphenous thrombus into the femoral vein: a potential complication of new endovenous ablation techniques. J Vasc Surg. 2005;41:130-135.
52 Timperman, PE. Arteriovenöse Fistel nach endovenöser Laserbehandlung der kurzen Vena saphena magna. J Vasc Interv Radiol. 2004;15:625-627.
53 Dunst KM, Huemer GM, Wayand W, Shamiyeh A. Diffuse phlegmonöse Phlebitis nach endovenöser Laserbehandlung der Vena saphena magna. J Vasc Surg. 2006;43:1056-1058.
54 Lurie F, Creton D, Eklof B, et al. Prospective randomized study of endovenous radiofrequency obliteration (closure procedure) versus ligation and stripping in a selected patient population (EVOLVeS Study). J Vasc Surg. 2003;38:207-214.
55 Merchant RF, DePalma RG, Kabnick LS. Endovaskuläre Obliteration des Saphena-Refluxes: eine multizentrische Studie. J Vasc Surg. 2002;35:1190-1196.
56 Puggioni A, Kalra M, Carmo M, Mozes G, Gloviczki P. Endovenous laser therapy and radiofrequency ablation of the great saphenous vein: analysis of early efficacy and complications. J Vasc Surg. 2005;42; 488-493.
57 Forlee MV, Grouden M, Moore DJ, Shanik G. Stroke after varicose vein foam injection sclerotherapy. J Vasc Surg. 2006;43: 162-164.