Încărcați acest număr Înapoi la rezumat
Steven E. ZIMMET2,3
Austin, SUA
ABSTRACT
Ablația cu laser endovenos (EVLA) este o alternativă mai puțin invazivă la extirparea venelor. Rezultatele par a fi egale sau mai bune decât cele cu stripping, cu scoruri mai bune ale calității vieții în perioada postoperatorie. S-a demonstrat că EVLA corectează sau îmbunătățește semnificativ anomaliile hemodinamice la pacienții cu insuficiență venoasă cronică (IVC) cu reflux venos superficial. Rapoartele timpurii sugerează că tehnicile de ablație endovenoasă, spre deosebire de stripping-ul chirurgical, sunt asociate cu o incidență scăzută a neovascularizării.
O varietate de lungimi de undă sunt utilizate pentru a efectua EVLA. În timp ce cromoforul inițial este apa sau hemoglobina, în funcție de lungimea de undă utilizată, carbonul pare a fi un cromofor secundar, dar cheie, care este probabil independent de lungimea de undă.
Aplicarea principiilor anesteziei tumescente la tratamentele venoase, împreună cu dezvoltarea tehnicilor de ablație endovenoasă, oferă posibilitatea de a trata marea majoritate a pacienților cu vene varicoase în cabinet fără anestezie generală sau incizii chirurgicale, maximizând în același timp rezultatele și minimizând recidiva.
INTRODUCERE
Refluxul venei safene este anomalia primară de bază în majoritatea cazurilor de insuficiență venoasă superficială. Astfel, abordările de tratare a joncțiunii safenofemurale și a incompetenței tronculare safene au dominat gândirea flebologilor. Trendelenburg a descris în anii 1890 ligatura joncțiunii safenofemurale singură, fără a extirpa vena safenă incompetentă. Avantajele ligaturii singure față de ligatură și stripping, care sunt lăudate și astăzi,1 includ conservarea trunchiului safenian pentru o posibilă utilizare viitoare ca grefă de bypass2 și evitarea lezării nervului safenian.3 Ligatura înaltă singură este mai puțin invazivă, mai rapidă și mai simplu de efectuat și este asociată cu o recuperare mai ușoară în comparație cu strippingul venos. Deși este adevărat că aceasta „cruță” în mod obișnuit trunchiul safenian,4 utilizarea unei vene safene bolnave ca și conductă a fost asociată cu un risc crescut de eșec al grefei.5 Cel mai important este faptul că nu mai există nici un dubiu cu privire la faptul că doar ligatura înaltă are ca rezultat, de obicei, un reflux persistent în trunchiul safenian.6,7 Reapariția varicelor este semnificativ redusă7-9 , iar rata de reintervenție este cu 60% până la 70% mai mică dacă vena safenă este extirpată în comparație cu ligatura singură.10,11 De asemenea, după ligatura singură, recidiva sau comunicarea reziduală cu joncțiunea din zona inghinală a fost constatată la 80% dintre pacienți, în timp ce 34% prezentau, de asemenea, incompetență a perforatoarelor de la jumătatea coapsei prin intermediul venei mari safene (GSV) nedecupate.12 După cum a concluzionat Neglen, decuparea GSV a coapsei este esențială pentru a minimiza recidiva care este cauzată de redezvoltarea comunicării incompetente cu confluența safenofemurală și din cauza incompetenței perforatoare a coapsei.13 Pur și simplu, neajunsurile ligaturii singure depășesc avantajele acesteia.
Este important de remarcat faptul că recidiva este frecventă chiar și după ligatura și extirparea venei safene. În timp ce intervenția chirurgicală inadecvată a joncțiunii safenofemurale și progresia bolii sunt mecanisme care explică unele cazuri de recidivă, un alt mecanism important este neovascularizarea în jurul joncțiunii după intervenția chirurgicală venoasă.11,14 De fapt, neovascularizarea a fost raportată ca fiind cauza principală a recidivei,9 canalele neovasculare de dimensiuni, număr și tortuozitate variabile fiind responsabile pentru refluxul spre varicele recurente în majoritatea cazurilor.15 Deși unii și-au exprimat îndoiala cu privire la veridicitatea adevăratei neovascularizații, există dovezi histologice clare că neovascularizația este o cauză a varicelor recurente.16 Rapoartele timpurii sugerează, în schimb, că tehnicile de ablație endovenoasă sunt asociate cu o incidență foarte scăzută a neovascularizației. 17 Este posibil ca dezvoltarea neovascularizației să fie în mare măsură prevenită prin evitarea disecției inghinale și prin păstrarea drenajului venos în afluenții joncționali normali.18,19
EVLA, ca și ablația prin radiofrecvență și scleroterapia cu spumă, este o alternativă mai puțin invazivă la extirparea venelor. EVLA este indicată la un pacient ambulatoriu cu reflux al venei safene mari, mici sau accesorii cu varice de suprafață și/sau simptome sau complicații legate de insuficiența venoasă superficială. EVLA se efectuează de rutină folosind anestezie locală diluată, cu sau fără anxiolitice orale suplimentare, în cabinet. Realizată în general în 30-60 de minute, durata procedurii depinde de lungimea segmentului tratat, de experiența operatorului și de efectuarea sau nu a unor proceduri auxiliare, cum ar fi flebectomia ambulatorie. Indiferent de modul în care este tratată incompetența safenă subiacentă, de obicei sunt necesare tratamente auxiliare pentru a trata varicele reziduale (figura 1).
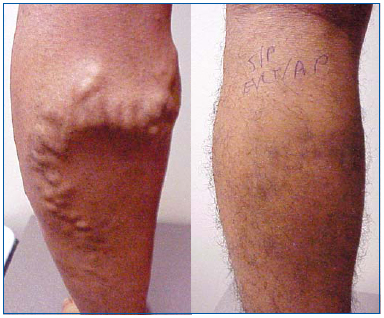
Figura 1. Bărbat de 26 de ani înainte și la o lună după ablația cu laser endovenos a venei safene mari și flebectomia ambulatorie a afluenților varicoși.
EFICIENȚĂ
Studiile pe termen scurt și mediu ale EVLA, indiferent de lungimea de undă utilizată, par remarcabil de consistente, raportând de obicei ablația venelor safene refluxante în 90% sau mai mult din cazuri.18,20-23 S-a demonstrat că EVLA a venei safene corectează sau îmbunătățește semnificativ anomalia hemodinamică și simptomele clinice ale insuficienței venoase cronice (CVI) la pacienții cu reflux venos superficial din clasa clinică 3-6 (Clinical, Etiological, Anatomical, Pathophysiological (CEAP)).24,25 Rezultatele par a fi egale sau mai bune decât cele ale stripping-ului, cu scoruri mai bune ale calității vieții în perioada postoperatorie în comparație cu stripping-ul.20,25-27 Au fost raportate rate ridicate de satisfacție a pacienților.18,28,29 Costul total (costul procedurii plus costul societal) al procedurilor endovenoase este probabil egal sau mai mic decât cel al intervenției chirurgicale.27
Datele timpurii privind tratamentul GSV cu dispozitive de 810 nm și 940 nm sugerează că eșecul tratamentului este neobișnuit la pacienții tratați cu > 70 J/cm.30,31 O rată de retragere de 2 mm/sec la 14 wați furnizează 70 J/cm.
MECANISMUL DE ACȚIUNE
Următoarele lungimi de undă sunt utilizate în prezent pentru EVLA: 810, 940, 980, 1064, 1319, 1320 și 2068 nm. S-a postulat că lezarea peretelui venos este mediată atât prin efect direct, cât și indirect, prin aburul indus de laser generat de încălzirea unor cantități mici de sânge din interiorul venei.32 Unii au sugerat că alegerea lungimii de undă are un mare impact asupra rezultatelor.23
Cromoforul principal al laserelor de 1320 și 2078 nm, cel puțin inițial, este apa, în timp ce alte lungimi de undă utilizate pentru EVLA vizează în principal hemoglobina. În mod evident, este imperativ să se deterioreze termic peretele venos în mod adecvat pentru a obține o ablație eficientă. O anumită încălzire poate avea loc prin absorbția directă a energiei fotonice (radiație) de către peretele venei, precum și prin convecție din bulele de abur și prin conducție din sângele încălzit. Cu toate acestea, este puțin probabil ca aceste din urmă mecanisme să reprezinte majoritatea impactului asupra venei. Temperatura maximă a sângelui este de 100°C. S-a constatat că tratamentul cu laser produce carbonizarea peretelui venei.33 Carbonizarea vârfului laserului, care are loc la aproximativ 300°C, este observată în urma EVLA și pare să apară indiferent de lungimea de undă utilizată.34 Carbonizarea vârfului fibrei laser creează o sursă de căldură punctiformă și reduce practic la zero penetrarea luminii în țesut.34,35 Mordon et al. au afirmat: „Aburul produs prin absorbția energiei laser de către sânge este o fracțiune infimă din energia necesară pentru a deteriora peretele venei și nu poate fi mecanismul principal de lezare a venei cu laser endovenos. Carbonizarea și tractul din pereții venelor observate prin histologie în urma laserului endovenos pot fi doar rezultatul contactului direct dintre vârful fibrei laser și peretele venei. „36 Dr. Rox Anderson, director al Centrului Wellman pentru fotomedicină de la Massachusetts General Hospital, a raportat că carbonul pare a fi un cromofor secundar, dar esențial, care este probabil independent de lungimea de undă (Figura 2).34 Rețineți că vârful și forma fibrei pot avea un impact asupra dezvoltării carbonizării.37

Figura 2. Carbonizarea vârfului fibrei laser de 600 microni secundară ablației cu laser endovenos cu un laser de 1320 nm (Fotografie realizată prin amabilitatea lui Mark Forrestal, MD, FACPh).
ANESTEZIE TUMORALĂ
EVLA trebuie efectuată sub anestezie locală folosind volume mari de o soluție diluată de lidocaină și epinefrină (volum mediu de 200-400 ml de lidocaină 0,1% cu 1:1.000.000 de epinefrină) care este tamponată cu bicarbonat de sodiu. Această soluție trebuie administrată fie manual, fie cu o pompă de perfuzie sub ghidaj ecografic, astfel încât vena să fie înconjurată cu lichidul anestezic pe întreaga lungime a segmentului care urmează să fie tratat (figura 3).
Beneficiile anesteziei tumescente pentru ablația endovenoasă includ:
– anestezie,
– separarea venei care urmează să fie tratată de structurile înconjurătoare,
– scufundare termică, care reduce vârfurile de temperatură în țesuturile perivenoase,
– comprimarea venei, care maximizează efectul tratamentului asupra peretelui venos.
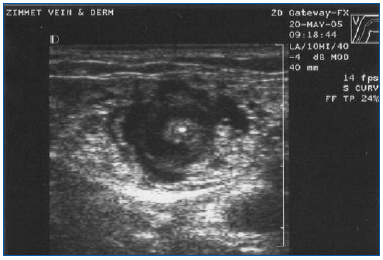
Figura 3. Imagine ecografică transversală a lichidului anestezic tumescent care înconjoară vena safenă mare situată central și fibra/cămașa laser.
Deși doza maximă sigură de lidocaină folosind tehnica tumescentă pentru proceduri venoase nu este bine studiată, o doză de 35 mg/kg este o estimare rezonabilă.
Utilizând acești parametri, anestezia tumescentă în contextul liposucției s-a dovedit a fi extraordinar de sigură. Mai multe informații sunt disponibile la http://www.liposuction.com/pharmacology/drug_inter act.php.
CONTRAINDICAȚII LA EVLA
Contraindicațiile tehnicii EVLA sunt estivate în tabelul I.

Tabel I. Contraindicații la laserul endovenos.
SEQUELAȚII ADVERSE
Durerea pe termen scurt și echimozele au fost frecvent observate după EVLA. S-a raportat, într-o analiză retrospectivă, că retragerea intermitentă a fibrelor laser cu impulsuri intermitente a cauzat niveluri semnificativ mai mari de durere și echimoze postoperatorii, comparativ cu un protocol de retragere continuă.38 Adăugarea unui bandaj cu întindere scurtă timp de 3 zile după EVLA în mod intermitent a redus substanțial echimozele și durerea raportate de pacienți. Angajarea pullback-ului în mod continuu a redus și mai mult severitatea durerii și a echimozelor într-o asemenea măsură încât nivelurile au fost similare cu cele raportate de pacienții tratați cu ablația prin radiofrecvență (tabelele II și III). Rapoartele preliminare sugerează că ar putea exista unele diferențe în evoluția postoperatorie în funcție de lungimea de undă utilizată pentru a efectua EVLA.22,39 Cu toate acestea, acest lucru se bazează pe date puține cu urmărire pe termen scurt.
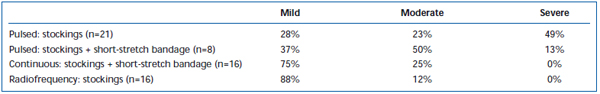
Tabel II. Vânătăi postoperatorii evaluate de pacienți la 3-7 zile după ablația cu laser endovenos pulsat (EVLA) cu ciorapi de clasa II, EVLA pulsat cu ciorapi plus bandaj cu întindere scurtă, EVLA în mod continuu cu ciorapi și bandaj cu întindere scurtă și ablația cu radiofrecvență cu ciorapi.
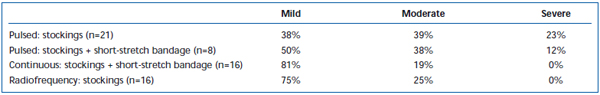
Tabel III. Durerea postoperatorie evaluată de pacienți la 3-7 zile după ablația cu laser endovenos pulsat (EVLA) cu ciorapi de clasa II, EVLA pulsat cu ciorapi plus bandaj cu întindere scurtă, EVLA în mod continuu cu ciorapi și bandaj cu întindere scurtă și ablația prin radiofrecvență cu ciorapi.
LEGIMENTE TERMICE PERIVENE
Temperaturi intravasculare maxime medii în timpul EVLA (vena jugulară de capră, 12 wați, impulsuri de 1 secundă, intervale de 1 secundă), măsurate la nivelul vârfului laser, au fost în medie de 729°C, în timp ce cele la 4 mm distal de vârf au fost în medie de 93°C.40 Cu toate acestea, riscul de leziuni termice colaterale depinde de încălzirea țesutului perivenos, nu de temperatura intravasculară.
S-a observat că colagenul se contractă la aproximativ 50°C, în timp ce necroza apare între 70°C și 100°C.41 Gradul de leziune termică a țesutului depinde în mare măsură de cantitatea și durata de căldură la care este expus țesutul. Henriques și Moritz au investigat răspunsul timp-temperatură pentru țesuturile expuse la temperaturi de până la 70°C.42 Aceștia au constatat că pielea poate rezista la creșteri de temperatură pentru perioade de expunere foarte scurte și că răspunsul pare să fie logaritmic pe măsură ce timpul de expunere devine mai scurt. De exemplu, o creștere a temperaturii corpului la 58°C va produce distrugerea celulelor dacă expunerea durează mai mult de 10 secunde. Cu toate acestea, țesuturile pot rezista la temperaturi de până la 70°C dacă durata expunerii este menținută pentru mai puțin de 1 secundă. Li et al. au raportat că încălzirea celulelor endoteliale la 48°C timp de 10 minute nu a indus moartea celulară.43 Aceștia au constatat, de asemenea, că osteoblastele, după o expunere de 10 minute sau mai puțin la 45°C, au suferit modificări tranzitorii și reversibile. Un alt studiu a constatat leziuni tisulare reversibile la nivelul membrelor posterioare ale șoarecilor după scufundarea într-o baie de apă la 44°C.44
Un studiu recent a măsurat temperatura de vârf la nivelul peretelui exterior al venei în timpul EVLA într-o venă vie a urechii de porc și în venele membrelor posterioare expuse.45 Setările EVLA au variat de la 8 wați (durata impulsurilor de 1-2 secunde), 10 wați (durata impulsurilor de 1-1,5 secunde), 12 wați (durata impulsurilor de 0,5-1,5 secunde) la 15 wați (durata impulsurilor de 0,5-1,0 secunde), cu și fără anestezie tumescentă. Rezultatele demonstrează că temperaturile de vârf au variat de la 34,6°C la 49,1°C în funcție de jouli livrați, cu temperaturi de vârf mai scăzute obținute atunci când a fost prezent lichidul tumescent (Figura 4).
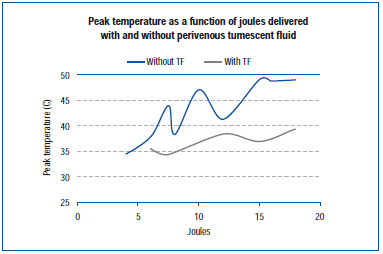
Figura 4. Adaptat după Zimmet SE, Min RJ. Modificări de temperatură în țesutul perivenos în timpul tratamentului cu laser endovenos într-un model porcin. J Vasc Interv Radiol. 2003;14:911-915 (ref 45).
Temperatura de vârf măsurată în timpul EVLA (63 de pacienți, 980 nm, 15 wați, impulsuri de 1,5 sec) la nivelul peretelui venos extern la om, la 3 cm sub joncțiunea safenofemurală, a fost de 40,9°C și 49,8°C cu și, respectiv, fără lichid tumescent.46 Rezultate similare au fost raportate de un alt studiu la om în timpul EVLA (12 pacienți, 810 nm, 12 W, impulsuri de 1 secundă, intervale de 1 secundă, tehnică tumescentă), cu temperaturi maxime de 43,3°C, 42,0°C și 36,0°C la 3 mm, 5 mm și, respectiv, 10 mm de GSV. 47
Se pare că există o scădere foarte rapidă a temperaturii pe distanțe scurte în timpul EVLA. Acest lucru este probabil în contrast cu energia de radiofrecvență, unde încălzirea cu microunde are loc în jurul interfeței țesut-electrod. Datele obținute la animale și la om sugerează că este puțin probabil ca temperaturile maxime perivenoase generate în timpul laserului endovenos să provoace leziuni permanente ale țesutului perivenos în majoritatea situațiilor. Temperatura maximă generată este redusă prin utilizarea lichidului tumescent perivenos. Aceste constatări par să explice incidența foarte scăzută raportată a leziunilor nervoase și a arsurilor cutanate în urma EVLA. Un studiu, care a utilizat un laser Nd: YAG de 1064 nm, a raportat o incidență foarte mare a paresteziei la 36,5% și a arsurilor cutanate la 4,8%.48 Trebuie remarcat faptul că cantitatea de energie administrată a fost de aproximativ trei ori mai mare decât cea utilizată în mod obișnuit și că tratamentul a fost efectuat fără anestezie tumescentă. În ciuda temperaturilor perivenoase scăzute raportate cu EVLA, este important de menționat că este necesară o precauție specială atunci când se ia în considerare intervenția endovenoasă în anumite cazuri, cum ar fi varicele nervului sciatic.49,50
COMPLICAȚII MAJORE
Complicațiile majore în urma EVLA au fost raportate rar. Ratele de tromboză venoasă profundă (TVP), reunite din mai multe serii, sunt mult mai mici de 1%.17,18,20,28 Un grup a raportat o incidență a extinderii trombului în vena femurală de 7,7%.51 Cu toate acestea, în acel studiu, EVLA a fost efectuată sub anestezie generală sau spinală. Faptul că pacienții nu au putut să se deplaseze imediat după operație poate să fi contribuit la incidența ridicată a extinderii trombilor. Există o singură raportare a unei fistule arterio-venoase care s-a dezvoltat în urma EVLA a venei safene scurte (SSV).52 Un pacient a dezvoltat tromboflebită septică în urma EVLA combinată cu ligatura deschisă a perforantelor și flebectomie înjunghiată.53 Aceasta s-a rezolvat cu tratament antibiotic și debridare.
ABORDĂRI ALTERNATIVE
EVLA și ablația prin radiofrecvență (RFA)54,55 ambele par a fi tratamente eficiente pentru incompetența safenă. Avantajele EVLA față de RFA includ timpi de procedură mai scurți și un cost per tratament mai mic. Ratele de ocluzie raportate de EVLA sunt, în general, ușor mai mari decât cele obținute cu RFA.56 Dezavantajele EVLA pot include mai multe vânătăi și disconfort în perioada postoperatorie timpurie, deși acest lucru poate depinde de tehnică. Ambele tehnici continuă să fie perfecționate, ceea ce va îmbunătăți rezultatele. Ambele proceduri, atunci când sunt efectuate folosind anestezie tumescentă, sunt asociate cu rate scăzute de complicații.
Un alt tratament emergent pentru refluxul safenian este utilizarea sclerozantelor spumoase administrate sub control cu ultrasunete. Un gaz, cum ar fi aerul sau CO2, poate fi amestecat cu sclerosanți detergenți lichizi pentru a crea o spumă, estimată a fi de aproximativ patru ori mai puternică decât forma lichidă a aceluiași agent. Primele rezultate sugerează că aceasta ar putea fi o modalitate valoroasă, deoarece este rapidă și puțin costisitoare, cu rate de succes pe termen scurt și mediu de aproximativ 75% până la 90%. Există multe variabile în ceea ce privește spuma (de exemplu, tipul și cantitatea de gaz, tehnica utilizată pentru a crea spuma, concentrația și tipul de sclerosant utilizat, volumul injectat etc.). Poate exista un risc mai mare de tromboză venoasă profundă în urma scleroterapiei cu spumă în comparație cu scleroterapia standard. O tehnică adecvată este importantă pentru a minimiza riscul acestei complicații. Alte efecte secundare raportate în urma scleroterapiei cu spumă includ evenimente vizuale și neurologice. Există un raport publicat de accident vascular cerebral în urma scleroterapiei cu spumă (20 ml de spumă de polidocanol) la un pacient cu un patent foramen ovale de 1,8 cm.57 Experiența și cercetările ulterioare cu această modalitate vor delimita mai bine riscurile sale, precum și eficacitatea pe termen lung.
CONCLUZIE
Principiile acceptate în prezent ale tratamentului venelor varicoase servesc la maximizarea rezultatelor din punct de vedere hemodinamic și al pacientului, minimizând în același timp riscul de recidivă. Tratamentul adecvat al venelor varicoase începe cu o evaluare precisă a patologiei venoase subiacente și cu identificarea surselor de hipertensiune venoasă. Obiectivele tratamentului includ eliminarea conexiunilor incompetente dintre sistemele profunde și superficiale, precum și obliterarea căilor de incompetență venoasă și a varicelor incompetente. Este evident că recidiva este redusă dacă segmentul incompetent al trunchiului safenian este ablatat.
Ablația cu laser endovenos este o alternativă mai puțin invazivă la extirparea venelor. Rezultatele par a fi egale sau mai bune decât cele ale strippingului, cu scoruri mai bune ale calității vieții în perioada postoperatorie. S-a demonstrat că EVLA corectează sau îmbunătățește semnificativ anomaliile hemodinamice la pacienții cu insuficiență venoasă cronică cu reflux venos superficial. Rapoartele timpurii sugerează că tehnicile de ablație endovenoasă, spre deosebire de stripping-ul chirurgical, sunt asociate cu o incidență scăzută a neovascularizării.
Aplicarea principiilor anesteziei tumescente la tratamentele venoase, împreună cu dezvoltarea tehnicilor de ablație endovenoasă, oferă posibilitatea de a trata marea majoritate a pacienților cu insuficiență venoasă superficială în cabinet, fără anestezie generală sau incizii chirurgicale, maximizând în același timp rezultatele și minimizând recidiva.
Acest articol a fost prezentat în 29 iulie 2006.

2. Large J. Tratamentul chirurgical al varicelor safene, cu păstrarea trunchiului principal al safenei mari. J Vasc Surg. 1985;2:886-891.
3. Holme JB, Holme K, Sorensen LS. Relația anatomică dintre vena safena mare și nervul safenian. Relevanță pentru chirurgia radicală a venelor varicoase. Acta Chir Scand. 1988;154:631-633.
4. Rutherford RB, Sawyer JD, Jones DN. Soarta venei safene reziduale după îndepărtarea sau ligaturarea parțială. J Vasc Surg. 1990;12:422-426.
5. Panetta TF, Marin ML, Veith FJ, et al. Boala preexistentă nesuspectată a venei safene: o cauză nerecunoscută a eșecului bypass-ului venos. J Vasc Surg. 1992;15:102- 110.
6. McMullin GM, Coleridge-Smith PD, Scurr JH. Evaluarea obiectivă a ligaturii fără stripping a venei safene lungi. Br J Surg. 1991;78:1139-1142.
7. Sarin S, Scurr JH, Coleridge Smith PD. Evaluarea extirpării venei safene lungi în tratamentul varicelor primare. Br J Surg. 1992;79:889-893.
8. Munn SR, Morton JB, Macbeth WA, McLeish AR. A dezbrăca sau a nu dezbrăca vena safenă lungă? Un studiu asupra venelor varicoase. Br J Surg. 1981;68:426-481.
9. Jones L, Braithwaite BD, Selwyn D, Cooke S, Earnshaw JJ. Neovascularizarea este cauza principală a recidivei venelor varicoase: rezultatele unui studiu randomizat de extirpare a venei safene lungi. Eur J Vasc Endovasc Surg. 1996;12:442-445.
10. Dwerryhouse S, Davies B, Harradine K, Earnshaw JJ. Decuparea venei safene lungi reduce rata de reoperare pentru vene varicoase recurente: rezultatele la cinci ani ale unui studiu randomizat. J Vasc Surg. 1999;29:589-592.
11. Winterborn RJ, Foy C, Earnshaw JJ. Cauzele recidivei venelor varicoase: rezultate târzii ale unui studiu randomizat controlat de extirpare a venei safene lungi. J Vasc Surg. 2004;40:634-639.
12. Corbett CR, Runcie JJ, Lea TM, Jamieson CW. Motive pentru decaparea venei safene lungi. Phlebologie. 1988;41:766-769.
13. Neglen P. Tratamentul varicelor de origine safenă: comparație între ligatură, excizie selectivă și scleroterapie. În: S: Bergan JJ, Goldman MP eds. Varice și telangiectazii: Diagnostic și tratament. St. Louis, Mo, SUA: Quality Medical Publishing; 1993:148-165.
14. Kostas T, Ioannou CV, Touloupakis E, et al. Varice recurente după operație: o nouă evaluare a unei probleme comune și complexe în chirurgia vasculară. Eur J Vasc Endovasc Surg. 2004;27:275-282.
15. Van Rij AM, Jones GT, Hill GB, Jiang P. Neovascularizarea și venele varicoase recurente: mai multe dovezi histologice și ecografice. J Vasc Surg. 2004;40:296-302.
16. Nyamekye I, Shephard NA, Davies B, et al. Dovezi clinico-patologice că neovascularizarea este o cauză a venelor varicoase recurente. Eur J Vasc Endovasc Surg. 1998;15: 412-415.
17. Ravi R, Rodriguez-Lopez JA, Trayler EA, et al. Ablația endovenoasă a venelor safene incompetente: o experiență mare într-un singur centru. J Endovasc Ther. 2006;13:244- 248.
18. Min RJ, Khilnani N, Zimmet SE. Tratamentul cu laser endovenos al refluxului venei safene: rezultate pe termen lung. J Vasc Interv Radiol. 2003;14:991-996.
19. Bergan JJ, Rattner Z. Endovenous therapy-2005. Acta Chir Bel. 2005;105:12- 15.
20. Agus GB, Mancini S, Magi G. Primele 1000 de cazuri ale Grupului de lucru italian pentru laser endovenos (IEWG). Raționament, și rezultate pe termen lung pentru perioada 1999-2003. Int Angiol. 2006;25:209-215.
21. Kalra M, Gloviczki P. În urmă cu cincisprezece ani, laserul trebuia să deschidă arterele, acum se presupune că trebuie să închidă venele: care este realitatea din spatele acestui instrument? Perspect Vasc Surg Endovasc Ther. 2006;18:3-8 (discuție 9- 10).
22. Kabnick LS. Rezultatul diferitelor lungimi de undă ale laserului endovenos pentru ablația venei safene mari. J Vasc Surg. 2006;43: 88-93.
23. Goldman MP, Maritess M, Rao J. Închiderea intravasculară cu laser de 1320 nm a venei mari safene: un studiu de urmărire de la 6 la 12 luni. Dermatol Surg. 2004;30: 1380-1385.
24. Marston WA, Owens LV, Davies S, et al. Ablația safenoasă endovenoasă corectează anomalia hemodinamică la pacienții cu CVI clasa clinică CEAP 3-6 din cauza refluxului superficial. Vasc Endovascular Surg. 2006;40:125-130.
25. De Medeiros CA, Luccas GC. Comparația tratamentului endovenos cu un laser de 810 nm versus stripping convențional al venei safene mari la pacienții cu varice primare. Dermatol Surg. 2005;31:1685-1694.
26. Mekako AI, Hatfield J, Bryce J, et al. A nonrandomised controlled trial of endovenous laser therapy and surgery in the treatment of varicose venins. Ann Vasc Surg. 2006;Jun 27:.
27. Vuylsteke M, Van den Bussche D, Audenaert EA, Lissens P. Endovenous laser obliteration for the treatment of primary varicose venins. Flebologie. 2006;21:80-87. 28. Perkowski P, Ravi R, Ravi R, Gowda RC, et al. Ablația cu laser endovenos a venei safene pentru tratamentul insuficienței venoase și a venelor varicoase: rezultate timpurii dintr-o experiență mare într-un singur centru. J Endovasc Ther. 2004;11:132-138.
29. Sharif MA, Soong CV, Lau LL, et al. Tratamentul cu laser endovenos pentru incompetența venei safene lungi. Br J Surg. 2006;93:831-835.
30. Proebstle TM, Krummenauer F, Gul D, Knop J. Nonocluzia și redeschiderea timpurie a venei safene mari după tratamentul cu laser endovenos este dependentă de fluență. Dermatol Surg. 2004;30:174-178.
31. Timperman PE, Sichlau M, Ryu RK. O livrare mai mare de energie îmbunătățește succesul tratamentului cu laser endovenos al venelor safene incompetente. J Vasc Interv Radiol. 2004;15:1061-1063.
32. Proebstle TM, Sandhofer M, Kargl A, et al. Deteriorarea termică a peretelui venos intern în timpul tratamentului cu laser endovenos: rolul cheie al absorbției energiei de către sângele intravascular. Dermatol Surg. 2002;28:596-600.
33. Schmedt CG, Sroka R, Steckmeier S, et al. Investigation on radiofrequency and laser (980 nm) effects after endoluminal treatment of saphenous vein insufficiency in an ex-vivo model. Eur J Vasc Endovasc Surg. 2006;Jun 14;.
34. Anderson RR. Laser endovenos: mecanism de acțiune. Lucrare prezentată la Reuniunea anuală a Academiei Americane de Dermatologie; 3-7 martie 2006; San Francisco, California, SUA.
35. Izzo F. Alte tehnici de ablație termică: ablația cu microunde și laser interstițial a tumorilor hepatice. Analele de oncologie chirurgicală. 2003;10:491-497.
36. Mordon SR, Wassmer B și Zemmouri J. Modelarea matematică a tratamentului endovenos cu laser (ELT). BioMedical Engineering OnLine. 2006;5:26. Disponibil la: http://www.biomedical-engineeringonline. com/content/5/1/26. Accesat la 19 iulie 2006.
37. De-Fei Hong, Shu-You Peng, Song-Ying Li, Li-Min Tong. Experimental study of diodelaser induced termocoagulation on hepatic tissue with scanner fiber tip. World J Gastroenterol. 2003;9:2350-2352.
38. Zimmet SE. Durere, echimoze și eficacitate pe termen scurt după tratamentul cu laser endovenos al venei safene mari: efectul tehnicii operatorii și al îngrijirii postoperatorii. Lucrare prezentată la al 16-lea Congres anual al Colegiului American de Flebologie; 7-10 noiembrie 2002; Fort Lauderdale, Florida, SUA.
39. Proebstle TM, Moehler T, Gul D, Herdemann S. Tratamentul endovenos al venei mari safene cu ajutorul unui laser Nd:YAG de 1320 nm provoacă mai puține efecte secundare decât utilizarea unui laser cu diode de 940 nm. Dermatol Surg. 2005;31:1678-1683.
40. Weiss RA. Compararea ocluziei cu radiofrecvență endovenoasă versus ocluzia cu laser cu diode de 810 nm a venelor mari într-un model animal. Dermatol Surg. 2002;28:56-61.
41. Biesman BS, Khan J. Chirurgia incizională cu laser. Clinics in Plastic Surg. 2000;27:213- 220.
42. Moritz AR, Henriques Jr EC. Studii de leziuni termice II: importanța relativă a timpului și a temperaturii de suprafață în provocarea bumelor cutanate. Am J Pathol. 1947;23:695-720.
43. Li S, Chien S, Branemark P. Necroza și apoptoza induse de șocul termic în osteoblaste. J Orthop Res. 1999;17:891-899.
44. Jansen W, Haveman J. Modificări histopatologice în pielea și țesuturile subcutanate ale picioarelor de șoarece după tratamentul cu hipertermie. Path Res Pract. 1990;186: 247-253.
45. Zimmet SE, Min RJ. Modificări de temperatură în țesutul perivenos în timpul tratamentului cu laser endovenos într-un model porcin. J Vasc Interv Radiol. 2003;14:911-915.
46. Lahl W. Investigații termometrice ale temperaturii perivenoase în timpul tratamentului cu laser endovenos al venelor varicoase. Lucrare prezentată la al 15-lea Congres Mondial al Uniunii Internaționale de Flebologie; 2-7 octombrie 2005; Rio de Janeiro, Brazilia.
47. Beale RJ, Mavor AID, Gough MJ. Disiparea căldurii în timpul tratamentului cu laser endovenos al venelor varicoase – există un risc de lezare a nervilor? Phlebology. 2006;21:32-35.
48. Chang CJ, Chua JJ. Fotocoagularea cu laser endovenos (EVLP) pentru venele varicoase. Lasers Surg Med. 2002;31:257-262.
49. Ricci S, Georgiev M, Jawien A, Zamboni P. Varicele nervului sciatic. Eur J Vasc Endovasc Surg. 2005;29:83-87.
50. Ricci S. Observarea cu ultrasunete a nervului sciatic și a ramurilor sale la nivelul fosei popliteale: întotdeauna vizibil, niciodată văzut. Eur J Vasc Endovasc Surg. 2005;30:659-663. 51 Mozes G, Kalra M, Carmo M, Swenson L, Gloviczki P. Extinderea trombului safenian în vena femurală: o potențială complicație a noilor tehnici de ablație endovenoasă. J Vasc Surg. 2005;41:130-135.
52 Timperman, PE. Fistulă arteriovenoasă după tratamentul endovenos cu laser al venei safene scurte. J Vasc Interv Radiol. 2004;15:625-627.
53 Dunst KM, Huemer GM, Wayand W, Shamiyeh A. Flebită flegmonoasă difuză după tratamentul cu laser endovenos al venei safene mari. J Vasc Surg. 2006;43:1056-1058.
54 Lurie F, Creton D, Eklof B, et al. Studiu prospectiv randomizat al obliterării cu radiofrecvență endovenoasă (procedura de închidere) față de ligatură și stripping la o populație selectată de pacienți (Studiul EVOLVeS). J Vasc Surg. 2003;38:207-214.
55 Merchant RF, DePalma RG, Kabnick LS. Obliterarea endovasculară a refluxului safenian: un studiu multicentric. J Vasc Surg. 2002;35:1190-1196.
56 Puggioni A, Kalra M, Carmo M, Mozes G, Gloviczki P. Terapia endovenoasă cu laser și ablația prin radiofrecvență a venei mari safene: analiza eficacității timpurii și a complicațiilor. J Vasc Surg. 2005;42;488-493.
57 Forlee MV, Grouden M, Moore DJ, Shanik G. Accident vascular cerebral după scleroterapie cu injecție de spumă în vene varicoase. J Vasc Surg. 2006;43: 162-164.
>.